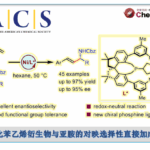
概要
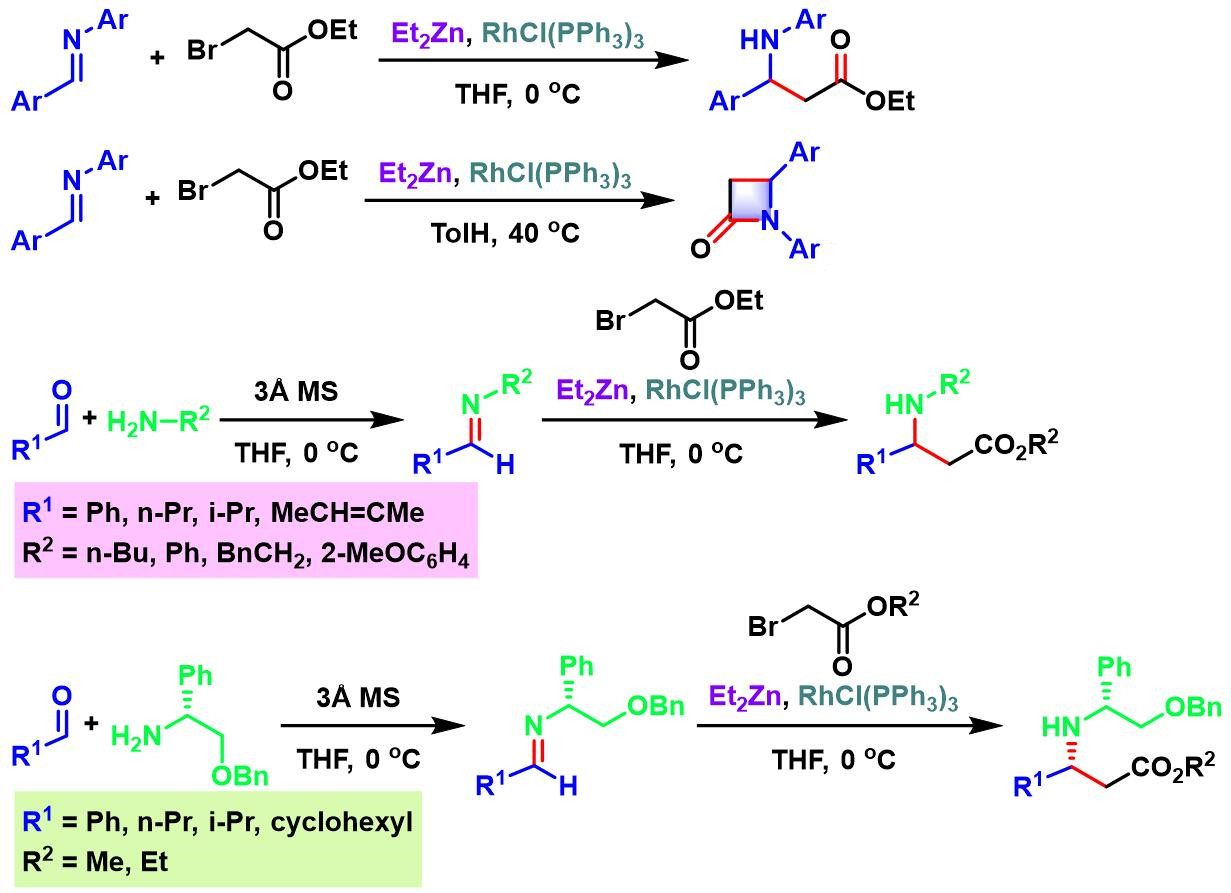
2000年,日本Hoshi大学制药科学部的Honda (星薬科大学薬品製造化学教室, Faculty of Pharmaceutical Sciences, Hoshi University, 本多 利雄, Honda Toshio)研究室首次报道了通过Wilkinson催化剂与二乙基锌促进的分子内与分子间Reformasky反应[1],并获得良好的产率 (41-82%)。然而,研究表明,对于分子间反应,无法获得优良的立体选择性 (syn/anti 1:1) [1]。
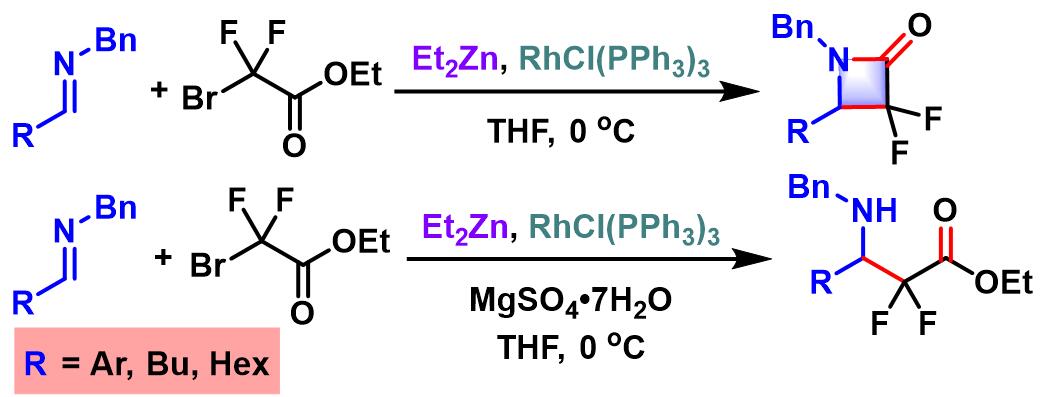
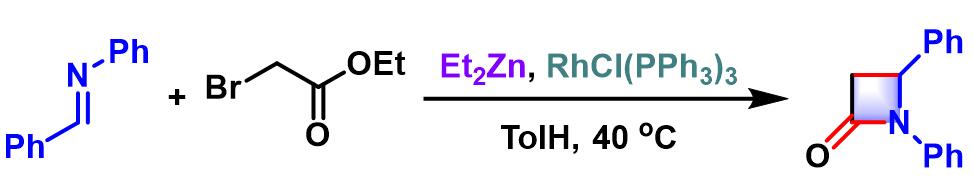
 2002年,Honda进一步将上述条件扩展至醛亚胺,并观察到溶剂效应的显著影响,采用THF与甲苯,分别可以获得相应的β-氨基酸酯与β-内酰胺[2]。之后,Honda发现通过醛与胺 (原位生成醛亚胺)及溴乙酸酯的三组分一锅反应,同样可以中等产率获得β-氨基酸酯[3]。并且,采用手性胺参与反应,可以顺利完成手性氨基酸酯的合成[3]。
2002年,Honda进一步将上述条件扩展至醛亚胺,并观察到溶剂效应的显著影响,采用THF与甲苯,分别可以获得相应的β-氨基酸酯与β-内酰胺[2]。之后,Honda发现通过醛与胺 (原位生成醛亚胺)及溴乙酸酯的三组分一锅反应,同样可以中等产率获得β-氨基酸酯[3]。并且,采用手性胺参与反应,可以顺利完成手性氨基酸酯的合成[3]。
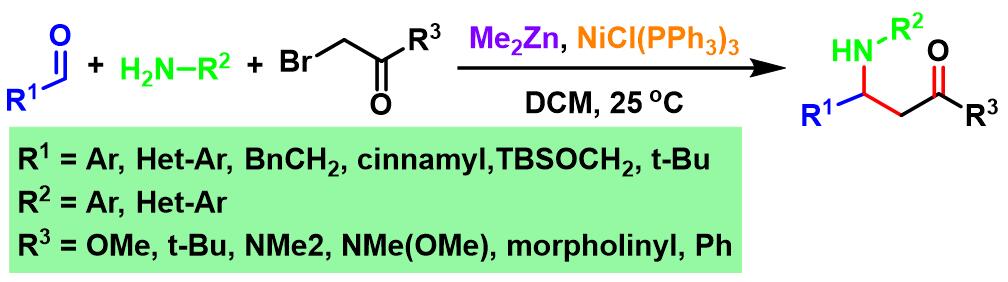
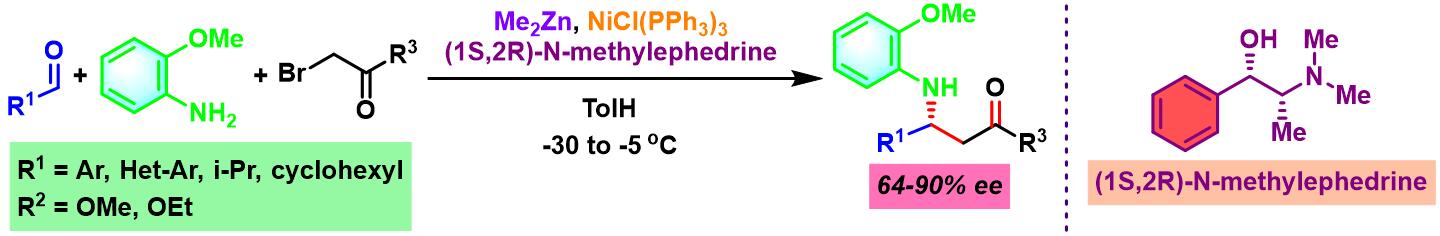
2003年,J. C. Adrian研究组发现采用镍催化剂NiCl(PPh3)3,同样可以完成醛与胺及溴乙酸酯的三组分一锅反应,并使β-氨基酸酯的产率获得更大提升 (81-97%)[4]。
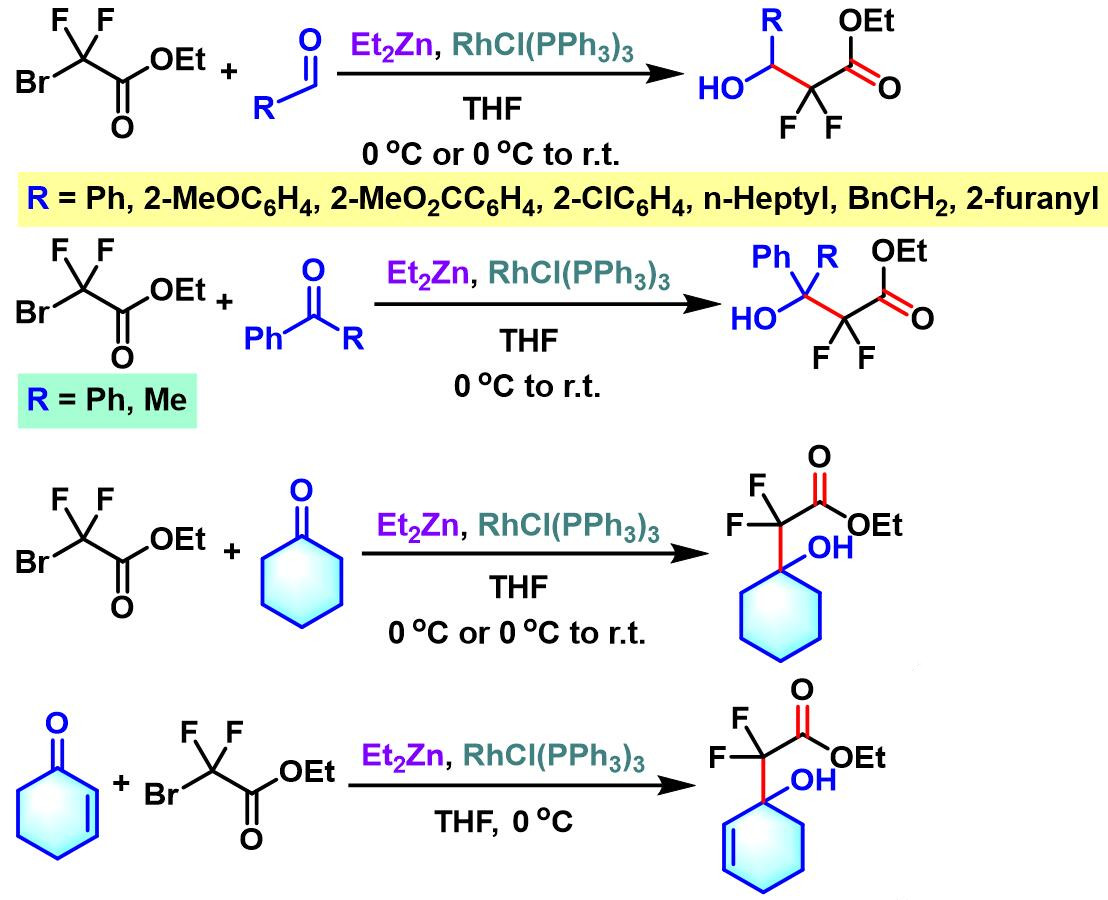
2004年,Kumadaki (熊懐 稜丸, 摂南大学薬品製造化学教室, Kumadaki Itsumaro, Faculty of Pharmaceutical Sciences, Setsunan University)将上述条件应用于溴代二氟乙酸酯。研究发现,对于酮底物,反应同样可以获得优良的产率[5]。因此,有效解决了溴代二氟乙酸乙酯与酮反应时,产率较低的问题[6]-[8]。
同时, Kumadaki对上述反应条件进行了进一步研究与改进,将其成功应用于3-氨基-2,2-二氟羧酸酯与二氟-β-内酰胺的合成[9]。
2005年,P. G. Cozzi采用手性(1S,2R)-N-methylephedrine配体,完成了首例由镍试剂/有机锌体系促进的对映选择性一锅三组分亚胺Reformatsky反应 (imino-Reformatsky reaction)[10]。
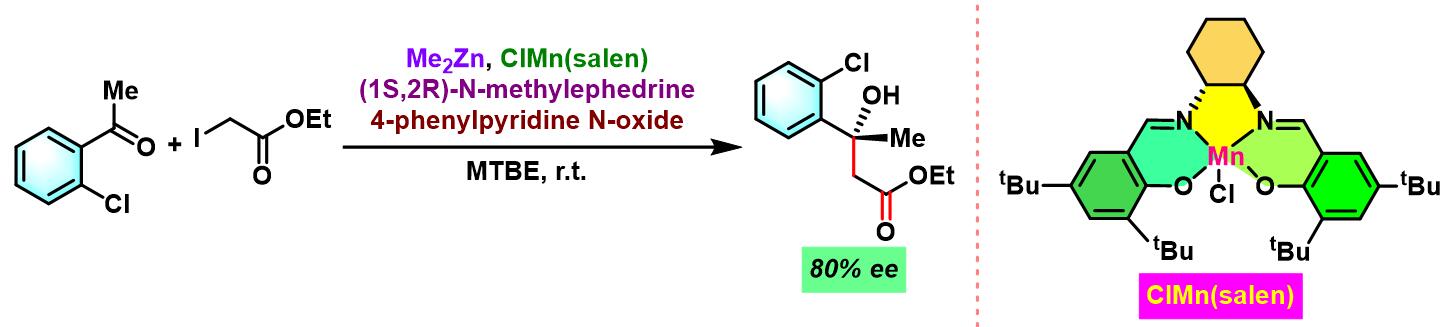
2006年,P. G. Cozzi采用手性锰催化剂ClMn(salen),成功实现首例由金属催化剂促进的对映选择性Reformasky反应[11]。
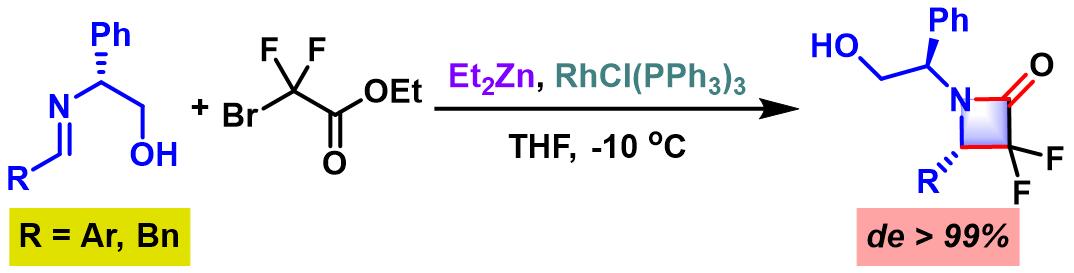
2007年,Ando (安藤 章,摂南大学薬品製造化学教室, Akira Ando, Faculty of Pharmaceutical Sciences, Setsunan University)通过Wilkinson催化剂/二乙基锌体系促进的具有(R)-2-羟基-1-苯乙基 (作为手性辅基)取代的亚胺与溴代二氟乙酸酯之间的Reformatsky反应,成功获得手性二氟-β-内酰胺[12]。
之后,Ando发现采用䓝基 (作为手性辅基)取代的溴代二氟乙酸酯,同样可以较好的对映选择性获得手性二氟-β-内酰胺[13]。
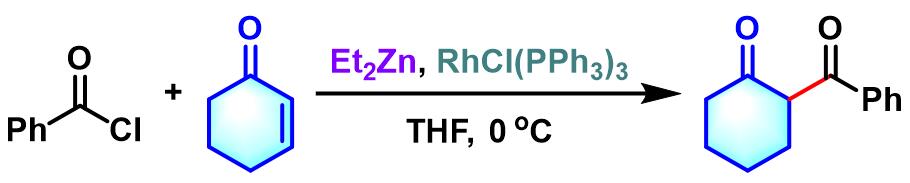
2008年,Ando将Honda的反应条件进一步应用于酰氯与α, β-不饱和酮的还原偶联,顺利完成1,3-二酮的合成[14]。
之后,Ando发现采用单氟二溴代乙酸酯,可以立体选择性地构建α-溴-α-氟-β-内酰胺。同时,Ando对其反应机理进行了深入研究[15]。
2010年,P. G. Cozzi发现在手性配体N-pyrrolidinyl norephedrine存在下,采用CuCN-dppp配合物/有机锌体系,同样可以有效地实现碘乙酸酯与官能团化的酮之间的对映选择性Reformasky反应[16]。
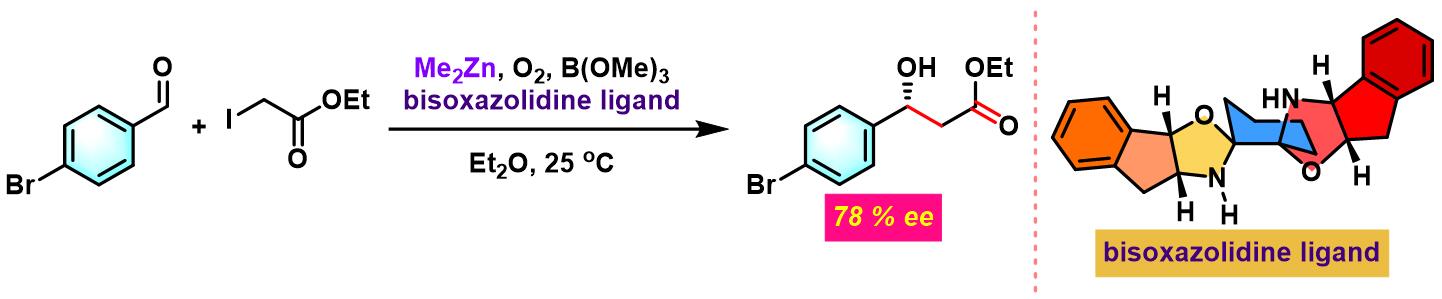
2011年,C. Wolf 研究发现,通过采用新发展的手性双噁唑啉配体/B(OMe)3/有机锌体系,同样可以获得较好的对映选择性[17]。同时,反应条件更加温和[17]。
2012年,Ando进一步将底物范围扩展至α, β-不饱和酯,并顺利完成β-酮酸酯的合成[18]。
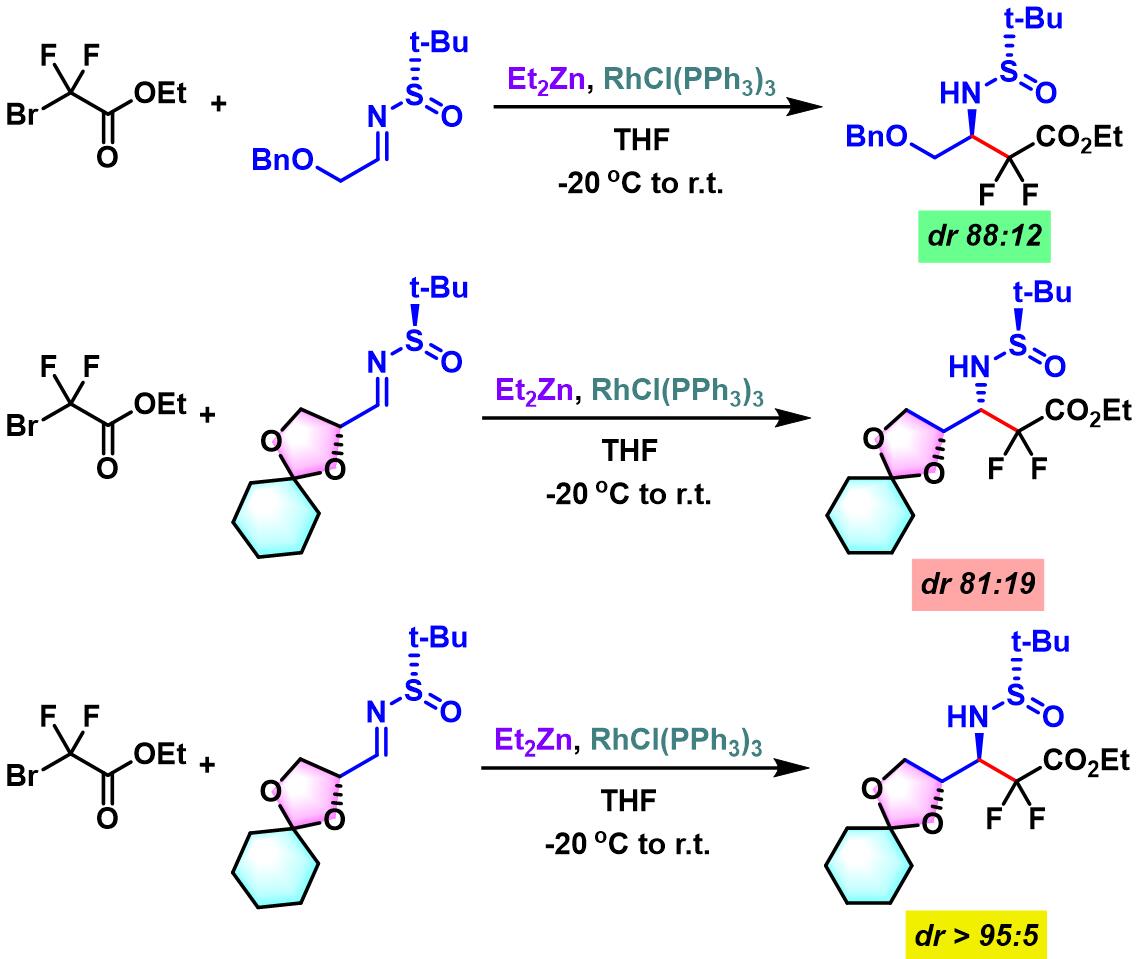
2014年,B. Linclau采用α-含氧基团取代的手性亚磺酰亚胺与溴代二氟乙酸酯之间进行反应,并观察到反应中存在双重立体差异 (double diastereodifferentiation) [19]。
文献中将这种通过有机金属试剂促进的醛或酮与卤乙酸酯之间的Reformasky反应称为Honda-Reformasky反应 (Honda-Reformasky reaction) [1]-[13], [15]-[17], [19]。而将Wilkinson催化剂/有机锌体系促进的酰氯与α, β-不饱和化合物之间的还原偶联反应称为还原型Honda-Reformasky反应 (Reductive Honda-Reformasky reaction) [14], [18]。上述反应条件温和,具有优良的产率与底物适用性。目前。该反应已成为合成β-羟基酸酯、手性β-氨基酸酯、β-内酰胺及1,3-二羰基化合物的有效方法[20]-[24]。
基本文献
- [1] K. Kanai, H. Wakabayashi, T. Honda, Org. Lett. 2000, 2, 2549. doi: 10.1021/ol006268c.
- [2] K. Kanai, H. Wakabayashi, T. Honda, Heterocycles 2002, 58, 47. doi: 10.3987/COM-02-S(M)10.
- [3] T. Honda, H. Wakabayashi, K. Kanai, Chem. Pharm. Bull. 2002, 50, 307. doi: 10.1248/cpb.50.307.
- [4] J. C. Adrian Jr, M. L. Snapper. J. Org. Chem. 2003, 68, 2143. doi: 10.1021/jo026847q.
- [5] K. Sato, A. Tarui, T. Kita, Y. Ishida, H. Tamura, M. Omote, A. Ando, I. Kumadaki, Tetrahedron Lett. 2004, 45, 5735. doi: 10.1016/j.tetlet.2004.05.099.
- [6] E. A. Hallinan, J. Fried, Tetrahedron Lett. 1984, 25, 2301. doi: 10.1016/S0040-4039(01)80239-2.
- [7] S. Watanabe, T. Fujita, M. Sakamoto, H. Takeda, T. Kitazume, T. Yamazaki, J. Fluorine Chem. 1997, 82, 1. doi: 10.1016/S0022-1139(96)03536-1.
- [8] E. W. Lang, B. Schaub, Tetrahedron Lett. 1988, 29, 2943. doi: 10.1016/0040-4039(88)85053-6.
- [9] K. Sato, A. Tarui, S. Matsuda, M. Omote, A. Ando, I. Kumadaki,
- Tetrahedron Lett. 2005, 46, 7679. doi: 10.1016/j.tetlet.2005.09.031.
- [10] P. G. Cozzi, E. Rivalta, Angew. Chem. Int. Ed. 2005, 44, 3600. doi: 10.1002/anie.200462757.
- [11] P. G. Cozzi, Angew. Chem. Int. Ed. 2006, 45, 2951. doi: 10.1002/anie.200504239.
- [12] A. Tarui, K. Kondo, H. Taira, K. Sato, M. Omote, I. Kumadaki, A. Ando, Heterocycles 2007, 73, 203. doi: 10.3987/COM-07-S(U)29.
- [13] A. Tarui, D. Ozaki, N. Nakajima, Y. Yokota, Y. S. Sokeirik, K. Sato, M. Omote, I. Kumadaki, A. Ando, Tetrahedron Lett. 2008, 49, 3839. doi: 10.1016/j.tetlet.2008.04.101.
- [14] S. Sato, R. Yamazoe, S. Yamamoto, A. Ohata, M. Traui, Omote, A. Ando, I. Kumadaki, Org. Lett. 2008, 10, 2405. doi: 10.1021/ol800660y.
- [15] A. Tarui, N. Kawashima, K. Sato, M. Omote, Y. Miwa, H. Minami, A. Ando, Tetrahedron Lett. 2010, 51, 2000. doi: 10.1016/j.tetlet.2010.02.023.
- [16] F. Benfatti, P. G. Cozzi, Tetrahedron Asymm. 2010, 21, 1503. doi: 10.1016/j.tetasy.2010.04.058.
- [17] C. Wolf, M. Moskowitz, J. Org. Chem. 2011, 76, 6372. doi: 10.1021/jo200774e.
- [18] K. Sato, M. Isoda, S. Ohata, S. Morita, A. Tarui, M. Omote, I. Kumadaki, A. Ando, Adv. Synth. Catal. 2012, 354, 510. doi: 10.1002/adsc.201100463.
- [19] C. Q. Fontenelle, M. Conroy, M. Light, T. Poisson, X. Pannecoucke, B. Linclau, J. Org. Chem. 2014, 79, 4186. doi: 10.1021/jo500396p.
- [20] P. G. Cozzi, E. Rivalta. Pure Appl. Chem. 2006, 78, 287. doi: 10.1351/pac200678020287.
- [21] P. G. Cozzi, A. Mignogna, L. Zoli, Pure Appl. Chem. 2008, 80, 891. doi: 10.1351/pac200880050891.
- [22] S. Choppin, L. Ferreiro-Medeiros, M. Barbarotto, F. Colobert, Chem. Soc. Rev. 2013, 42, 937. doi: 10.1039/C2CS35351B.
- [23] M. A. Fernández-Ibáñez, B. Maciá, D. A. Alonso, I. M. Pastor, Eur. J. Org. Chem. 2013, 7028. doi: 10.1002/ejoc.201300571.
- [24] H. Pellissier, Beilstein J. Org. Chem. 2018, 14, 325. doi:10.3762/bjoc.14.21.
反应机理
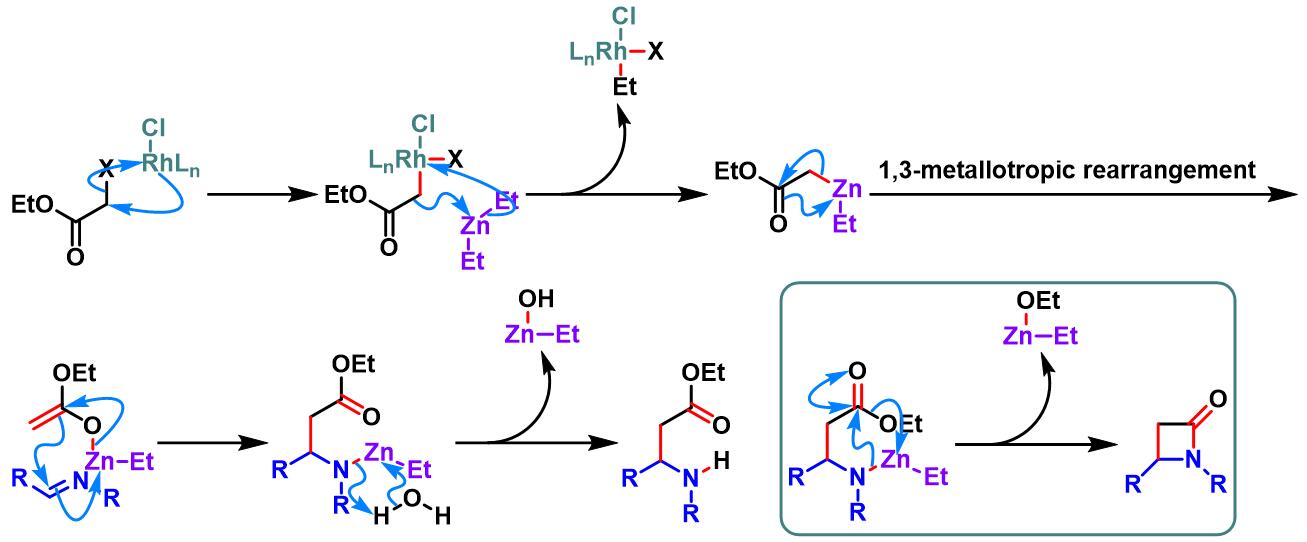
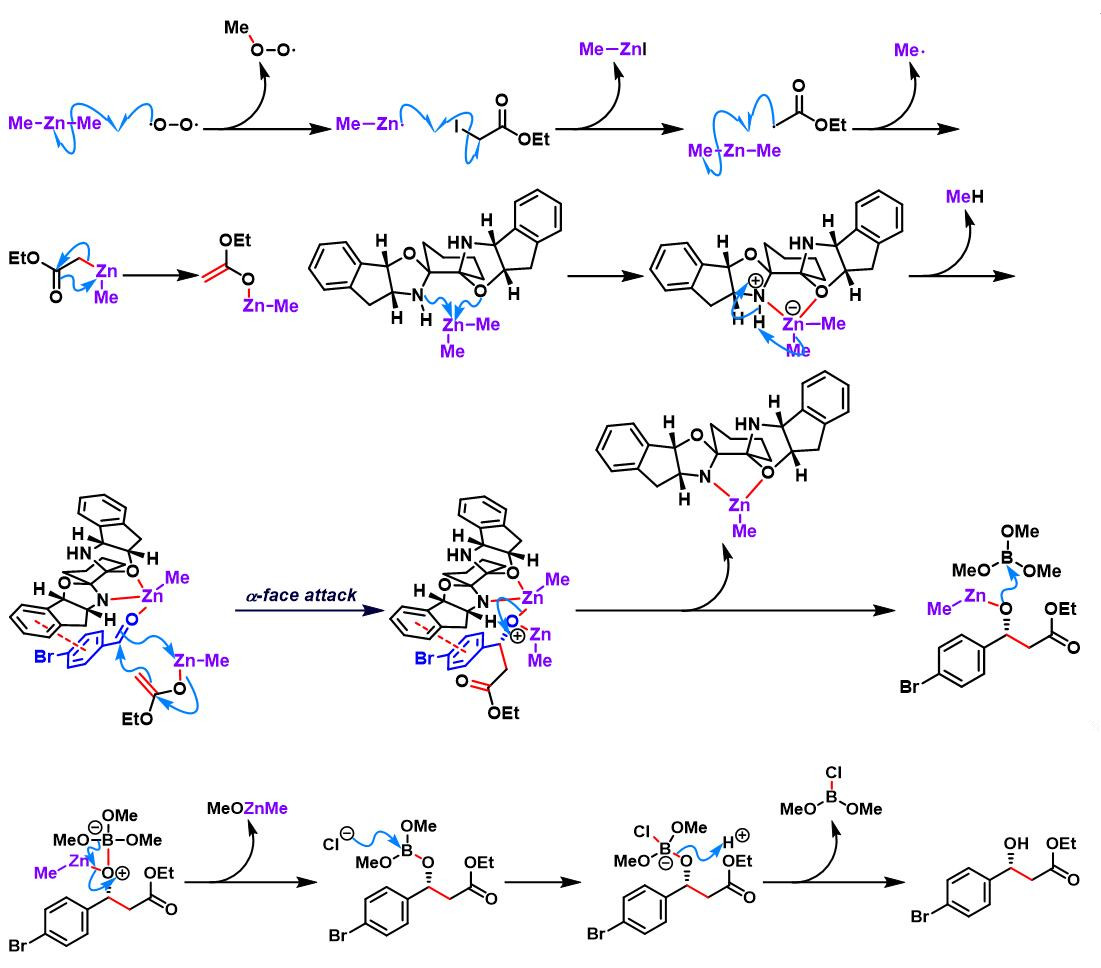
分子间Honda-Reformasky反应[1]
分子内Honda-Reformasky反应[1]
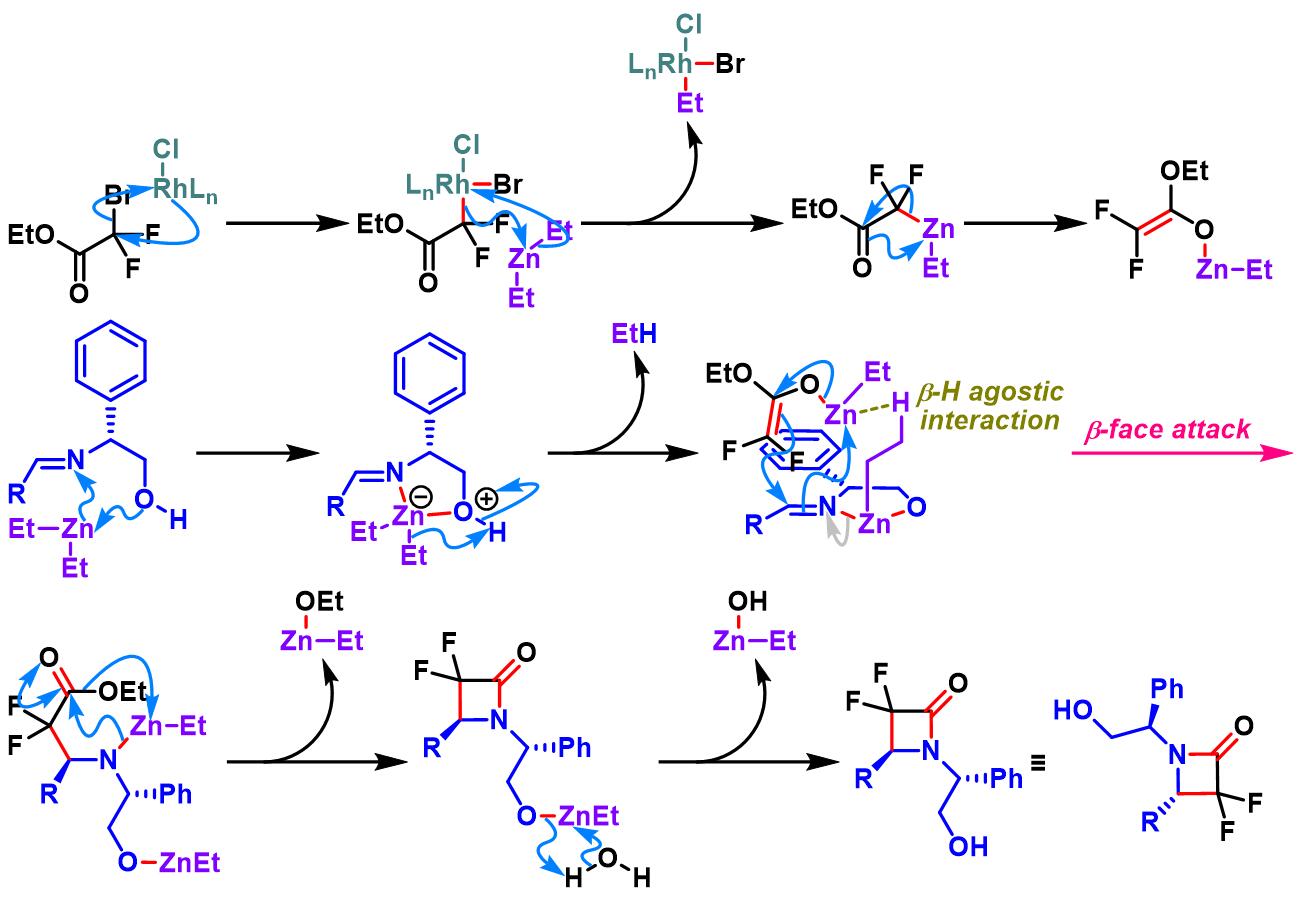
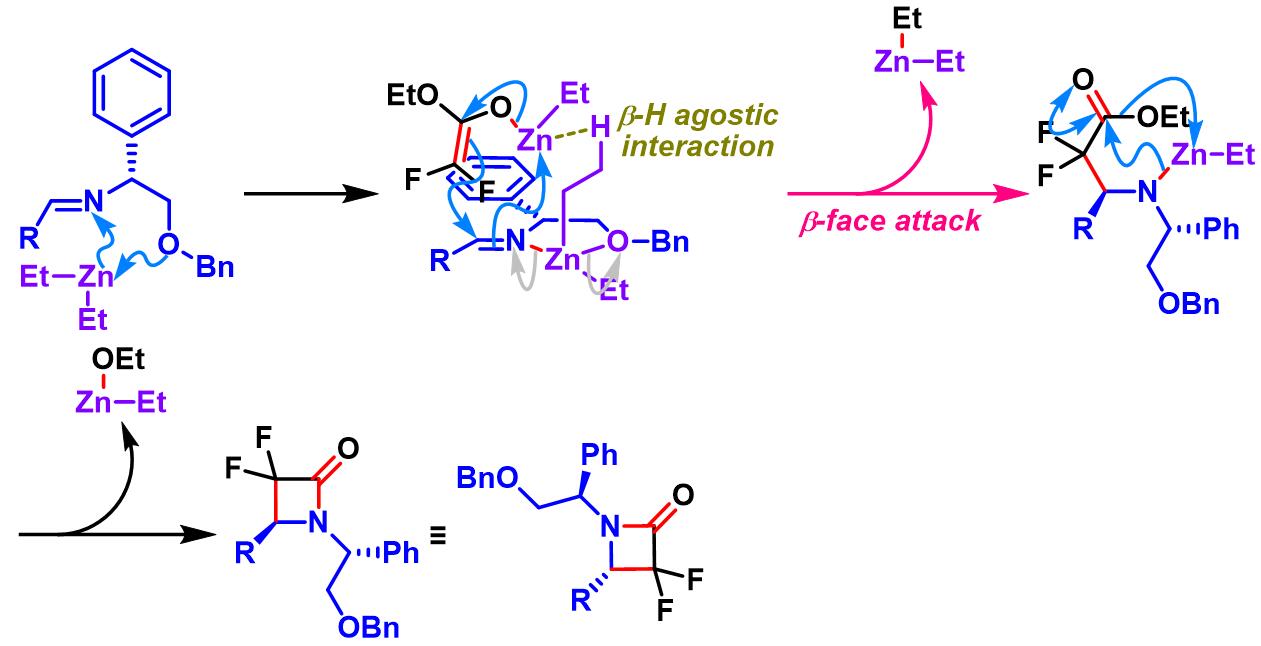
亚胺参与的Honda-Reformatsky反应[1]
溴代二氟乙酸酯参与的Honda-Reformatsky反应[1]-[4]
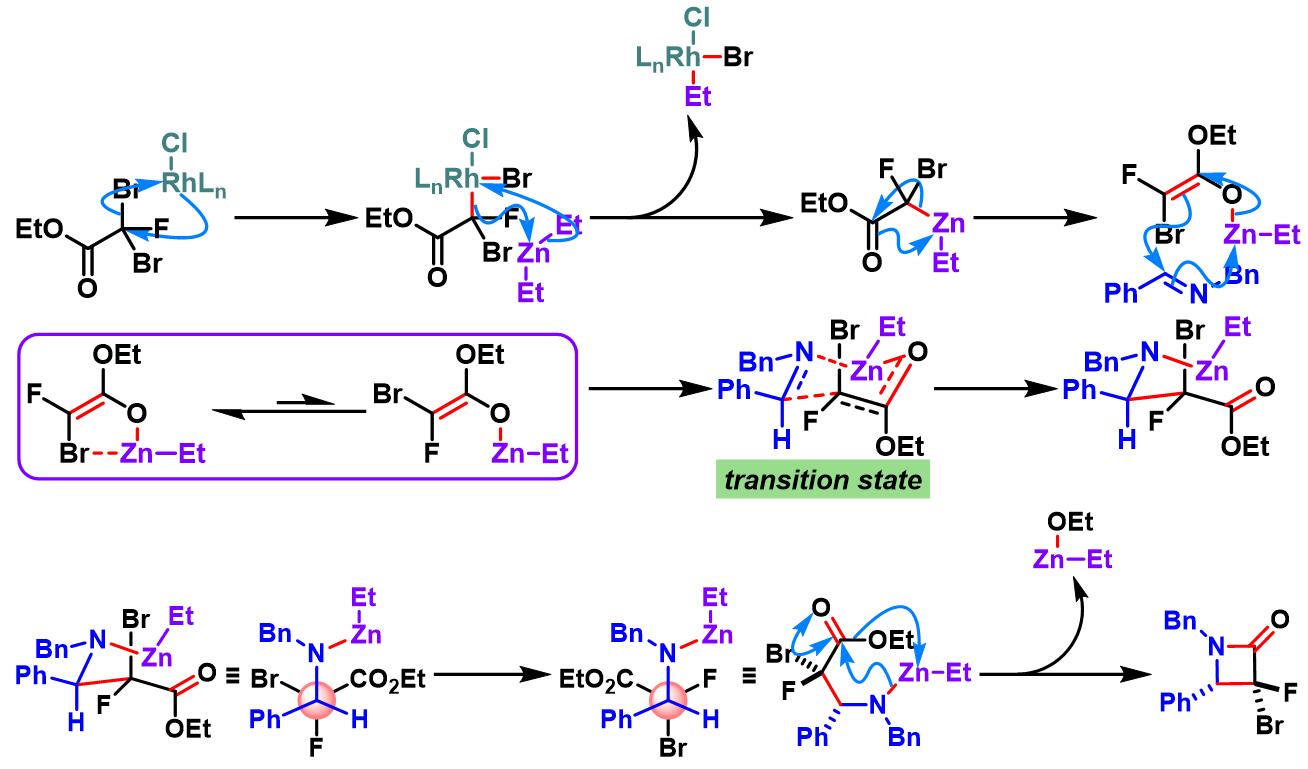
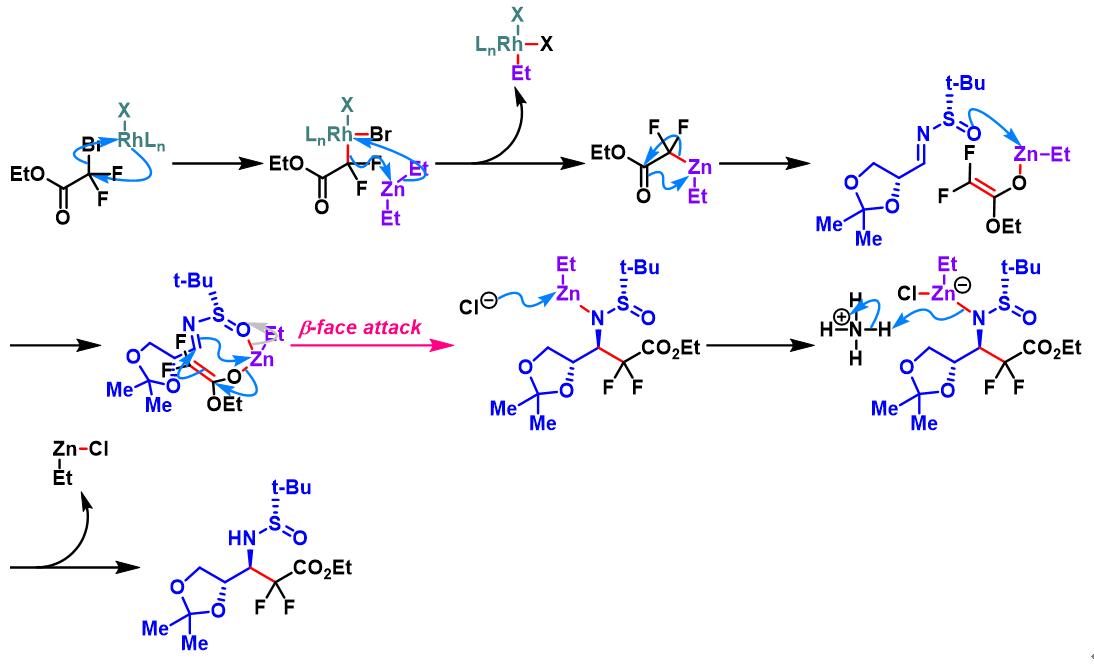
单氟二溴代乙酸酯参与的Honda-Reformatsky反应[1], [5]
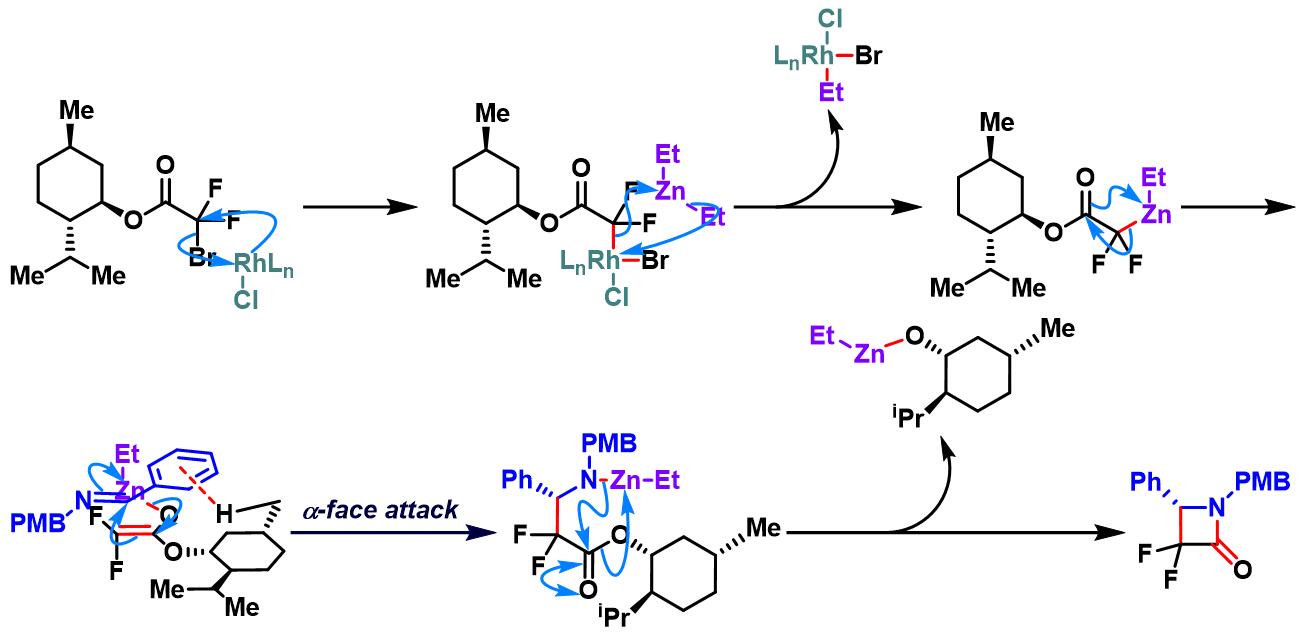
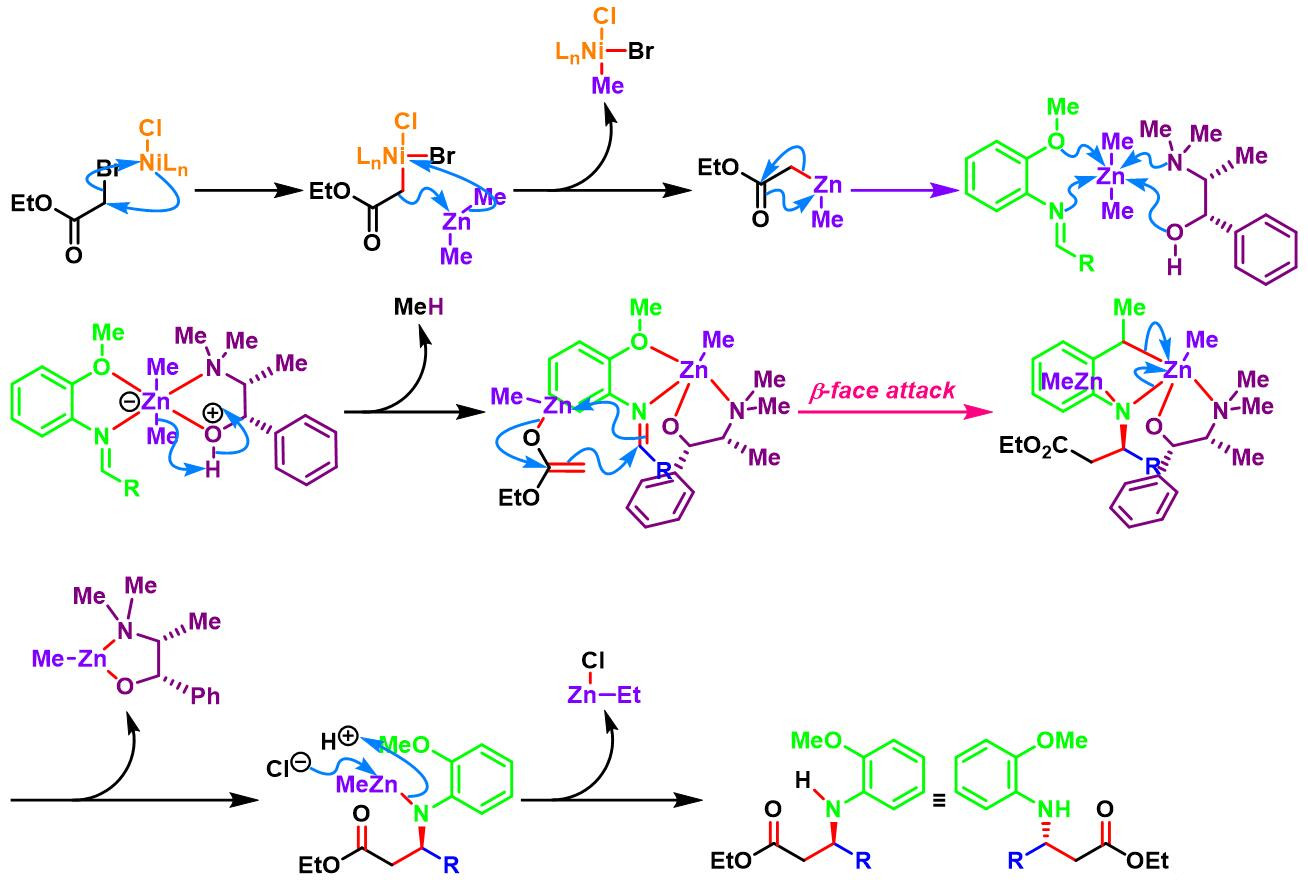
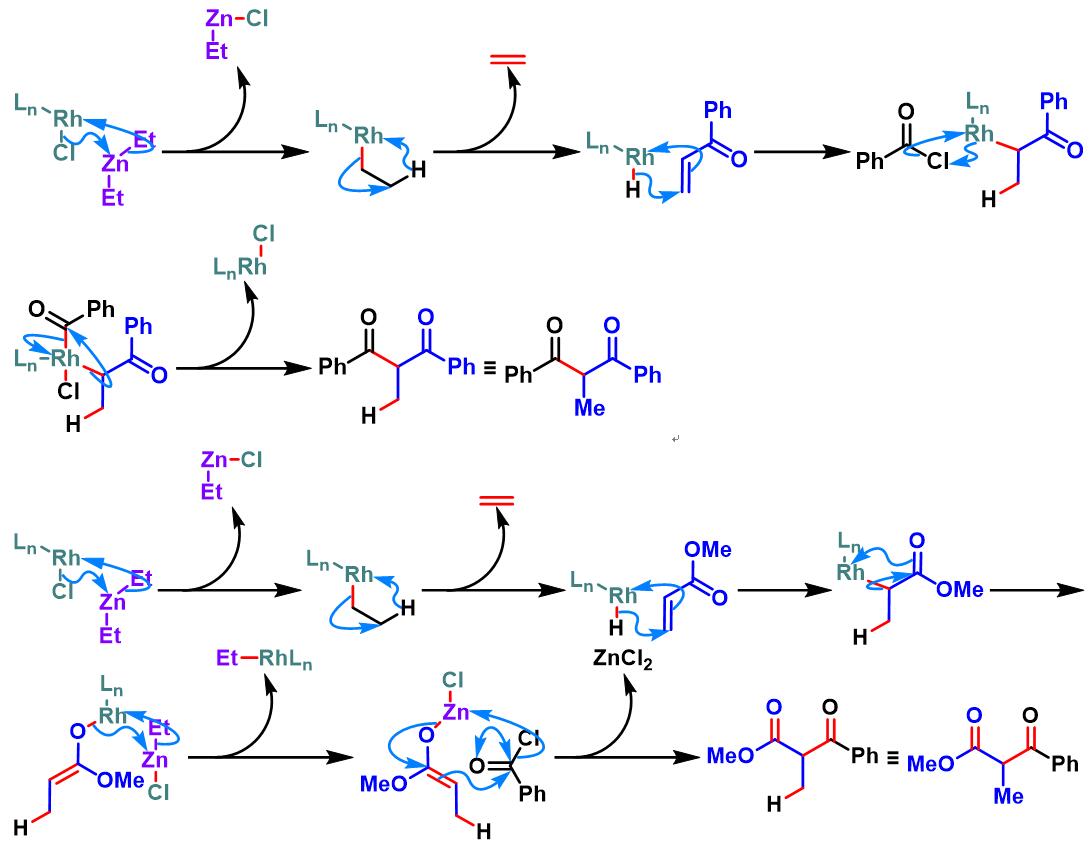
镍试剂参与的对映选择性亚胺Honda-Reformatsky反应[1], [6]
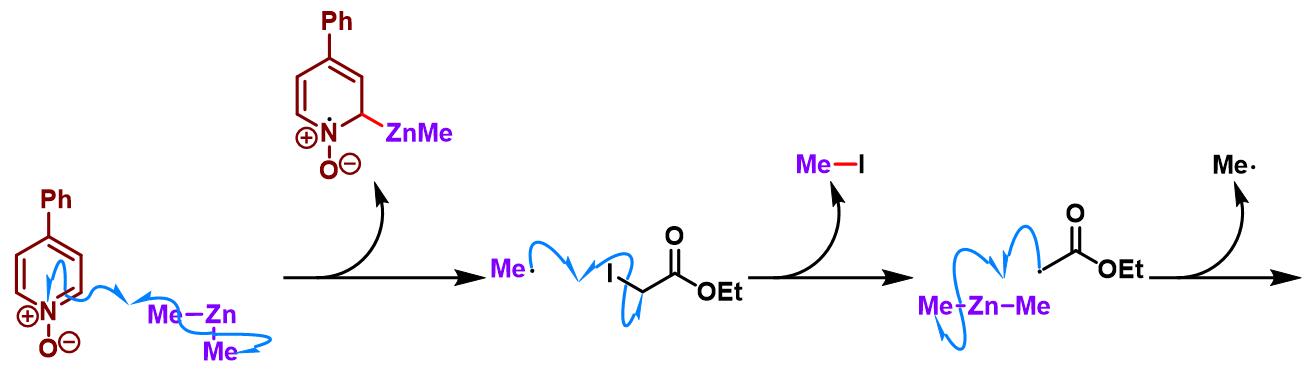
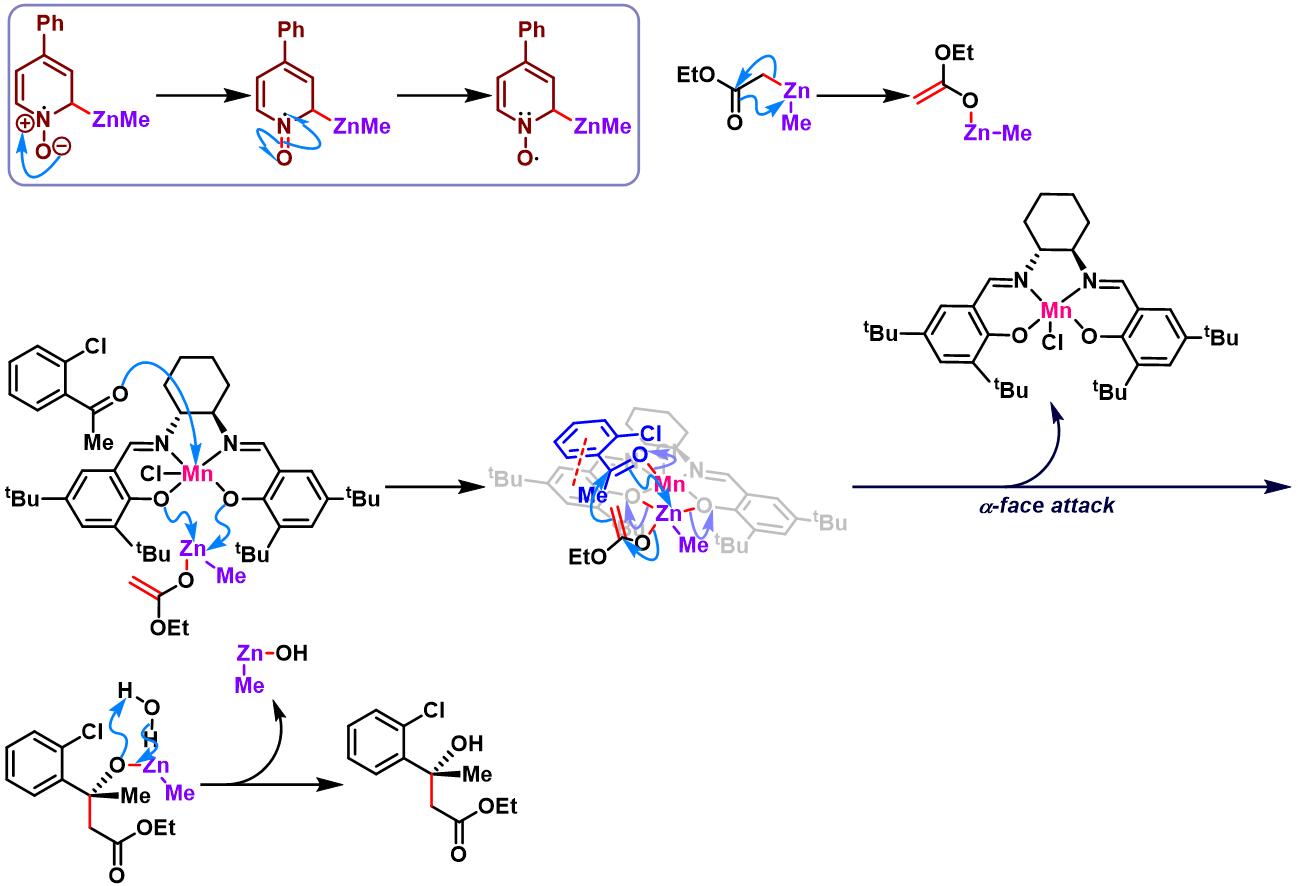
手性锰催化剂参与的对映选择性亚胺Honda-Reformatsky反应[1], [7]-[9]
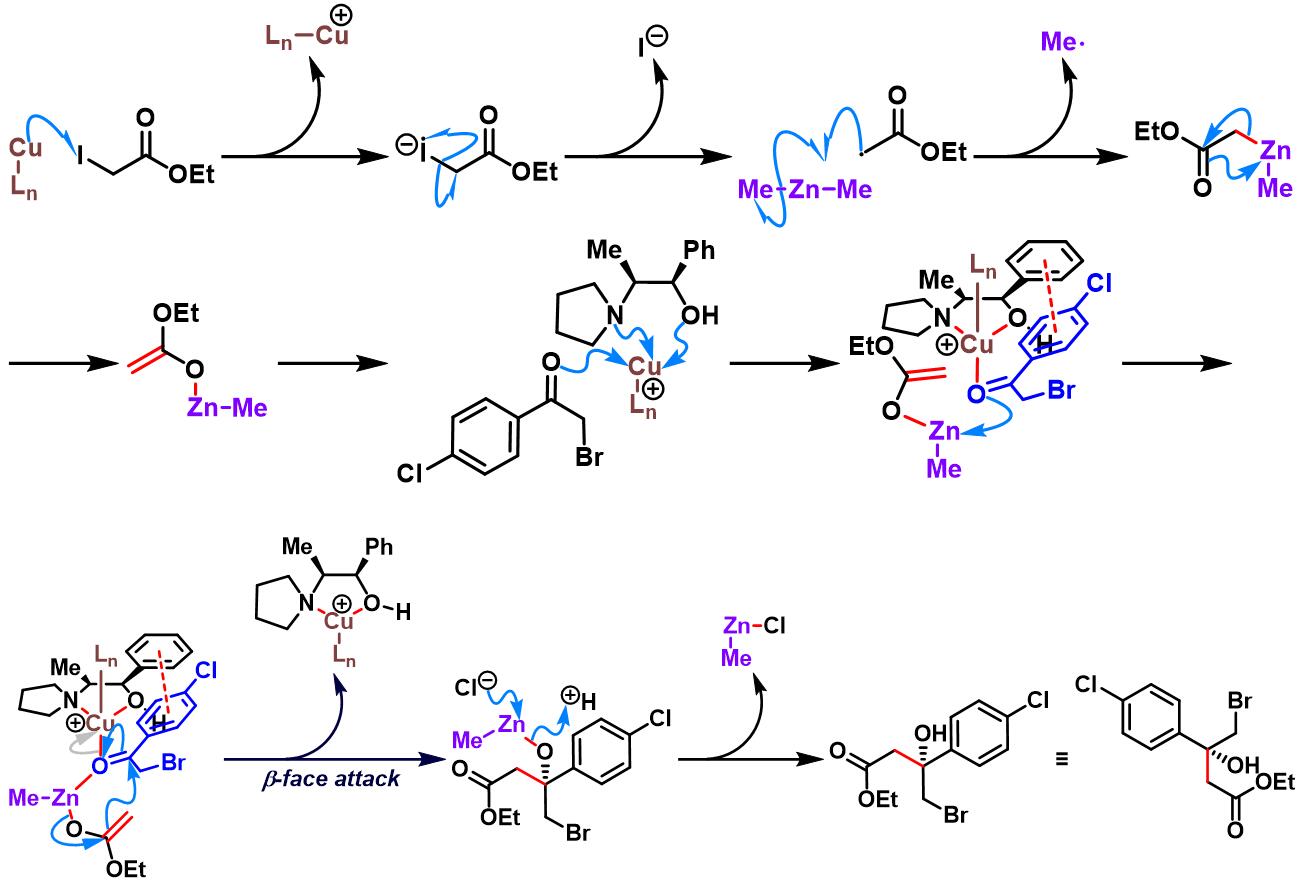
手性配体/CuCN-dppp配合物参与的对映选择性Honda-Reformatsky反应[10]
手性双噁唑啉配体/B(OMe)3/有机锌参与的对映选择性Honda-Reformatsky反应[11]
还原型Honda-Reformatsky反应[12]-[13]
双重立体差异的Honda-Reformatsky反应[14]
参考文献
- [1] M. M. Hansen, P. A. Bartlett, C. H. Heathcock, Organometallics, 1987, 6, 2069. doi: 10.1021/om00153a006.
- [2] M. K. Mokhallalati, M. J. Wu, L. N. Pridgen, Tetrahedron Lett. 1993, 34, 47. doi: 10.1016/S0040-4039(00)60054-0.
- [3] K. Sato, Y. Ishida, E. Murata, Y. Oida, Y. Mori, M. Okawa, K. Iwase, A. Tarui, M. Omote, I. Kumadaki, A. Ando, Tetrahedron 2007, 63, 12735. doi: 10.1016/j.tet.2007.09.081.
- [4] S. Conti, M. Falorni, G. Giacomelli, F. Soccolini, Tetrahedron 1992, 48, 8993. doi: 10.1016/S0040-4020(01)81997-9.
- [5] A. Tarui, N. Kawashima, K. Sato, M. Omote, Y. Miwa, H. Minami, A. Ando, Tetrahedron Lett. 2010, 51, 2000. doi: 10.1016/j.tetlet.2010.02.023.
- [6] D. Enders, J. Zhu, G. Raabe. Angew. Chem. Int. Ed. Engl. 1996, 35, 1725. doi: 10.1002/anie.199617251.
- [7] A. Gualandia, C. M. Wilson, P. G. Cozzi, Chimia 2017, 71, 562. doi: 10.2533/chimia.2017.562.
- [8] J. R. Chipperfield, J. Clayton, K. A. Siraj, S. Woodward, J. Chem. Soc. Dalton Trans. 2000, 1087. doi: 10.1039/B001059F.
- [9] E. Mileo, F. Benfatti, P. G. Cozzi, M. Lucarini, Chem. Commun. 2009, 469. doi: 10.1039/B818437B.
- [10] Y. Lin, S. Lai, C. Che, W. Fu, Z. Zhou, N. Zhu, Inorg. Chem. 2005, 44, 1511. doi: 10.1021/ic048876k.
- [11] J. Lewìnski, W. Śliwiński, M. Dranka, I. Justiniak, J. Lipkowski. Angew. Chem. Int. Ed. 2006,45, 4826. doi: 10.1002/anie.200601001.
- [12] S. Sato, R. Yamazoe, S. Yamamoto, A. Ohata, M. Traui, Omote, A. Ando, I. Kumadaki, Org. Lett. 2008, 10, 2405. doi: 10.1021/ol800660y.
- [13] K. Sato, M. Isoda, S. Ohata, S. Morita, A. Tarui, M. Omote, I. Kumadaki, A. Ando, Adv. Synth. Catal. 2012, 354, 510. doi: 10.1002/adsc.201100463.
- [14] J. C. Barrow, P. L. Ngo, J. M. Pellicore, H. G. Selnick, P. G. Nantermet, Tetrahedron Lett. 2001, 42, 2051. doi: 10.1016/S0040-4039(01)00122-8.
反应实例
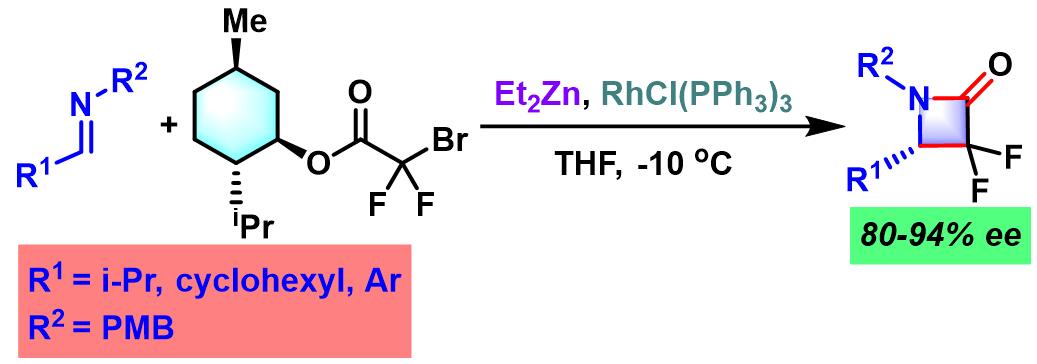
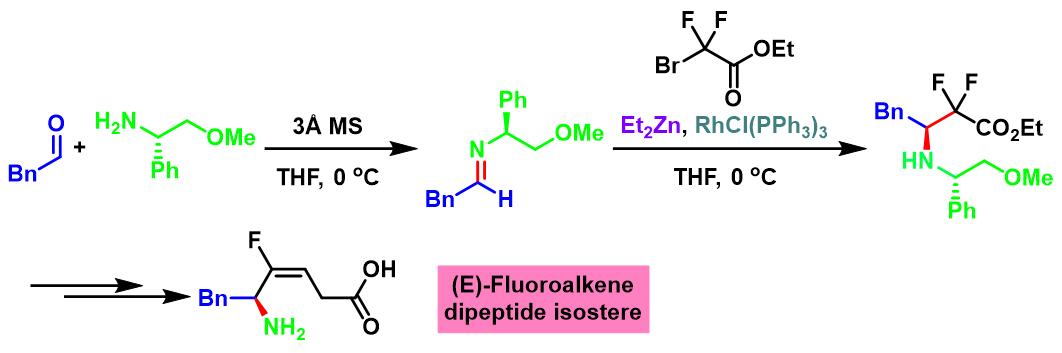
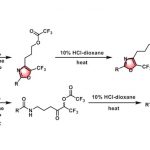
(E)-氟代烯基二肽等排体 (fluoroalkene dipeptide isosteres)的合成[1]
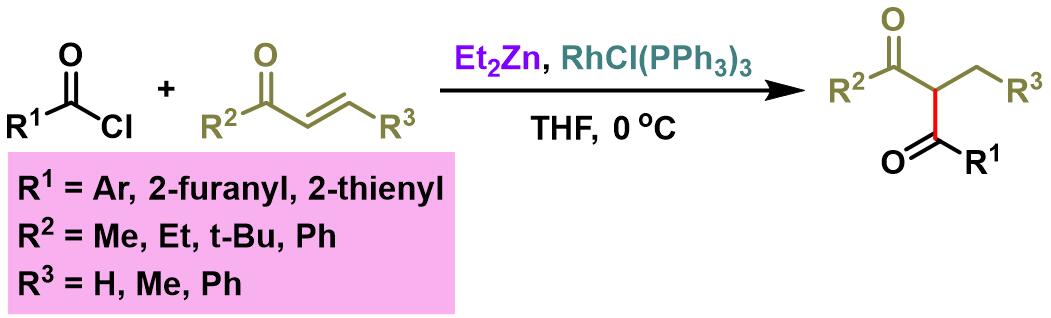
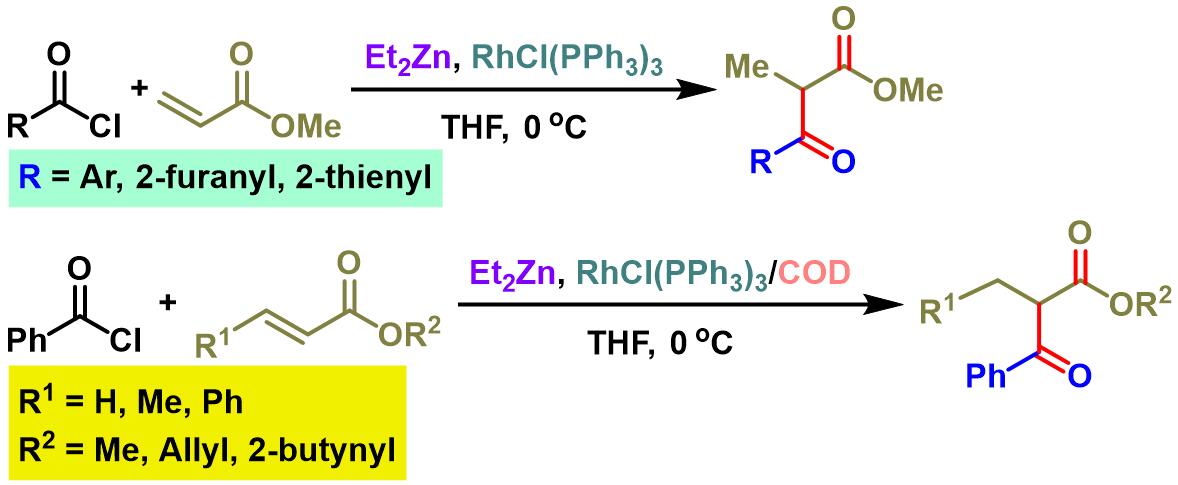
1,3-二羰基化合物的合成[2]
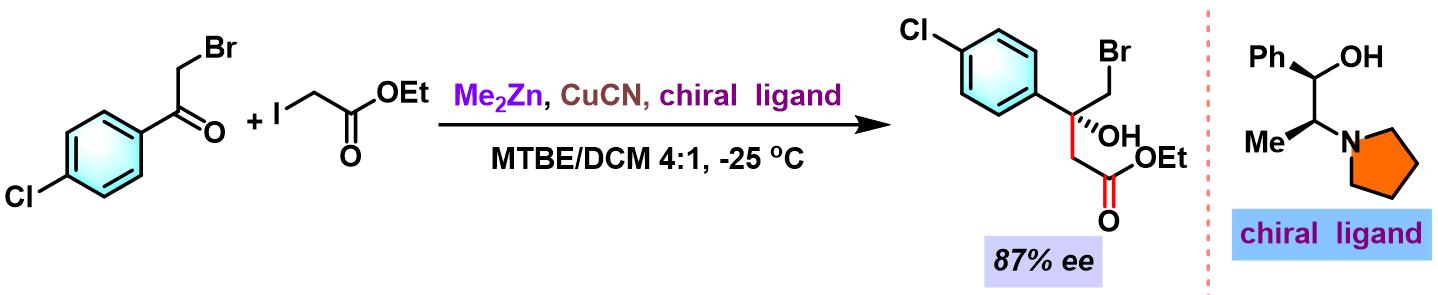
β-羟基酸酯的合成[3]
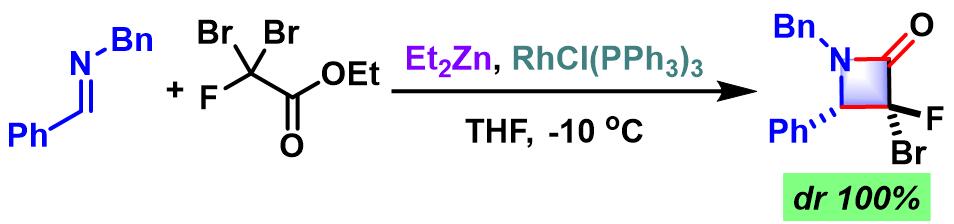
β-内酰胺的合成[4]
实验步骤
Wilkinson催化剂参与的Honda-Reformasky反应
0°C下,向Wilkinson催化剂 (0.05 eq.)的四氢呋喃溶液 (浓度为0.04 M)中加入醛 (1 eq.)与溴乙酸酯的四氢呋喃溶液 (浓度分别为0.13 M及0.2 M)。搅拌5 min后,再滴加二乙基锌 (1 M正己烷溶液,2.2 eq.)。维持0°C,继续搅拌,直至反应结束。反应结束后,加入饱和碳酸氢钠溶液淬灭反应。淬灭完成后,滤除产生的沉淀,再将滤液浓缩。向浓缩的滤液中加入饱和食盐水后,再加入乙醚进行萃取。将合并的有机相通过无水硫酸钠干燥后,减压除去溶剂。粗产物通过硅胶柱色谱分离纯化 (正己烷/乙酸乙酯2:1 v/v作为洗脱剂),获得β-羟基酸酯。
亚胺参与的Honda-Reformatsky反应
0°C下,向Wilkinson催化剂 (0.05 eq.)的四氢呋喃 (醛浓度为0.22 M,反应最终获得β-氨基酸酯)或甲苯溶液 (醛浓度为0.22 M,反应最终获得β-内酰胺)中加入亚胺 (1 eq.)与溴乙酸酯 (1.1 eq.)。 搅拌5 min后,再滴加二乙基锌 (1 M正己烷溶液, 4eq.)。维持0°C (对于四氢呋喃溶液)或加热至40°C (对于甲苯溶液)继续搅拌,直至反应结束。反应结束后,加入饱和碳酸氢钠溶液淬灭反应。淬灭完成后,滤除产生的沉淀,向滤液中加入饱和食盐水后,再加入乙酸乙酯进行萃取。将合并的有机相通过无水硫酸钠干燥后,减压除去溶剂。粗产物通过硅胶柱色谱分离纯化获得β-氨基基酸酯或β-内酰胺。
镍试剂参与的Honda-Reformatsky反应
室温下,向醛 (1 eq.)的二氯甲烷溶液 (醛浓度为0.22 M)中加入芳胺 (1.05 eq.)。将上述混合物搅拌30 min后, 再加入二甲基锌的甲苯溶液 (2M, 3.6 eq.)。 继续搅拌30 min后,再加入溴乙酸酯 (1.07 eq.)。随后,立即加入新制备的镍催化剂 (0.05 eq.)的二氯甲烷溶液 (浓度为0.02 M)。将上述反应混合物继续搅拌,并由TLC监控,直至反应结束。反应结束后,加入2 M HCl溶液淬灭反应。淬灭完成后,分离出有机相,依次加入饱和碳酸氢钠与饱和食盐水进行洗涤,再通过无水硫酸镁干燥后,减压除去溶剂,获得相应β-氨基基酸酯。
手性锰催化剂参与的对映选择性亚胺Honda-Reformatsky反应
室温下,向ClMn(Salen) (0.2 eq.)的MTBE溶液 (浓度为0.008 M)中加入4-苯基吡啶N-氧化物 (0.25 eq.)。将上述混合物搅拌1 h后,再加入酮 (1 eq.)与碘乙酸酯 (2 eq.)。将产生的棕色溶液搅拌5 min后,通过注射器滴加二甲基锌 (2M甲苯溶液, 2 eq.)。此时,观察到上述混合物中有沉淀出现。将上述反应混合物继续搅拌,直至反应结束。反应结束后,加入饱和碳酸氢钠溶液淬灭反应。淬灭完成后,滤除产生的沉淀,并分离出有机相,水相中继续加入乙醚进行萃取。将合并的有机相通过无水硫酸钠干燥后,减压除去溶剂。粗产物通过快速柱色谱分离纯化 (采用环己烷/乙醚7:3至9:1进行梯度洗脱) 获得相应手性β-羟基酸酯。
手性配体/CuCN-dppp配合物参与的对映选择性Honda-Reformatsky反应
室温氮气气氛下,向经热喷枪干燥的两口烧瓶中加入氰化亚铜 (0.15 eq.)与dppp (0.15 eq.), 再加入适量二氯甲烷溶解。将上述混合物搅拌30 min后,减压除去溶剂,再加入MTBE (维持后续加入的酮底物的浓度为0.04 M)。 将上述混合物冷却至-25°C,通过注射器滴加二甲基锌 (2M甲苯溶液, 2 eq.)。再加入N-pyrrolidinyl norephedrine (0.25 eq.),随后,立即加入加入酮 (1 eq.)与碘乙酸酯 (2 eq.)。 将上述反应混合物继续搅拌,并由TLC监控,直至反应结束。反应结束后,加入1 M HCl溶液淬灭反应。淬灭完成后,向反应液中加入乙醚进行稀释,分离出有机相,水相中继续加入乙醚进行萃取。 将合并的有机相通过无水硫酸钠干燥后, 减压除去溶剂。粗产物通过快速柱色谱分离纯化,获得相应手性β-羟基酸酯。
手性双噁唑啉配体/B(OMe)3/有机锌参与的对映选择性Honda-Reformatsky反应
室温下,将双噁唑啉配体 (0.096 eq.)通过无水乙醚溶解 (浓度为0.005 M)后,转移至连接有氯化钙干燥管的三口烧瓶中。将上述溶液在氮气气氛下搅拌5min后,加入碘乙酸酯 (2 eq.)。继续搅拌5min后,加入三甲氧基硼 (1 eq.)。之后,移除氯化钙干燥管上的胶塞,将上述混合物暴露于空气中,进一步搅拌5 min后,通过注射器滴加二甲基锌 (1.2M甲苯溶液, 4 eq.)。随后,立即通过注射泵自动滴加酮 (1 eq.)的无水乙醚溶液 (底物浓度为0.25 M)。滴加结束后,再通过注射器再次滴加二甲基锌 (1.2M甲苯溶液, 4 eq.)。将上述反应混合物继续搅拌,直至反应结束。反应结束后,加入1 M HCl溶液淬灭反应。淬灭完成后,向反应液中加入乙醚进行萃取。将合并的有机相通过无水硫酸镁干燥后,减压除去溶剂。粗产物通过快速柱色谱分离纯化,获得相应手性β-羟基酸酯。
还原型Honda-Reformatsky反应
0°C下,向Wilkinson催化剂 (0.02 eq.)的四氢呋喃溶液 (维持α,β-不饱和化合物浓度为0.04 M)中加入酰氯 (2 eq.)与α,β-不饱和化合物 (1 eq.)。之后,再滴加二乙基锌 (1 M正己烷溶液,1.5 eq.)。维持0°C,继续搅拌,直至反应结束。反应结束后,加入1 M HCl溶液淬灭反应。淬灭完成后,加入乙酸乙酯进行萃取。将合并的有机相依次通过饱和食盐水洗涤及无水硫酸镁干燥后,减压除去溶剂。粗产物通过硅胶柱色谱分离纯化,获得相应1,3-二羰基化合物。
参考文献
- [1] A. Niida, K. Tomita, M. Mizumoto, H. Tanigaki, T. Terada, S. Oishi, A. Otaka, K. Inui, N. Fujii, Org. Lett. 2006, 8, 613. doi: 10.1021/ol052781k.
- [2] S. Sato, R. Yamazoe, S. Yamamoto, A. Ohata, M. Traui, Omote, A. Ando, I. Kumadaki, Org. Lett. 2008, 10, 2405. doi: 10.1021/ol800660y.
- [3] K. Kanai, H. Wakabayashi, T. Honda, Org. Lett. 2000, 2, 2549. doi: 10.1021/ol006268c.
- [4] K. Kanai, H. Wakabayashi, T. Honda, Heterocycles 2002, 58, 47. doi: 10.3987/COM-02-S(M)10.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.