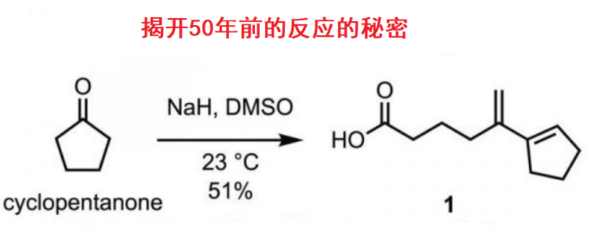
俄亥俄州立大学的・David A. Nagib等人,开发出了脂肪族醇类的自由基参与型β位置选择性的C(sp3)-H胺基化反应。该反应的关键在于,由Trichloroimidates产生的氨基自由基,发生1,5-氢移动(HAT),在底物β位选择性生成碳自由基。
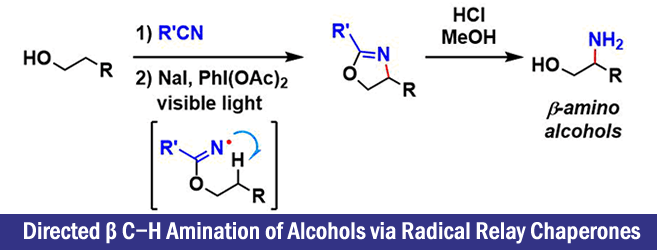
“Directed β C−H Amination of Alcohols via Radical Relay Chaperones”
Wappes, E. A.; Nakafuku, K. M.; Nagib, D. A.* J. Am. Chem. Soc. 2017, 139, 10204. DOI: 10.1021/jacs.7b05214
问题设定与解决点
烯烃的双功能化常常是作为β氨基醇的合成的经典手法被广为所知[1]、而作为最直接最有效的醇的β位C(sp3)-H键的直接胺基化的合成实例的报道还很少。铑或者银催化的氮宾的β位C-H胺基化的手法虽然已经被报道了,然而由于立体因素,主产物往往为γ-胺基化产物[2]。
作者以氮自由基为起点,着眼于1,5-HAT,实现了远端位的C-H胺基化反应。该方法学的主要特点是,醇β位的选择性胺基导入法。
该方法的特点
最关键的是作者使用了imidate作为氮自由基源。如标题图所示,该反应首先形成六元环的过渡态,实现选择性的控制。由imidate生成的自由基再进行的HAT过程进行反应的报道这一次是首次。这是由于对于Aminal结构来说,氮自由基形成时往往会伴有竞争性的β断键,很难控制。
作者通过DFT计算SOMO的能量发现,aminal结构中取代基的影响非常大。另一方面,imidate的N-H键的解离能量(BDE)大致以100 ± 1 kcal/mol进行计算。这也意味着可以有效切断大多数的sp3C-H键。
另外,如下文所属,结构对HAT过程的进行度的影响很大,因此影响HAT的不是BDE的值,而是SOMO能量。
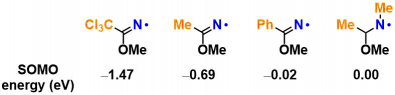
主张的有效性验证
①Imidate部位・反应条件的优化
文章中以2-苯基乙醇为原料,合成了各种不同取代基取代的imidate,在IOAc(= NaI + PhI(OAc)2)、荧光灯照射下进行反应。作者发现并验证了,在使用Trichloroacetoimidate的场合,苄位的C-H胺基化反应可以定量的(100%)进行。而使用Benzoyl imidate的时候,反应也能中度的(49%)进行。
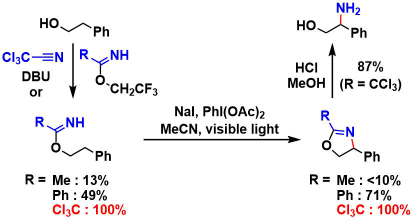
以脂肪醇为原料的反应中,如果使用亲核性较高的benzoyl imidate的话,β位胺基化反应可以叫高产率的进行(trichloroacetoimidate的亲核性低,无法引起Oxazoline的闭环)。
并且,作者通过KIE发现,HAT过程是本反应的rate determination阶段。
②底物拓展性讨论
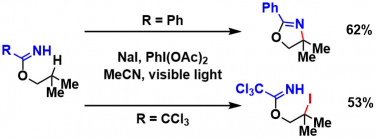
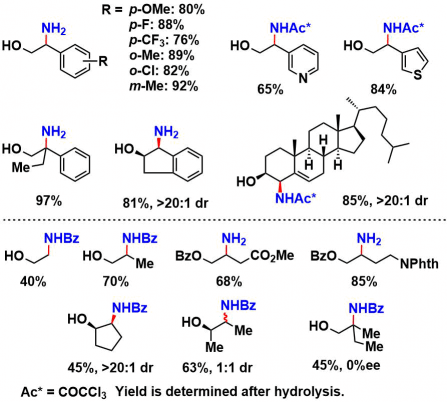
case by case,作者用了苄位・烯丙位C-H胺基化=trichloroacetoimidate、3級・2級・1級C-H胺基化=benzoyl imidate的组合进行底物拓展。在使用手性的含有3级碳的醇作为底物时,得到的是完全消旋的产物。由此表明,中间体是经由平面radical,或者cation进行的。
需要讨论的点
- 包括imidate的原料合成,胺基化反应如果可以one-pot进行的话,反应的实用性就大大加强了。本文中立体位阻大的imidate的合成是一个难点。
接下来该读的文章?
- Muniz等人最近开发出了一种新的催化C-H胺基化反应(吡咯烷的合成)、大致步骤为Ts amide形成→I2―光催化剂―氧气条件[3]。如果本文能够参考该工作,并且加上Nagib以前的一篇文章[4]进行改良的话、新的氧化剂催化的反应方法学的开发也是很有可能实现的。
参考論文
- (a) Ager, D. J.; Prakash, I.; Schaad, D. R. Chem. Rev. 1996, 96, 835. DOI: 10.1021/cr9500038 (b) Bergmeier, S. C. Tetrahedron 2000, 56, 2561. doi:10.1016/S0040-4020(00)00149-6 (c) Karjalainen, O. K.; Koskinen, A. M. P.Org. Biomol. Chem. 2012, 10, 4311. doi:10.1039/C2OB25357G
- (a) Davies, H. M. L.; Manning, J. R. Nature 2008, 451, 417. doi:10.1038/nature06485 (b) Roizen, J. L.; Harvey, M. E.; Du Bois, J. Acc. Chem. Res. 2012, 45, 911. DOI: 10.1021/ar200318q (c) Jeffrey, J. L.; Sarpong, R. Chem. Sci. 2013, 4, 4092. doi:10.1039/C3SC51420J
- Becker, P.; Duhamel, T.; Stein, C. J.; Reiher, M.; Muniz, K. Angew. Chem. Int. Ed.2017, 56, 8004. DOI: 10.1002/anie.201703611
- Wappes, E. A.; Fosu, S. C.; Chopko, T. C.; Nagib, D. A. Angew. Chem. Int. Ed.2016, 55, 9974. DOI: 10.1002/anie.201604704
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.