概要
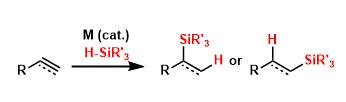
氢化硅烷相对来说是比较稳定的化合物,但是在金属催化剂的存在下,可以跟不饱和键进行加成反应。通常该方法作为有机硅化合物的合成手法被越来越多的开发使用。近年来,尤其是在半导体的表面修饰,以及一些功能性材料的开发上可谓作用巨大。
反应得到的取代型硅烷化烯烃可以通过玉尾氧化、Hiyama偶联反应、质子化、卤代等各种反应进行多种化合物合成与转换。
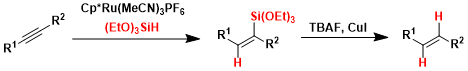
以下列出的催化剂常常被应用在氢硅烷化中。Wilkinson催化剂在非极性溶剂中可以生成cis-烯烃硅烷。Trost催化剂通常具有特殊的选择性,可以使末端炔转化成α-乙烯基硅烷
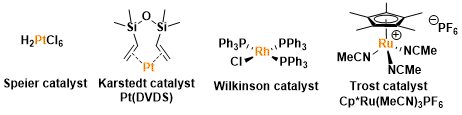
基本文献
<Pt catalysis>
- Speier, J. L.; Webster, J. A.; Bernes, G. H. J. Am. Chem. Soc. 1957, 79, 974. DOI: 10.1021/ja01561a054
- Lewis, L. N.; Sy, K. G. ; Bryant, G. L.; Donahue, P. E. Organometallics 1991, 10, 3750. doi:10.1021/om00056a055
- Denmark, S. E; Wang, Z. Org. Lett. 2001, 3, 1073. DOI: 10.1021/ol0156751
- Itami, K.; Mitsudo, K.; Nishino, A.; Yoshida, J. J. Org. Chem. 2002, 67, 2645. DOI: 10.1021/jo0163389
- Kettler, P. B. Org. Proc. Res. Dev. 2003, 7, 342. doi:10.1021/op034017o
<Pd catalysis>
- Yoshida, J.; Tamao, K.; Takahashi, M.; Kumada, M. Tetrahedron Lett. 1978, 19, 2161. doi:10.1016/S0040-4039(01)86834-9
<Rh catalysis>
- Ojima, I.; Kumagai, M. J. Organomet. Chem. 1974, 66, C14. doi:10.1016/S0022-328X(00)93873-7
- Dickers, H. M.; Haszeldine, R. N.; Mather, A. P.; Parish, R. V. J. Organomet. Chem. 1978, 161, 91. doi:10.1016/S0022-328X(00)80914-6
- Takeuchi, R.; Tanouchi, N. J. Chem. Soc., Perkin Trans. 1 1994, 2909. DOI: 10.1039/P19940002909
- Takeuchi, R.; Nitta, S.; Watanabe, D. J. Org. Chem. 1995, 60, 3045. DOI: 10.1021/jo00115a020
<Y catalysis>
- Molander, G. A.; Retsch, W. H. Organometallics 1995, 14, 4570. DOI: 10.1021/om00010a022
<Ru catalysis>
- Esteruelas, M. A.; Herrero, J.; Oro, L. A. Organometallics 1993, 12, 2377. DOI: 10.1021/om00030a057
- Na, Y.; Chang, S. Org. Lett. 2000, 2, 1887. DOI: 10.1021/ol0059697
- Trost, B. M.; Ball, Z. T. J. Am. Chem. Soc. 2001, 123, 12726. DOI: 10.1021/ja0121033
- Trost, B. M.; Ball, Z. T. J. Am. Chem. Soc. 2005, 127, 17644. DOI: 10.1021/ja0528580
反应机理
反应机理主要有两种论点。
① Chalk-Harrod机理: 从硅烷对金属催化剂的氧化加成作为开端,通过金属-质子键的插入进行的反应。金属以Pt为佳,具体机理循环请看下图。 (参考:J. Am. Chem. Soc. 1965, 87, 16)
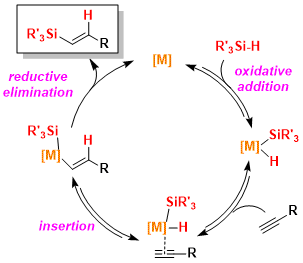
② 异构化机理: 起始步骤与①相同,但是金属-硅键的插入过程有所不同。为了避免位阻,反应中发生异构化,因此最终反应生成了Z-烯烃硅烷。这个结果很好的解释了一些Ru,Rh,Ir催化体系反应是如何得到选择性得到cis产物。(参考:J. Am. Chem. Soc. 2003, 125, 11578)

反应实例
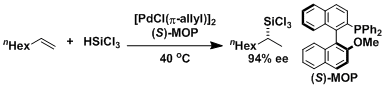
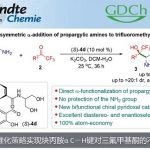
利用MOP作为配体的不对称硅氢化反应[1]
Norzoanthamine的合成[2]:对于缺电子烯烃的情况,利用Wilkinson催化剂-三乙基硅烷体系可以进行共轭还原。另外Stryker试剂也能达到相同的效果。
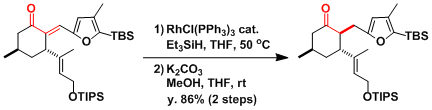
通常下图还原反应的位置选择性控制十分困难,但是利用分子内反应可以解决选择性上的问题,如下图所示[3]。
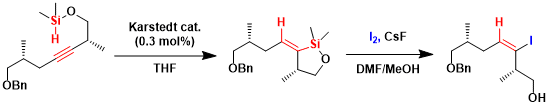
通过活用trans-氢硅烷化(6-endo环化)→玉尾氧化达成的(+)-spectaline的全合成[4]。
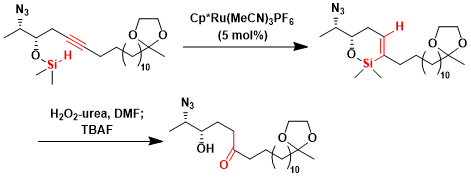
利用Cp*Ru催化剂催化进行trans-硅氢烷化后再通过脱硅化反应可以得到E-烯烃[4]。该手法可以作为Lindlar还原或者diimide还原得到Z-烯烃的相辅相成的烯烃合成手法。
实验步骤
实验技巧
参考文献
[1] (a) Uozumi, T.; Hayashi, T. J. Am. Chem. Soc. 1991, 113, 9887. DOI: 10.1021/ja00026a044 (b) Hayashi, T. Acc. Chem. Res. 2000, 33, 354. DOI: 10.1021/ar990080f[2] Miyashita, M.; Tanino, K. et al. Science 2004, 305, 495. DOI: 10.1126/science.1098851
[3] Onyango, E. O.; Tsurumoto, J.; Imai, N.; Takahashi, K.; Ishihara, J.; Hatakeyama, S. Angew. Chem. Int. Ed. 2007, 46, 6703. DOI: 10.1002/anie.200702229
[4] Trost, B. M.; Ball, Z. T.; Laemmerhold, K. M. J. Am. Chem. Soc. 2005, 127, 10028. DOI: 10.1021/ja051578h
[5] Trost, B. M.; Ball, Z. T.; Joge, T. J. Am. Chem. Soc. 2002, 124, 7922. DOI: 10.1021/ja026457l (b) Furstner, A.; Radkowski, K. Chem. Comm. 2002, 2182. DOI: 10.1039/B207169J
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.