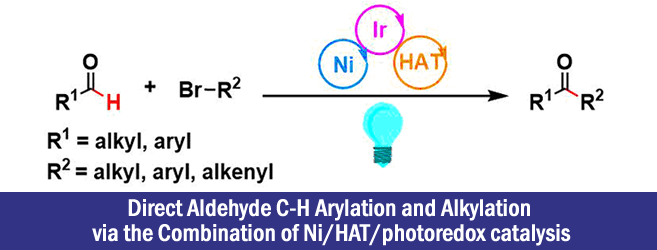
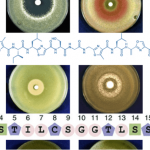
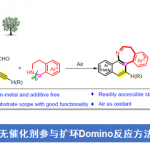
普林斯顿大学・David W. C. MacMillan等人利用可见光氧化还原催化剂、镍催化剂、氢原子移动(HAT)催化剂这三种组合,成功开发出了醛与溴代物的直接偶联合成酮的手法。
“Direct Aldehyde C-H Arylation and Alkylation via the Combination of Nickel, Hydrogen Atom Transfer, and Photoredox Catalysis”
Zhang, X.; MacMillan, D. W. C.* J. Am. Chem. Soc. 2017, 139, 11353–11356. DOI: 10.1021/jacs.7b07078
问题点设定
酮结构广泛存在于生物活性天然产物,医药品,有机功能性材料中,同时酮的后续官能团化修饰的多样性也非常强,是一个十分重要的官能团结构。。
一般而言,酮的合成法有以下4种。
- 有机金属试剂对Weinreb酰胺的亲核加成
- Friedel-Crafts酰化反应
- 与酰氯交叉偶联反应
- 2级醇的氧化反应
但是,以上4种方法中、1・3需要进行试剂的预先制备,步骤稍多。方法2的话,对底物的电子性质的依存性比较大,底物的一般性比较窄。而方法4需要使用比较多量的氧化剂。(下图所示)
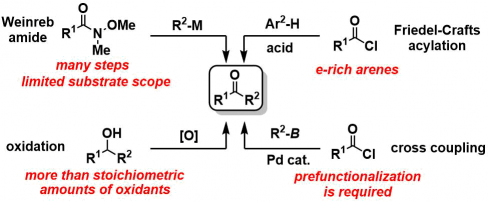
经典的酮的合成法与问题点
在这样的背景下,开发一种直接的酮合成法就显得很有意义。而利用醛直接合成酮的方法,从阶梯经济/原子经济的角度来看,也是非常有价值的。这类方法学,其实早就已经被开发,比如有使用胺 – 钯体系进行烯胺介导的Heck反应[1]、将芳基金属化合物配位插入醛合成铜的手法[2,3]、将具有小的键解离能(BDE)的醛的C-H键切断形成甲酰基自由基,再通过通过钯催化剂进行偶联的方法[4]。但是这些方法无论在底物适用范围上比较窄,另外反应温度也非常高,还具有很大的改良余地。
问题的解决思路
论文作者等人,尝试了开发一种以醛为底物直接合成酮的手法,反应条件中使用了可见光氧化还原催化剂・镍催化剂・HAT催化剂这三种组合[5]。
也就是说,首先想定了下图催化循环、利用醛的C-H键BDE比较小(89 kcal/mol)的特征,体系中生成的HAT催化活性种将醛的C-H键切断后生成甲酰基自由基,并且通过镍催化剂存在下与卤代化合物偶联形成酮。
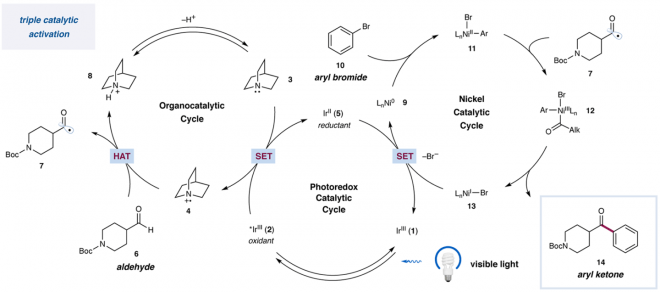
引用自标题论文
方法的有效性验证
①反应条件的最优化
4-甲酰基-N-Boc-哌啶作为原料进行优化。
成功的关键是,反应溶剂使用了dioxane。其实这类设计早就尝试过,而以前的溶剂都是用的DMSO或者MeCN这种高介电常数的溶剂,本反应如果使用这些溶剂的话,会导致竞争性的氮的α位的C-H活化副反应。同时,HAT催化剂quinuclidine的自由基活性种的稳定性也与溶剂的介电常数有直接关系。最终,反应以以下条件为基准进行底物拓展。
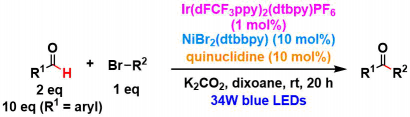
②底物的一般性验证
溴化物底物:反应适用于无论是吸电子还是缺电子溴化芳烃。并且该反应同样适用于一般来说合成困难的杂原子芳烃酮的合成。即使使用链烯基溴·烷基溴,也可以以适度的收率合成酮。
醛底物:使用脂肪族醛的场合,一般可以得到70%产率的酮。α位是4取代的醛无法发生反应。芳香族的醛虽然也适用,然而用量比较大(10 eq)。
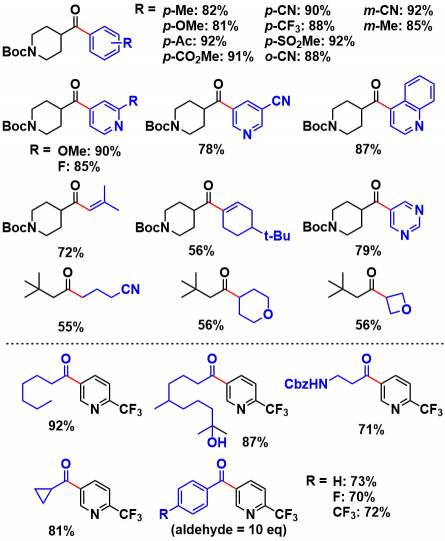
③ 反应机理的推定的基本根据
Ir(dFCF3ppy)2(dtbpy)PF6 的氧化还原电位(Ir(III)*/Ir(II) = + 1.21 V in MeCN vs SCE) 与HAT催化剂quinuclidine的氧化还原电位(N+・/N = +1.1 V in MeCN vs SCE))进行比较可以知道,被激活的Ir种可以氧化quinuclidine,生成HAT催化活性种,具体参考上文中催化循环图示。
小编所感
- 以醛与溴化物为原料合成酮的现有的报道中,本方法的底物适用性最广。
- 该反应对于芳香族的醛底物来说,反应性比较差,而且需要在非常稀释条件下进行,从这点来说对于大量合成来说是一个巨大的问题。另外photoredox条件的必然性就是对氧化,还原敏感的官能团是致命的。
参考文献
- Ruan, J.; Saidi, O.; Iggo, J. A.; Xiao, J. J. Am. Chem. Soc. 2008, 130 10510. DOI: 10.1021/ja804351z
- Huang, Y.-C.; Majumdar, K. K.; Cheng, C.-H. J. Org. Chem. 2002, 67, 1682. DOI: 10.1021/jo010289i
- Pucheault, M.; Darses, S.; Genet, J.-P. J. Am. Chem. Soc. 2004, 126, 15356. DOI: 10.1021/ja044749b
- Suchand, B.; Satyanarayana, G. J. Org. Chem. 2016, 81, 6409. DOI: 10.1021/acs.joc.6b01064
- Shaw, M. H.; Shurtleff, V. W.; Terrett, J. A.; Cuthbertson, J. D.; MacMillan, D. W. C. Science 2016, 352, 1304. DOI: 10.1126/science.aaf6635
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!















No comments yet.