作者:石油醚
导读
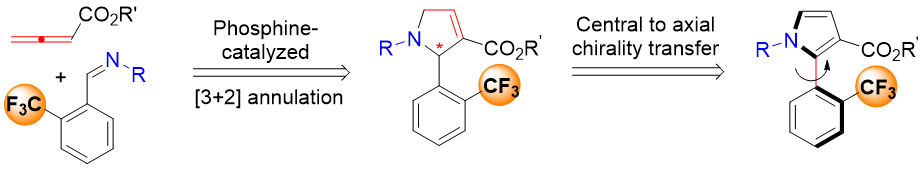
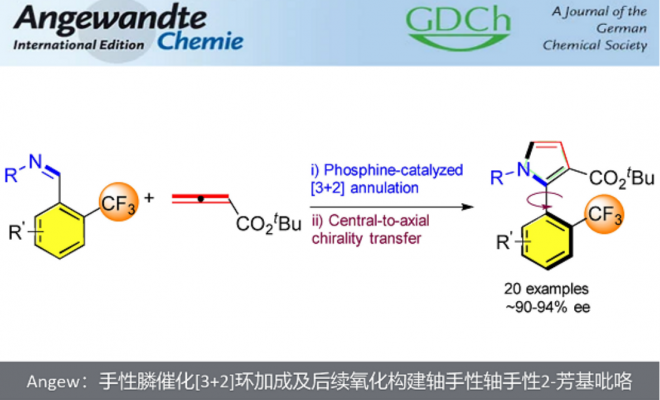
近日,新加坡国立大学的卢一新课题组在Angew. Chem. Int. Ed.上发表论文,报道一种手性膦催化的[3+2]环加成及后续氧化促进的中心手性到轴手性转移的反应策略,进而成功实现一系列轴手性2-芳基吡咯化合物的制备。
“Synthesis of Axially Chiral CF3-Substituted 2-Arylpyrroles by Sequential Phosphine-Catalyzed Asymmetric [3+2] Annulation and Oxidative Central-to-Axial Chirality Transfer.
Chuan Xiang Alvin Tan, ui Li, uhao Zhang, ei Dai, isar Ullah* Yixin Lu*
Angew. Chem. Int. Ed., 2022, ASAP. doi:10.1002/anie.202209494.
正文
轴手性广泛存在于生物活性分子和药物分子中,并且轴手性化合物在不对称催化合成中有着非常重要的应用。尽管轴手性联芳基化合物的合成已经得到了广泛的关注,但是在五元杂环和芳环之间构建轴手性的不对称合成方法较少。这主要是因为与六元环联芳基轴手性化合物相比,五元杂环与轴之间的夹角更大,从而使其阻转异构体的能垒更低,所以其合成面临着较大的挑战性。因此,新加坡国立大学的卢一新课题组设计了一种手性膦催化的[3+2]环加成及后续氧化促进的中心手性到轴手性转移的反应策略,构建了一系列的轴手性2-芳基吡咯化合物。
首先,作者采用2-CF3取代的苯磺酰亚胺1a和联烯酸酯2作为反应底物,筛选并优化一系列催化剂、溶剂及不同酯基取代的联烯酸酯2,进而得到最优的反应条件为:采用P3作为催化剂,甲苯为溶剂及联烯酸叔丁酯为反应底物,室温下反应4小时即可得到高收率和高立体选择性的[3+2]环化产物3-吡咯啉3a。
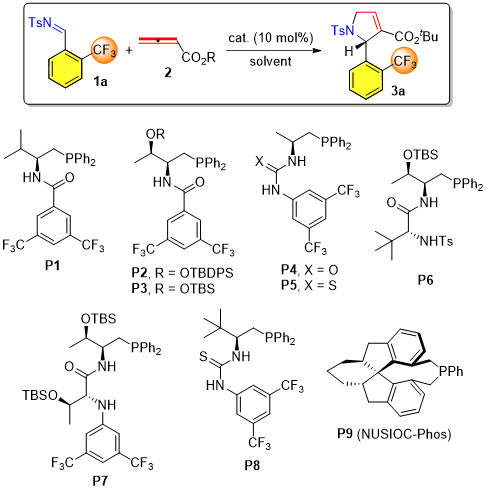
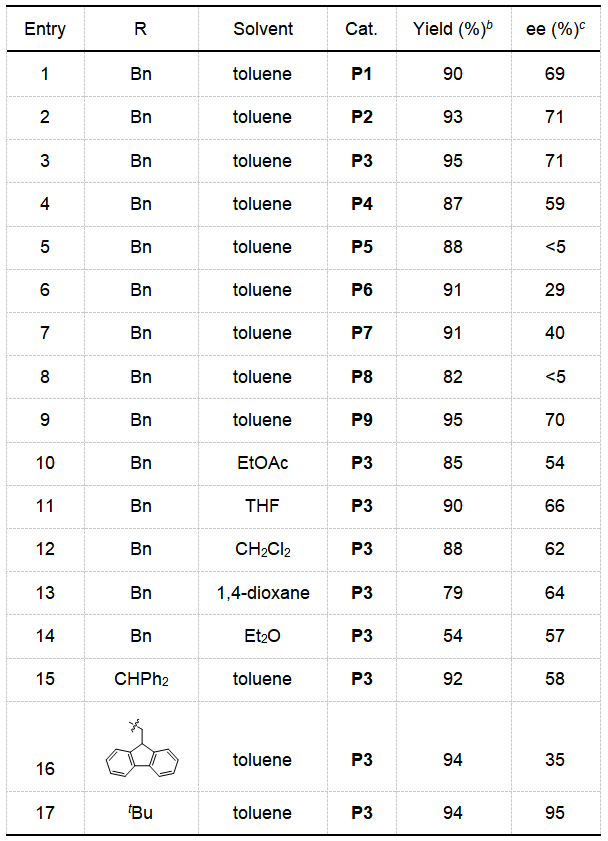
[a] Reaction conditions: 1a (0.12 mmol), 2 (0.1 mmol), and the catalyst (0.01 mmol) in the solvent specified (1.0 mL) at room temperature for 4 h. [b] Isolated yield. [c] Determined by HPLC analysis on a chiral stationary phase. THF = tetrahydrofuran, Ts = 4-toluenesulfonyl, TBS = tert-butyldimethylsilyl, TBDPS = tert-butyldiphenylsilyl。
接着,作者对由氧化促进的中心手性转化为轴手性的反应条件进行了探究。作者筛选了一系列的氧化剂,进而确定了最优的氧化剂为Pb(OAc)4。

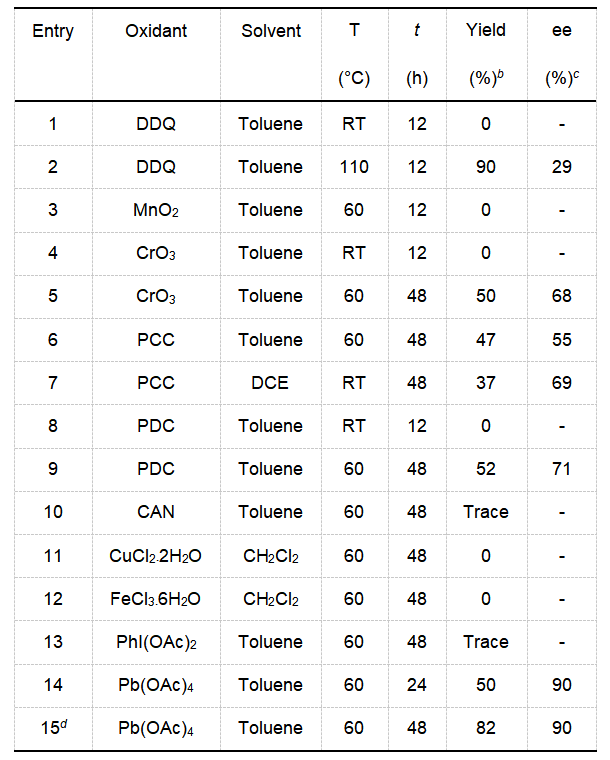
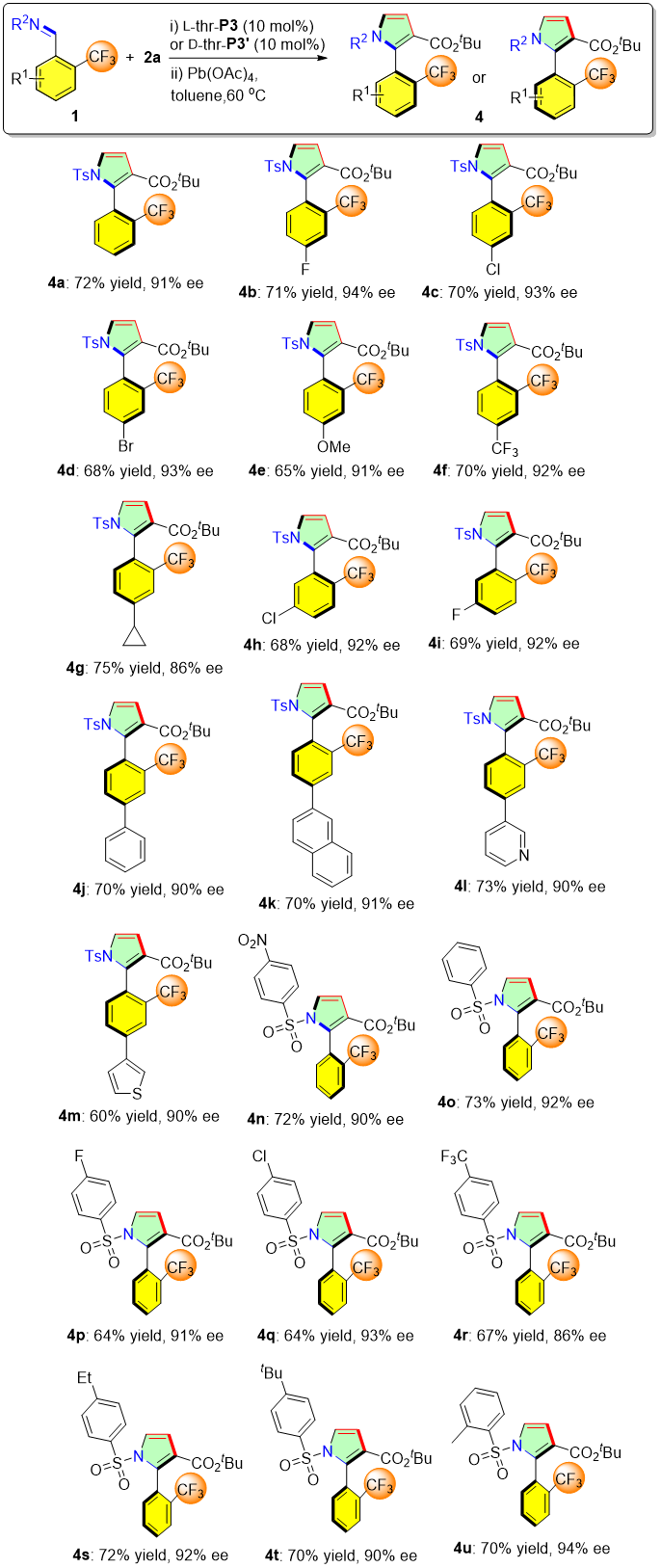
在得到了最优的反应条件后,作者接着对反应的底物范围进行了研究。
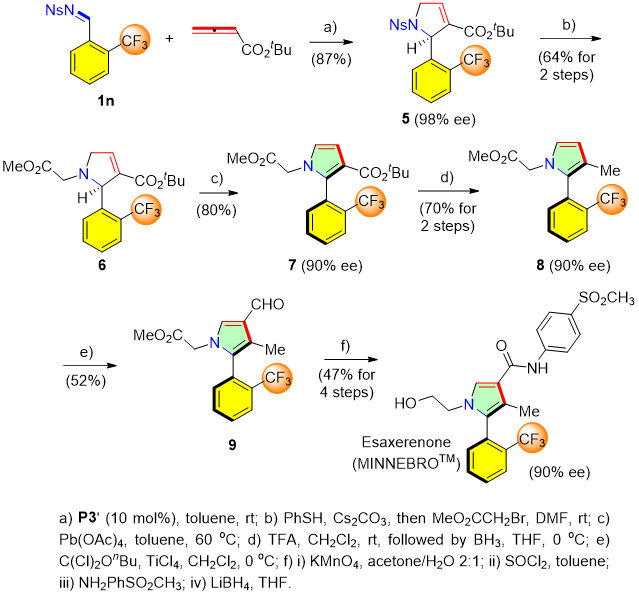
为了揭示该反应方法的实用性,作者首次实现了药物埃沙西林酮的不对称合成。该药物被用来治疗高血压,但是该药物目前的制备仍然依赖于动力学拆分。因此,作者提供了一条更加高效且便捷的合成方法。
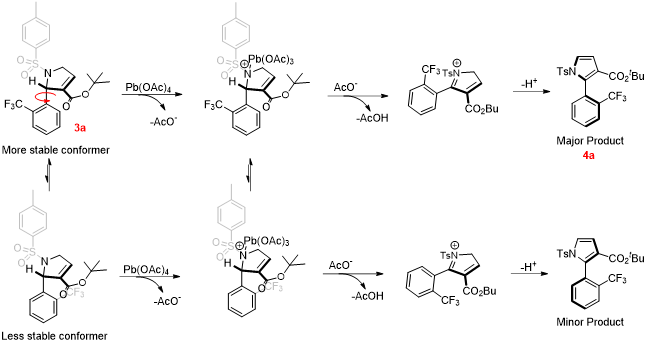
随后作者提出了中心手性转化为轴手性的可能反应机理。在手性转移过程中,轴手性对映选择性的降低主要是因为不稳定异构体也可以被氧化生成相对应的阻转异构体。
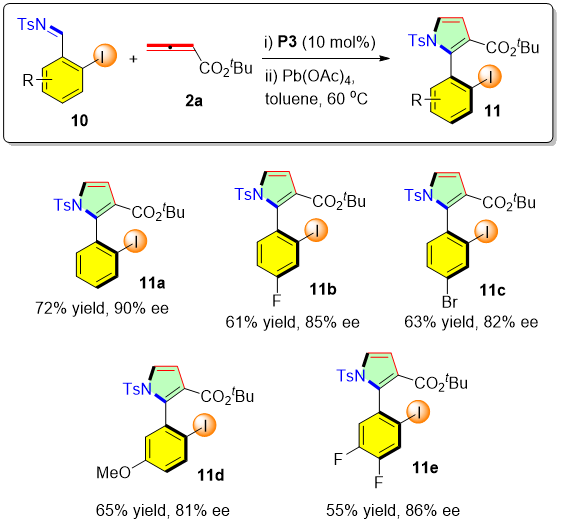
该方法同样也可以用于合成其它的2-芳基吡咯。当作者采用2-I取代的苯磺酰亚胺10和联烯酸叔丁酯2a作为底物时,在上述筛选出的最优的反应条件下可以得到一系列的碘代的2-芳基吡咯化合物。
总结
新加坡国立大学的卢一新课题组成功设计出一种手性膦催化的[3+2]环加成及后续氧化促进的中心手性到轴手性转移的反应策略,构建了一系列的2-芳基吡咯轴手性化合物。该反应具有优秀的底物适用范围和官能团兼容性,并应用于抗高血压药物埃沙西林酮的首次不对称全合成。作者相信该反应的开发为后续2-芳基吡咯轴手性化合物的广泛应用提供了坚实基础。
(卢一新教授供稿)
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载

















No comments yet.