本文作者:杉杉
导读
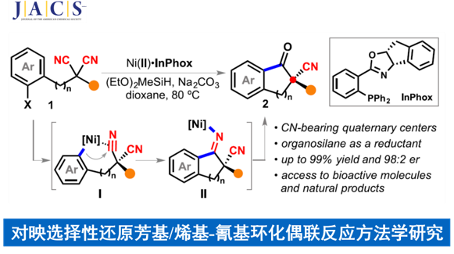
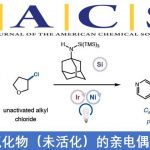
近日,武汉大学的刘文博课题组在J. Am. Chem. Soc.中发表论文,报道一种全新的通过镍催化剂促进的各类C(sp2)-亲电基团与氰基官能团之间的对映选择性分子内还原交叉偶联反应方法学,进而成功完成一系列对映富集的含氰基四级立体中心的手性分子的构建。这一全新的对映选择性分子内去对称化还原交叉偶联环化策略具有优良的对映选择性、广泛的底物应用范围以及潜在的合成应用价值等优势。
Enantioselective Nickel-Catalyzed Reductive Aryl/Alkenyl-Cyano Cyclization Coupling to All-Carbon Quaternary Stereocenters
Chen, R. Sun, F. Yao, X. Hu, L. Xiang, H. Cong, W. Liu, J. Am. Chem. Soc.2022, 144, 4776. doi: 10.1021/jacs.2c01237.
正文
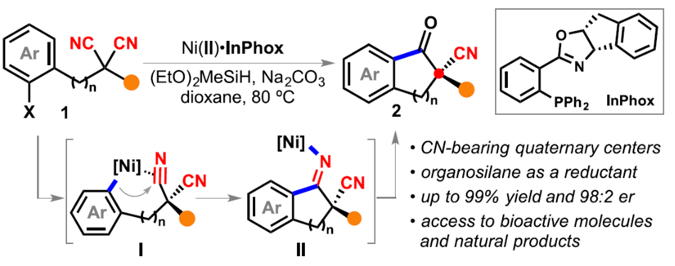
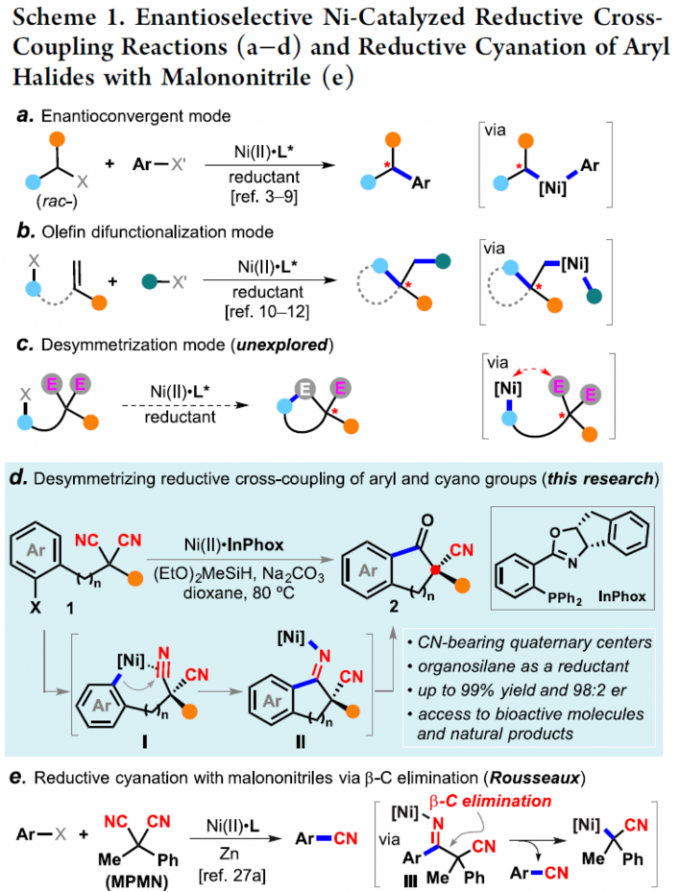
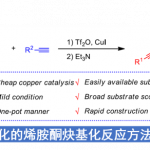
目前,过渡金属催化的还原交叉偶联反应方法学[1]-[7]已经成为构建C-C键的一种极为关键的反应策略(Scheme 1),尤其将其应用于各类具有四级中心的有机分子的构建[8]。这里,受到前期本课题组对于一系列二取代丙二腈分子参与的催化去对称化反应方法学[9]以及Rousseaux团队对于采用镍催化剂促进还原氰基化反应方法学 (Scheme 1e)[10]相关研究报道的启发,武汉大学的刘文博课题组报道一种全新的通过镍催化剂促进的芳基卤亲电结构单元与氰基官能团之间的对映选择性分子内还原交叉偶联反应方法学,进而成功完成一系列对映富集的并具有α-四级立体中心的茚满酮 (indanone)与四氢萘酮 (tetralone)分子的构建 (Scheme 1d)。
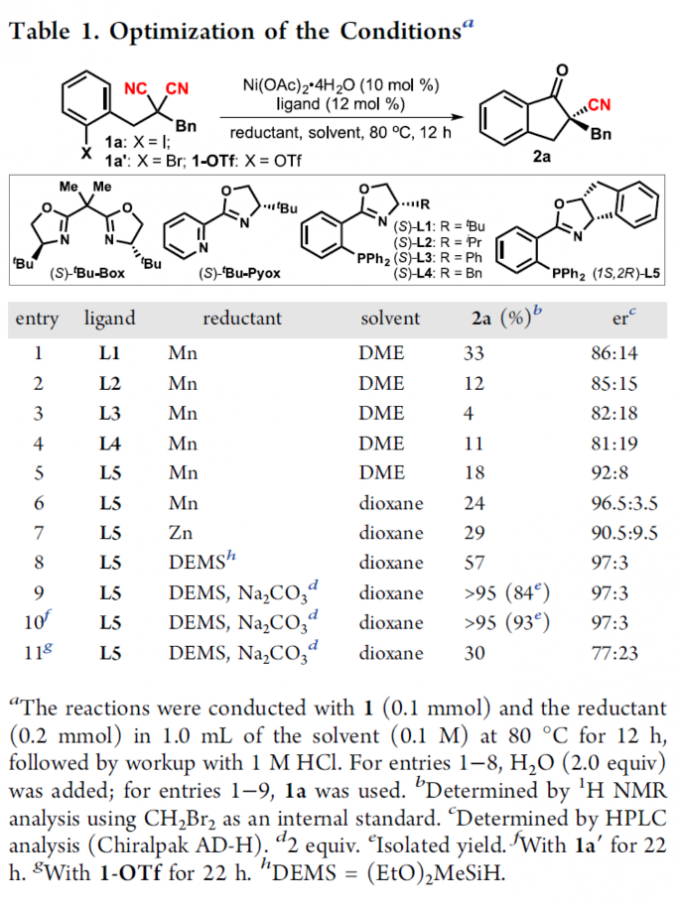
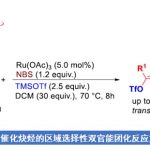
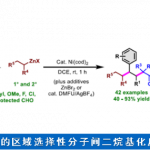
首先,作者采用二取代丙二腈1a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用Ni(OAc)2·4H2O作为催化剂,L5作为手性配体,DEMS (diethoxymethylsilane)作为还原剂,二氧六环作为反应溶剂,反应温度为80 oC,最终获得93%收率的手性产物2a (97:3 er)。
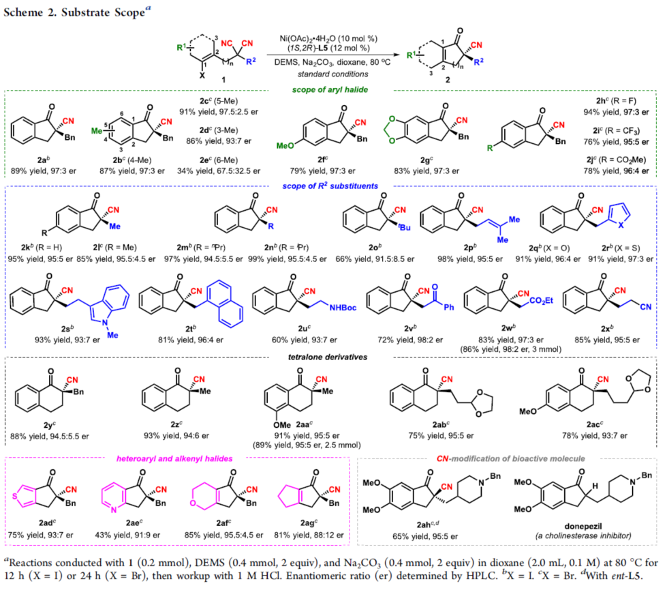
在上述的最佳反应条件下,作者对一系列二取代丙二腈底物的应用范围进行考察 (Scheme 2)。首先,作者对分子中芳基卤结构单元的立体与电子效应进行相关研究 (2b–2j)。实验表明,上述的标准反应体系对于在芳基卤结构单元的3-、4-或5-位带有甲基基团取代的丙二腈底物,均能够获得良好的反应收率与优良的对映选择性 (2b–2d)。然而,对于芳基卤结构单元的6-位具有甲基基团取代的丙二腈底物,则观察到目标产物2e中反应收率与对映选择性的显著降低。同时,作者发现,上述的标准反应条件对于芳基卤结构单元中存在各类供电子与吸电子基团取代的丙二腈底物,均能够有效地兼容,并以良好的反应收率以及高度的对映选择性,获得相应的对映富集产物2f–2j。接下来,作者对于丙二腈结构单元中α-位置的官能团的兼容性进行深入研究 (2k−x)。作者发现,上述的标准反应体系对于丙二腈结构单元中前手性四级中心的立体效应缺乏显著的敏感性。同时,底物中的R2取代基团为甲基、丙基以及异丙基、叔丁基、烯丙基以及富电子的杂环芳基时,均能够获得高度对映富集的手性产物2k–2s。同时,作者发现,这一全新的对映选择性环化策略具有良好的官能团兼容性。而且,这一策略同样能够有效地应用于一系列具有α-四级中心的四氢萘酮类分子的构建2y–2ac。之后,该小组进一步发现,一系列具有杂芳基卤 (2ad-2ae)以及环烯基卤 (1af–1ag)结构单元的丙二腈底物,同样能够有效地参与上述的对映选择性合成转化过程。同时,这一全新的环化策略同样能够进一步应用于氰基取代的donepezil生物活性分子2ah的构建。
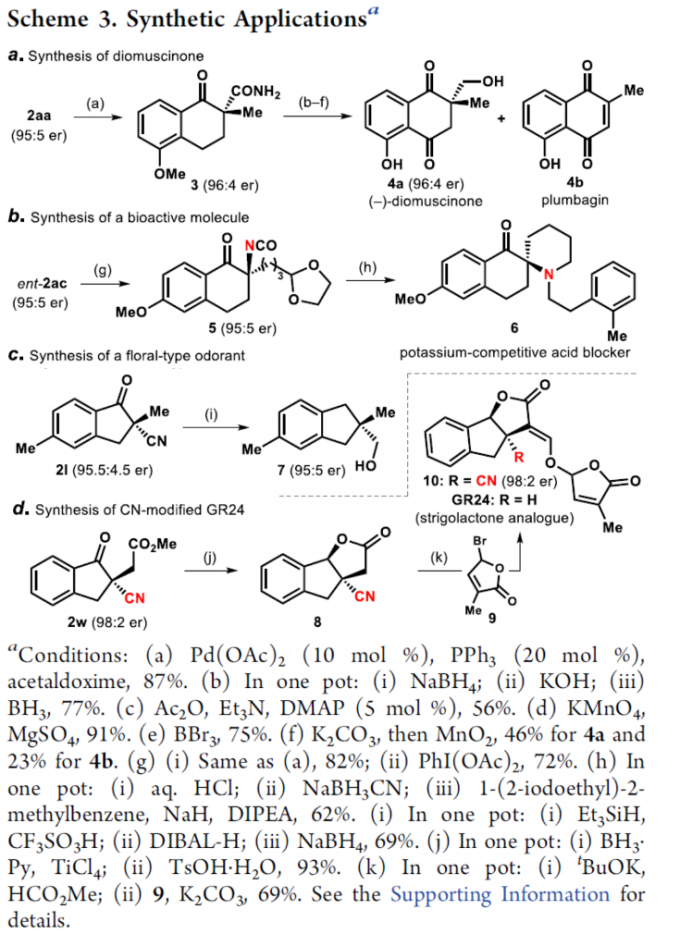
接下来,该小组通过如下的一系列研究进一步表明,这一全新的对映选择性环化策略具有良好的合成应用价值 (Scheme 3)。
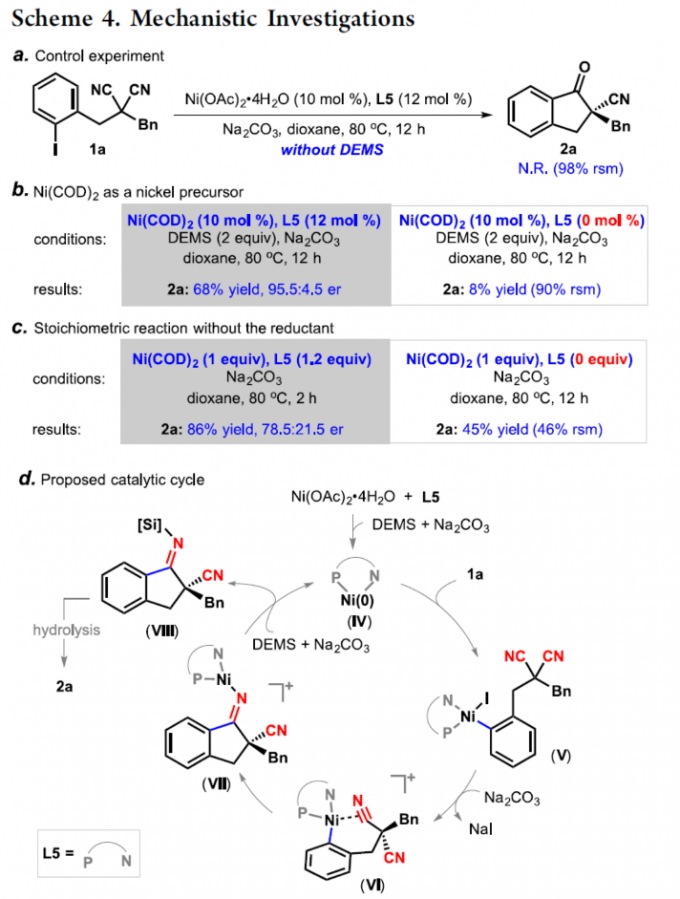
之后,作者通过控制实验以及一系列化学计量反应实验的相关研究 (Scheme 4a-c)表明,上述的环化过程通过镍(0)配合物引发,同时,需要加入还原剂,将反应过程中形成的高价镍配合物还原,进而完成后续的催化循环。基于上述的实验研究以及前期相关的文献报道[2], [10],作者提出如下合理的反应机理 (Scheme 4d)。
总结
武汉大学的刘文博课题组成功设计出一种全新的通过镍催化剂促进的各类C(sp2)-亲电基团与氰基官能团之间的对映选择性去对称化还原交叉偶联反应方法学,进而成功完成一系列对映富集的含氰基四级立体中心的手性分子的构建。这一全新的对映选择性分子内去对称化还原交叉偶联环化策略具有优良的官能团兼容性、优良的对映选择性、广泛的底物应用范围以及潜在的合成应用价值等优势。
参考文献
- [1] A. H. Cherney, N. T. Kadunce, S. E. Reisman, J. Am. Chem. Soc. 2013, 135, 7442. doi: 10.1021/ja402922w.
- [2] K. E. Poremba, S. E. Dibrell, S. E. Reisman, ACS Catal. 2020, 10, 8237. doi: 10.1021/acscatal.0c01842.
- [3] H. Guan, Q. Zhang, P. J. Walsh, J. Mao, Angew. Chem. Int. Ed. 2020, 59, 5172. doi: 10.1002/anie.201914175.
- [4] B. P. Woods, M. Orlandi, C. Y. Huang, M. S. Sigman, A. G. Doyle, J. Am. Chem. Soc. 2017, 139, 5688. doi: 10.1021/jacs.7b03448.
- [5] A. Banerjee, H. Yamamoto, Org. Lett. 2017, 19, 4363. doi: 10.1021/acs.orglett.7b02076.
- [6] Q. Pan, Y. Ping, Y. Wang, Y. Guo, W. Kong, J. Am. Chem. Soc. 2021, 143, 10282. doi: 10.1021/jacs.1c03827.
- [7] J. He, Y. Xue, B. Han, C. Zhang, Y. Wang, S. Zhu, Angew. Chem. Int. Ed. 2020, 59, 2328. doi: 10.1002/anie.201913743.
- [8] (a) Y. Minko, M. Pasco, L. Lercher, M. Botoshansky, I. Marek, Nature 2012, 490, 522. doi: 10.1038/nature11569.
- (b) K. W. Quasdorf, L. E. Overman, Nature 2014, 516, 181. doi: 10.1038/nature14007.
- (c) Y. Liu, S. Han, W. Liu, B. M. Stoltz, Acc. Chem. Res. 2015, 48, 740. doi: 10.1021/ar5004658.
- (d) T. T. Talele, J. Med. Chem. 2020, 63, 13291. doi: 10.1021/acs.jmedchem.0c00829.
- (e) P. Hu, H. M. Chi, K. C. DeBacker, X. Gong, J. H. Keim, I. T. Hsu, S. A. Snyder, Nature 2019, 569, 703. doi:10.1038/s41586-019-1179-2.
- (f) W. Xue, X. Jia, X. Wang, X. Tao, Z. Yin, H. Gong, Chem. Soc. Rev. 2021, 50, 4162. doi: 10.1039/D0CS01107J.
- [9] (a) J. Cai, L. Bai, Y. Zhang, Z. Wang, F. Yao, J. Peng, W. Yan, Y. Wang, C. Zheng, W. Liu, Chem. 2021, 7, 799. doi: 10.1016/j.chempr.2021.02.013.
- (b) X. Hu, Z. Chen, J. Zhao, R. Sun, H. Zhang, X. Qi, W. Liu, J. Am. Chem. Soc. 2021, 143, 3734. doi: 10.1021/jacs.1c00840.
- (c) Z. Lu, X. Hu, H. Zhang, X. Zhang, J. Cai, M. Usman, H. Cong, W. Liu, J. Am. Chem. Soc. 2020, 142, 7328. doi: 10.1021/jacs.0c02075.
- (d) J. Cai, L. Bai, Y. Zhang, Z. Wang, F. Yao, J. Peng, W. Yan, Y. Wang, C. Zheng, W. Liu, Chem. 2021, 7, 799. doi: 10.1016/j.chempr.2021.02.013.
- [10] L. R. Mills, J. M. Graham, P. Patel, S. A. L. Rousseaux, J. Am. Chem. Soc. 2019, 141, 19257. doi: 10.1021/jacs.9b11208.
- [10] T. Moragas, A. Correa, R. Martin, Chem. – Eur. J. 2014, 20, 8242. doi: 10.1002/chem.201402509.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载















No comments yet.