作者:石油醚
导读:
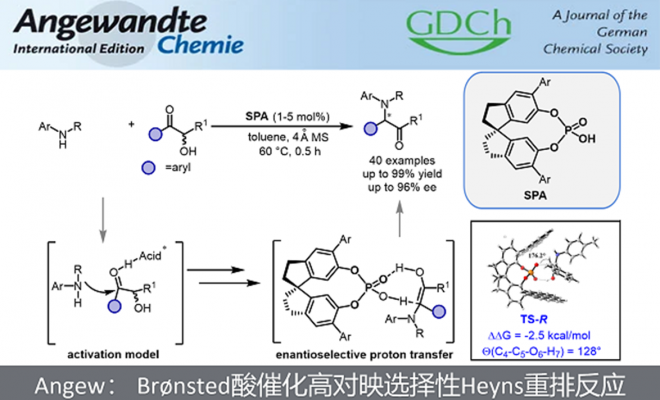
南开大学化学学院朱守非课题组报道了首例Brønsted酸催化的不对称Heyns重排反应,以高收率(up to 99%)和高对映选择性(up to 96% ee)合成了系列α-芳基-α-氨基酮,这是此前不对称Heyns反应无法合成的。该反应条件温和,操作简单,收率和选择性高,易于放大,实用性好。该方法被成功用于多种手性胺合成,提高了一些生物活性分子的合成效率。机理实验表明手性磷酸催化了酮胺缩合、亚胺异构化和烯醇质子迁移三个过程,并在催化质子转移过程中实现了手性控制。该成果近期发表于Angew. Chem. Int. Ed. 2022, (https://doi.org/10.1002/anie.202212976),博士生曹晋是文章的第一作者。
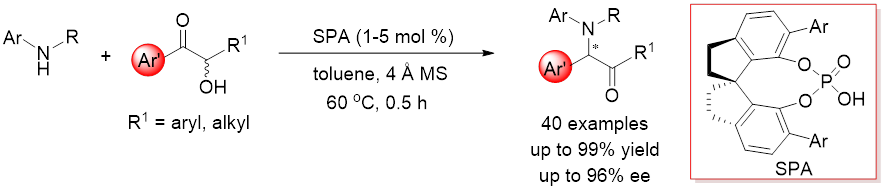
图1. Brønsted酸催化高对映选择性Heyns重排反应
“Highly Enantioselective Brønsted Acid Catalyzed Heyns Rearrangement.
Jin Cao, Yu-Xuan Su, Xin-Yu Zhang, Shou-Fei Zhu*
Angew. Chem. Int. Ed. 2022, ASAP. Doi: 10.1002/anie.202212976.
正文:
手性胺是很多天然产物和药物的核心结构单元,也广泛用作手性配体和催化剂。因此,发展从简单原料合成手性胺的方法具有重要意义。Heyns重排反应通过α-羟基酮与胺反应直接合成α-胺基酮,仅产生一分子水为副产物,是合成手性胺的高效方法。近年来,有报道使用手性碱催化剂实现了该反应的不对称转化,但存在催化剂用量高、对映选择性不理想、底物局限等问题。例如,手性碱催化体系仅用于合成手性α-烷基-α-胺基酮,在合成α-芳基-α-胺基酮中未见成功报道。这可能是由于α-芳基-α-胺基酮具有更强酸性的α-H,在碱性催化剂存在下易于消旋化。
此前,南开大学朱守非课题组提出了“手性质子梭催化剂”概念,使用同时含有Brønsted酸和Brønsted碱的手性双功能催化剂作为手性质子梭,通过协同的方式,直接催化烯醇及烯醇盐中间体的质子迁移过程,实现了多种极具挑战的质子转移反应的有效手性控制(Angew. Chem. Int. Ed. 2011, 50, 11483; Angew. Chem. Int. Ed. 2014, 53,3913; Chem. Sci. 2014, 5, 1442; J. Am. Chem. Soc. 2015, 137, 8700; Chem. Sci. 2016, 7, 1104; Chem. Sci. 2017, 8, 7197; Acta Chim. Sinica. 2018, 76, 883; ACS Catal. 2019, 9, 6522; Org. Lett. 2019, 21, 9391; Science 2019, 366, 990; J. Am. Chem. Soc. 2020, 142, 10557; J. Am. Chem. Soc. 2021, 143, 6962; ACS Catal. 2022, 12, 13143)。在上述研究基础上,他们实现了首例手性Brønsted酸催化的不对称Heyns重排反应,以高收率(up to 99%)和高对映选择性(up to 96% ee)合成了系列手性α-芳基-α-胺基酮化合物,这是此前不对称Heyns反应无法合成的。
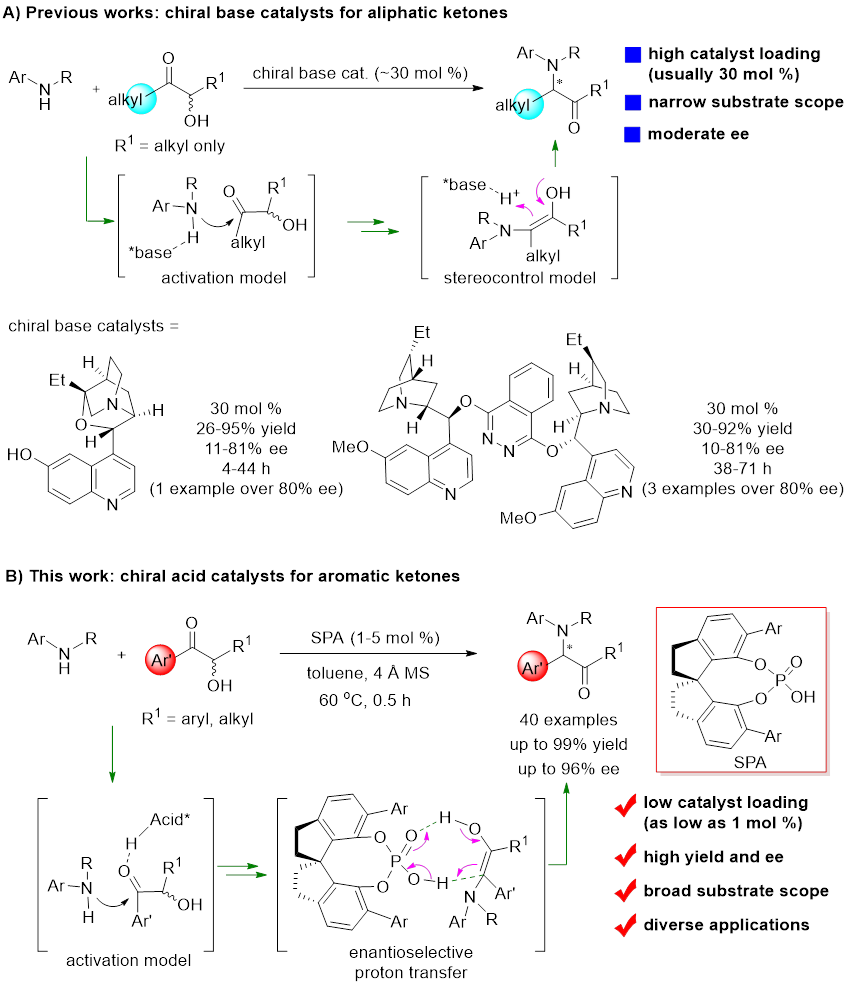
图2. 对映选择性Heyns重排反应
该反应效率很高。在反应普适性考察中,所有的底物都能在30分钟内完全转化(图3)。反应的底物适用范围较广,α-羟基酮两侧取代基可以为芳基-烷基和芳基-芳基,均能获得优秀的收率和对映选择性。芳基上带有吸电子取代基能给出更好的结果,且产物在反应过程中不会发生消旋化。烷基基团可以是直链烷基、支链烷基、官能化的烷基和苄基。带有给电子基和弱吸电子基的芳胺底物能给出较好的结果,但酰胺和烷基胺在此反应中没有活性。反应可以耐受稠环、芳杂环,以及卤素、酯基、硝基、硅基等多种官能团。
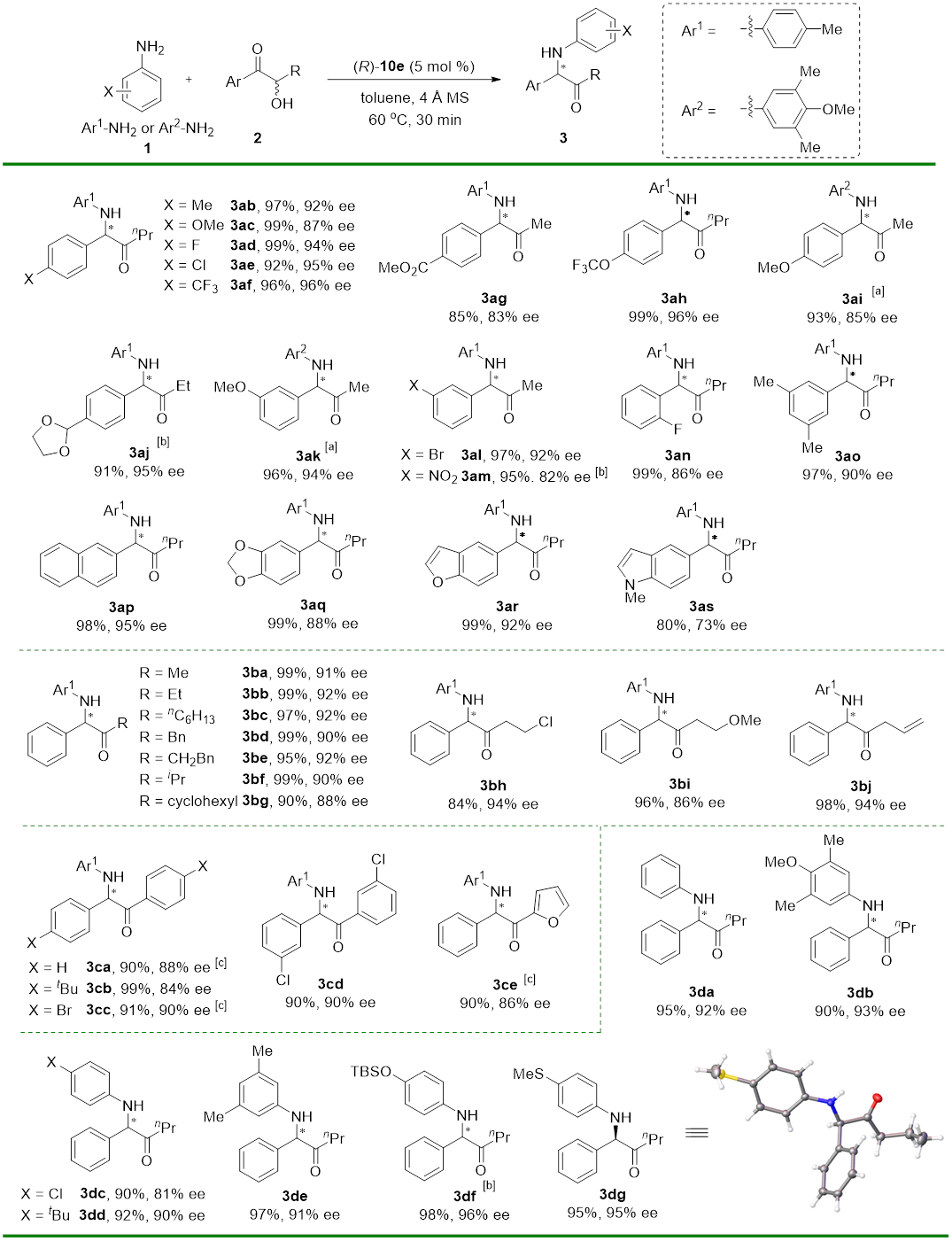
Reaction conditions: 1/2/(R)-10e = 0.1:0.6:0.005 (mmol), in 0.5 mL of solvent at 60 °C, 30 min. [a] Reaction performed in 0.2 mmol scale. [b] (S)-10e was used as catalyst. [c] 1 mL PhOMe was used as solvent.
图3. 底物适用范围
该反应操作简单,容易放大,所得手性α-芳基-α-胺基酮产物可以对映选择性保持地转化为多种手性胺,展现出很好的应用潜力(图4)。作者还将该方法成功应用于生物活性分子(TNF-α抑制剂、脱氧cytoxazone)的合成中,显著提高了合成效率。
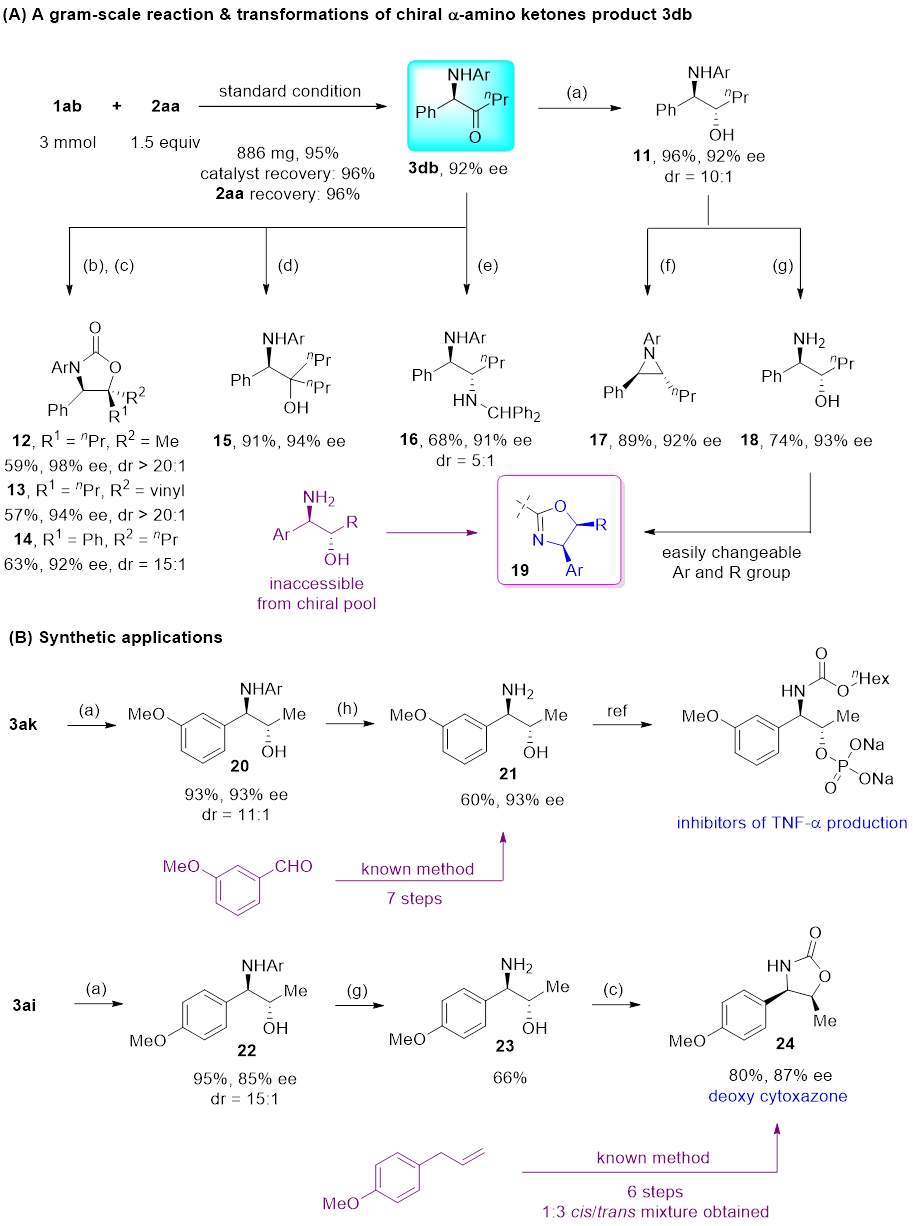
(a) BH3-SMe2, THF, -20 °C. (b) RMgBr, THF, -78 °C. (c) Triphosgene, Et3N, THF. (d) nPrMgBr, THF, 0 °C. (e) TiCl4, Ph2CHNH2, Et2O, 0 °C – rt. Then BH3-SMe2, -30 °C. (f) Diethyl azodicarboxylate, PPh3, THF, 0 °C – rt. (g) Ceric ammonium nitrate, MeCN/H2O, 0 °C – rt. (h) Trichloroisocyanuric acid, H2SO4, MeCN/H2O, rt.
图4. 克级规模实验及产物转化
该Brønsted酸催化的不对称Heyns重排存在两种可能的反应过程(图5A)。作者通过氘代实验排除了1,2-负氢迁移的机制(图5B),说明了反应中可能经历了烯醇中间体并发生了氢氘交换(图5C);α-羟基酮底物的光学纯度不影响反应的对映选择性(图5D),进一步排除了负氢迁移的可能性;KIE实验表明烯醇的生成不是反应的决速步(图5 E和F)。作者认为,手性磷酸催化了酮胺缩合、亚胺异构化和烯醇质子迁移三个过程,并在催化质子转移过程中实现了手性控制。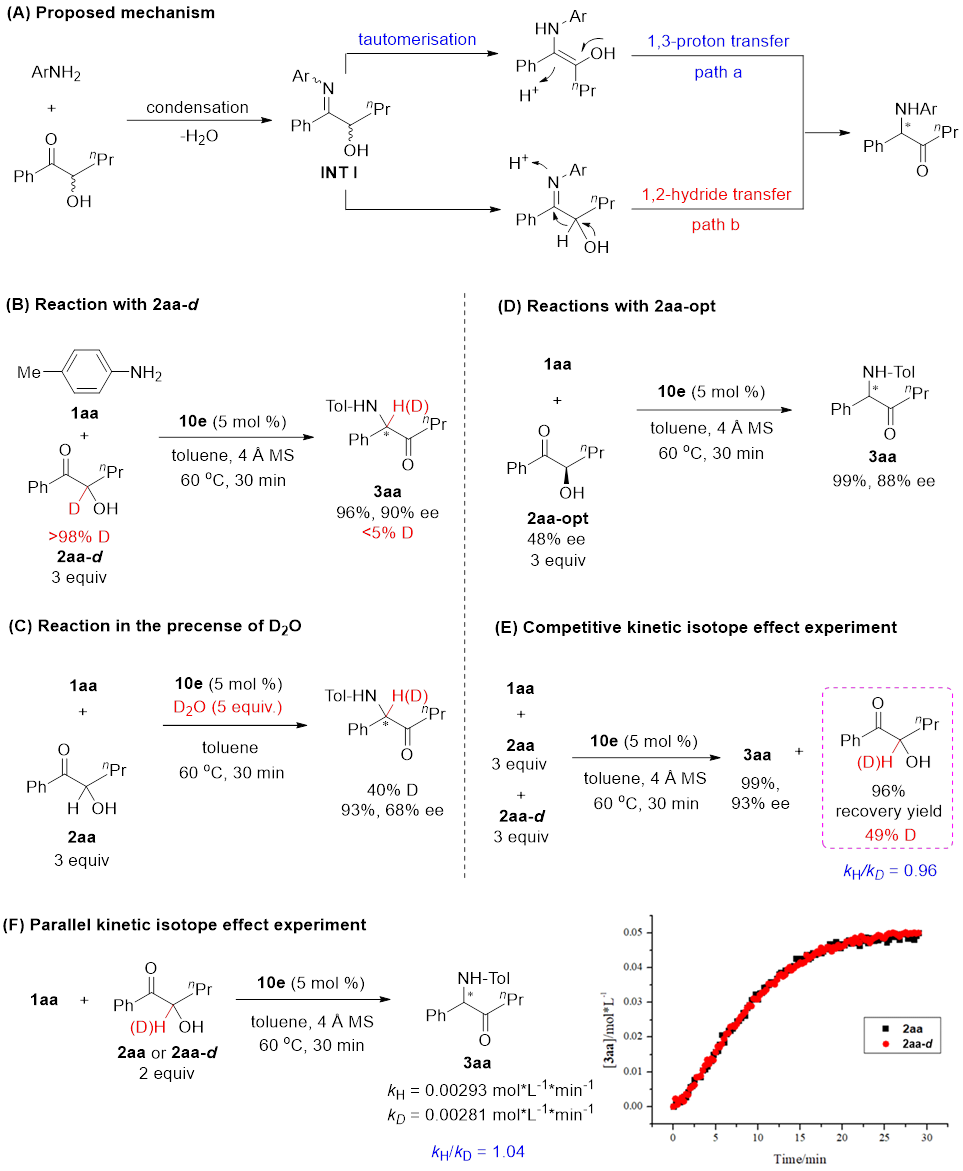
图5. 机理实验
理论计算表明过渡态能量与两方面因素密切相关:一是催化剂与烯醇的轨道重叠程度,二是烯醇的稳定性。在优势过渡态TS-R中,分子轨道重叠优于相应的TS-S过渡态,作者认为过渡态轨道最大重叠需求是手性质子梭实现手性控制的主要驱动力。此外,作者观察到了底物芳环取代基电性显著影响对映选择性的现象。理论计算表明,缺电子芳环与烯醇的二面角发生了更大程度的扭转。这种形变影响了底物与催化剂的相互作用,最终表现为底物电性对于反应对映选择性的影响。(图6)
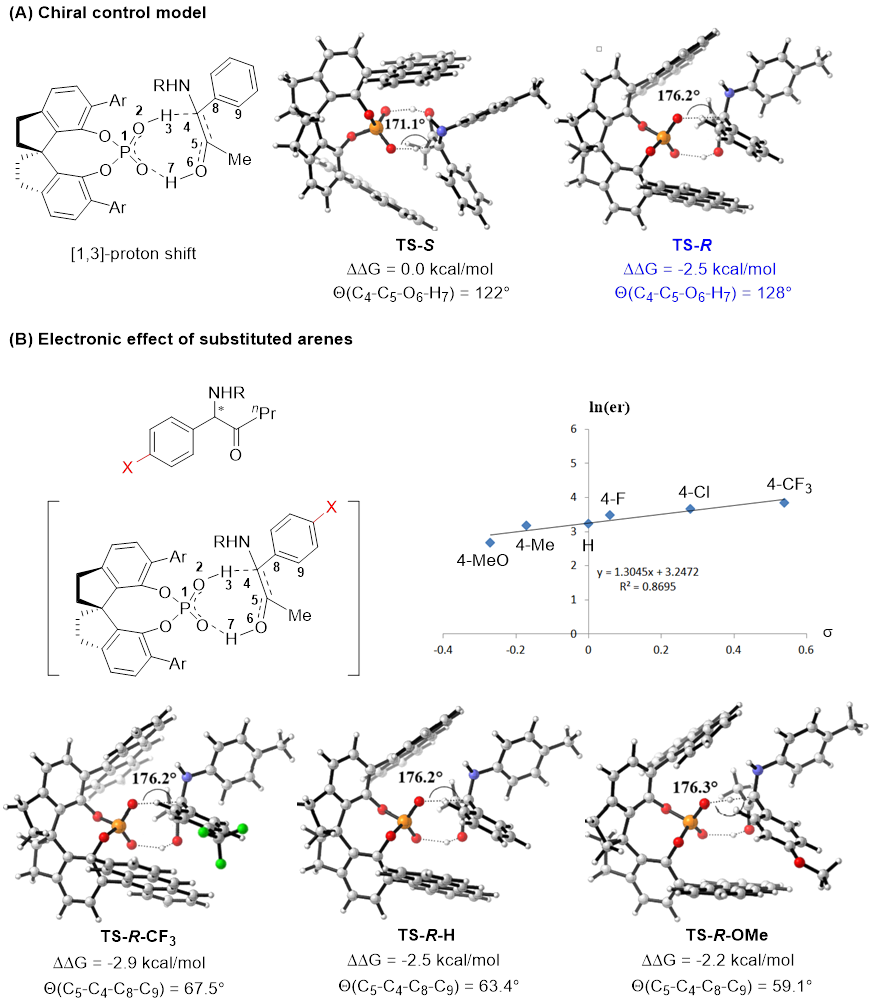
图6. DFT计算
总之,朱守非课题组实现了首例手性Brønsted酸催化的不对称Heyns重排反应。该反应效率高,底物适用范围广,能在温和条件下高对映选择性得到手性中心具有较强酸性氢的手性α-芳基-α-胺基酮化合物,这是文献中手性碱催化体系所无法实现的。反应产物可以发生丰富的转化,为复杂含氮功能分子的合成带来新的机遇。机理实验表明,反应经历了亚胺到烯胺以及烯醇到酮式两次异构化过程。手性磷酸通过氢键网络促进了烯醇/胺中间体的不对称质子转移。该反应为不对称Heyns重排反应的实际应用带来可能,其新颖的催化体系也为经历活性烯醇/胺中间体的反应的研究带来新的思路。
(朱守非教授供稿)
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载






















No comments yet.