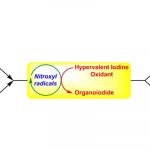
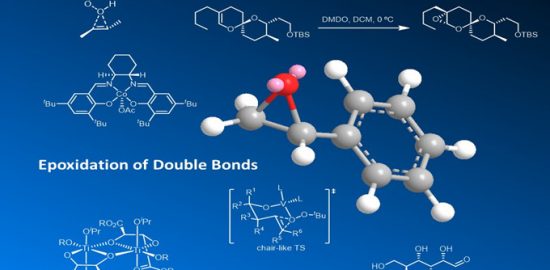
概要
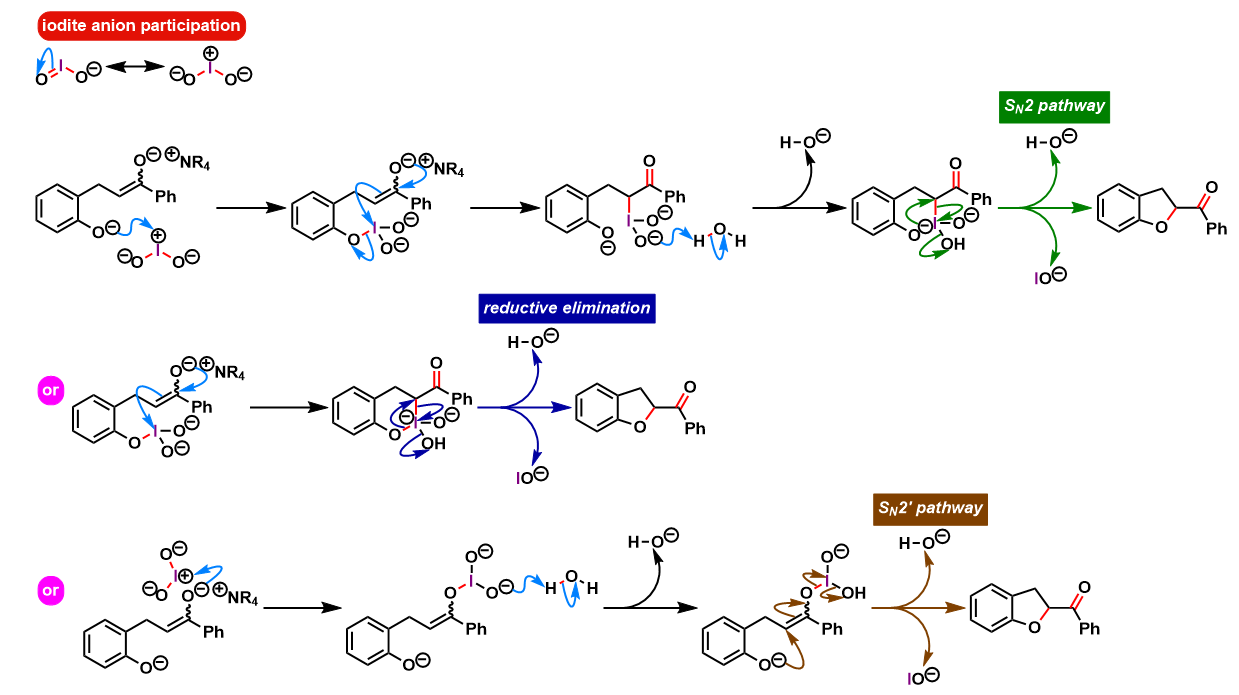
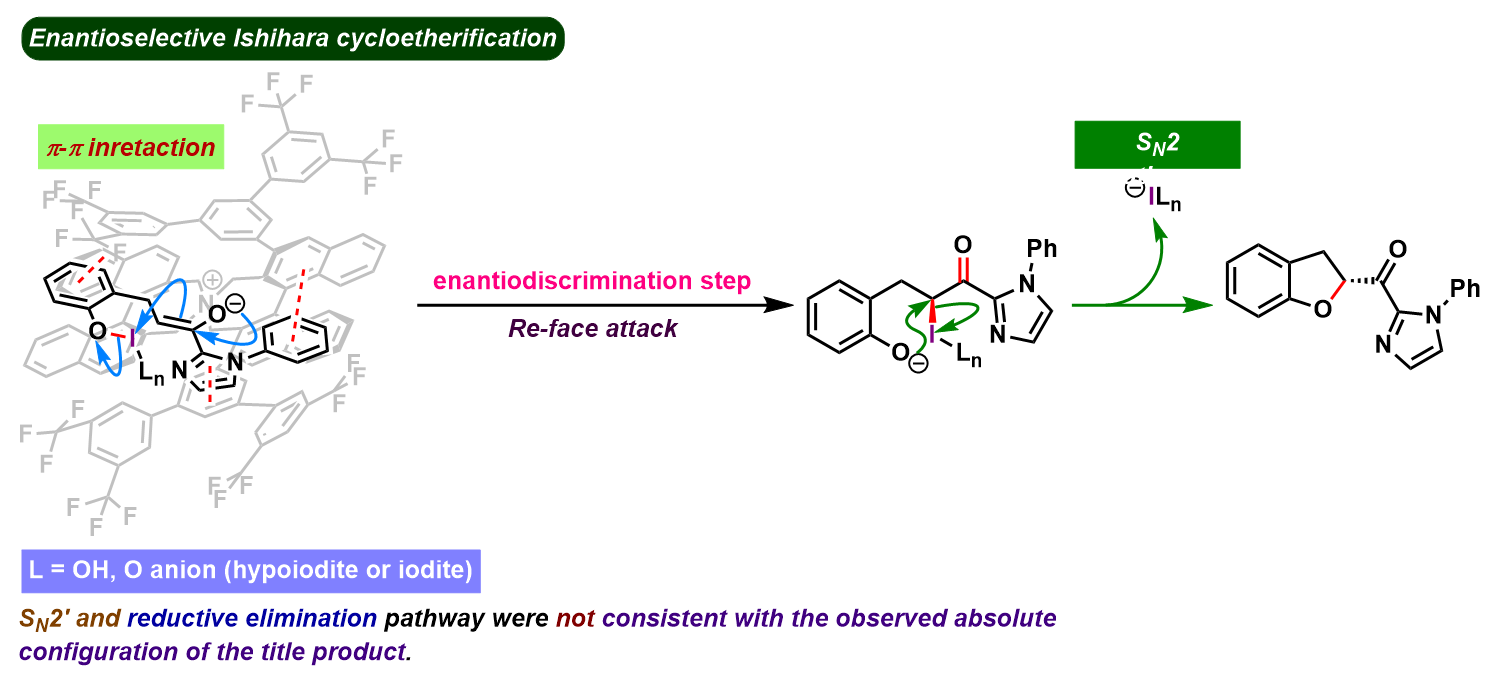
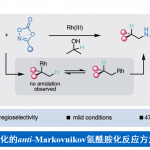
2010年日本名古屋大学工学院 (名古屋大学工学研究科, Graduate School of Engineering, Nagoya University)的石原一彰 (石原一彰, Ishihara Kazuaki)研究室报道了首例由次碘酸季铵盐/亚碘酸季铵盐(quaternary ammonium hypoiodite / quaternary ammonium iodite, 通过TBAI (tetrabutylammonium iodide)与H2O2或TBHP原位生成)参与的酮酚(ketophenol)的氧化环醚化过程,成功完成了2-酰基-2,3-二氢苯并呋喃类化合物的构建[1]。同时,Ishihara进一步采用原位产生的手性次碘酸及亚碘酸N-螺环季铵盐(N-spiro-type quaternary ammonium hypoiodite /iodite)催化剂,成功实现了酮酚(ketophenol)的对映选择性氧化环醚化[1]。
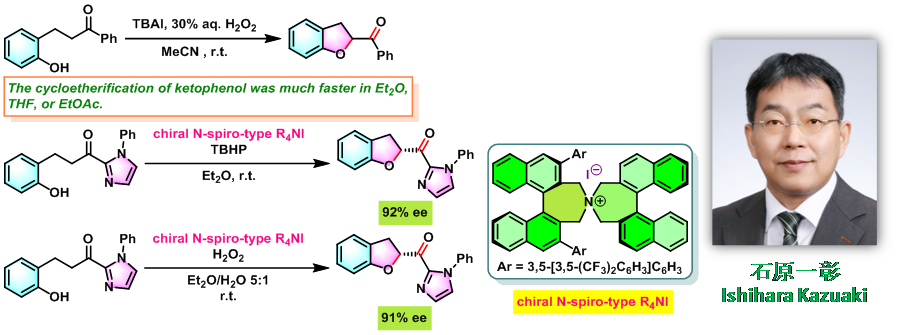
2016年,Ishihara采用CHP (cumene hydroperoxide)代替H2O2或TBHP,将上述条件应用于δ-羟基酮衍生物,并顺利完成手性2-酰基四氢呋喃骨架的构建[2]。
文献中将上述方法学称为Ishihara环醚化 (Ishihara cycloetherification)。该反应条件温和、环境友好,具有优良的化学选择性(反应过程中无酚的氧化产物生成)与优良的对映选择性。同时,生成的手性2-酰基-2,3-二氢苯并呋喃为各类生物活性化合物合成过程中的关键砌块[3]-[7]。
基本文献
- [1] M. Uyanik, H. Okamoto, T. Yasui, K. Ishihara, Science 2010, 328, 1376. doi: 10.1126/science.1188217.
- [2] M. Uyanik, H. Hayashi, H. Iwata, K. Ishihara, Chem. Lett. 2016, 45, 353. doi: 10.1246/cl.160004.
- [3] W. Wei, Y. Wang, J. Yin, J. Xue, Y. Li, Org. Lett. 2012, 14, 1158. doi: 10.1021/ol300107v.
- [4] L. Wei, J. Xue, H. Liu, W. Wang, Y. Li, Org. Lett. 2012, 14, 5302. doi: 10.1021/ol3024874.
- [5] M. Uyanik, H. Hayashi, K. Ishihara, Science 2014, 345, 291. doi: 10.1126/science.1254976.
- [6] B. J. Nachtsheim, Science 2014, 345, 270. doi: 10.1126/science.1257347.
- [7] T. Netscher, Angew. Chem. Int. Ed. 2014, 53, 14313. doi: 10.1002/anie.201409826.
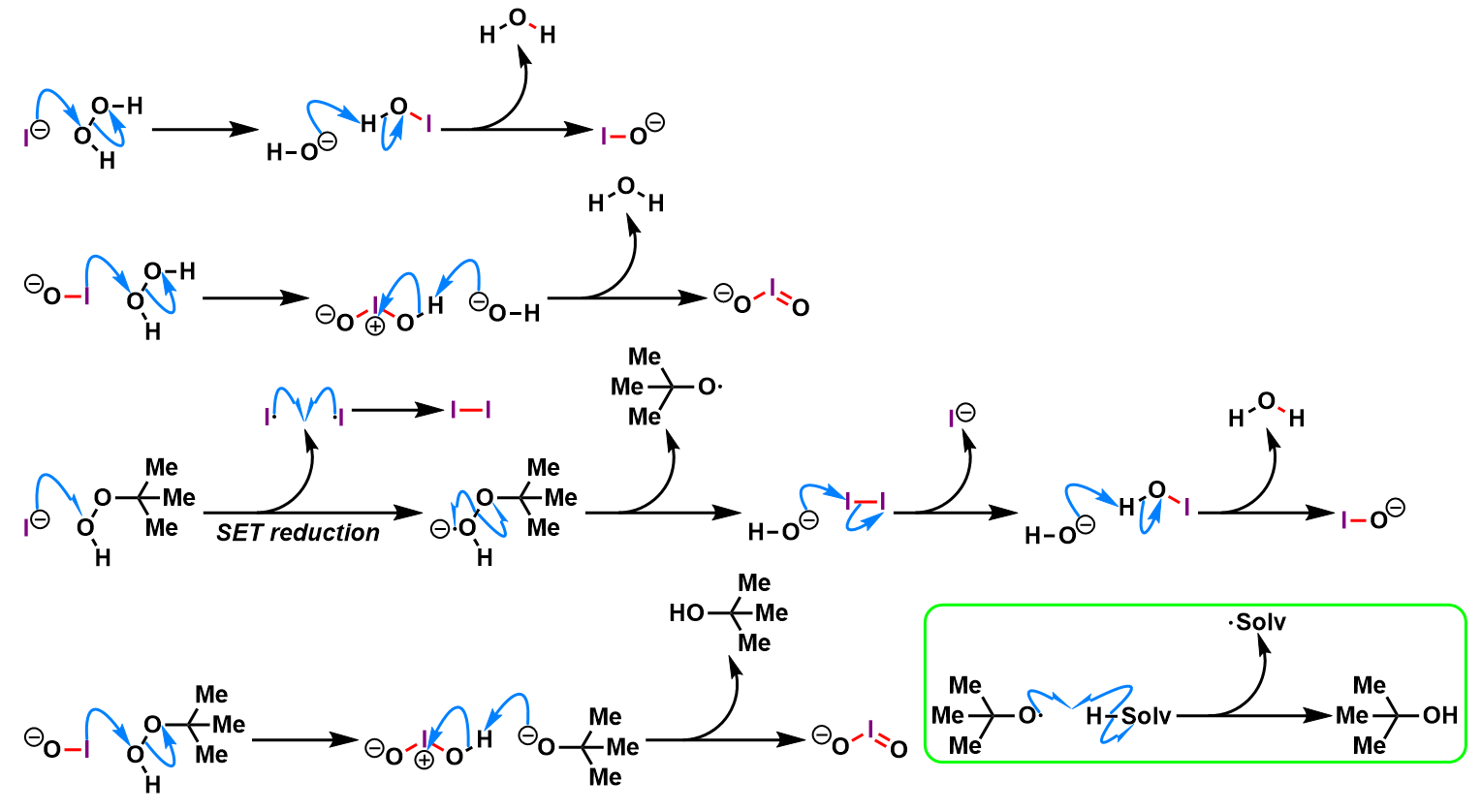
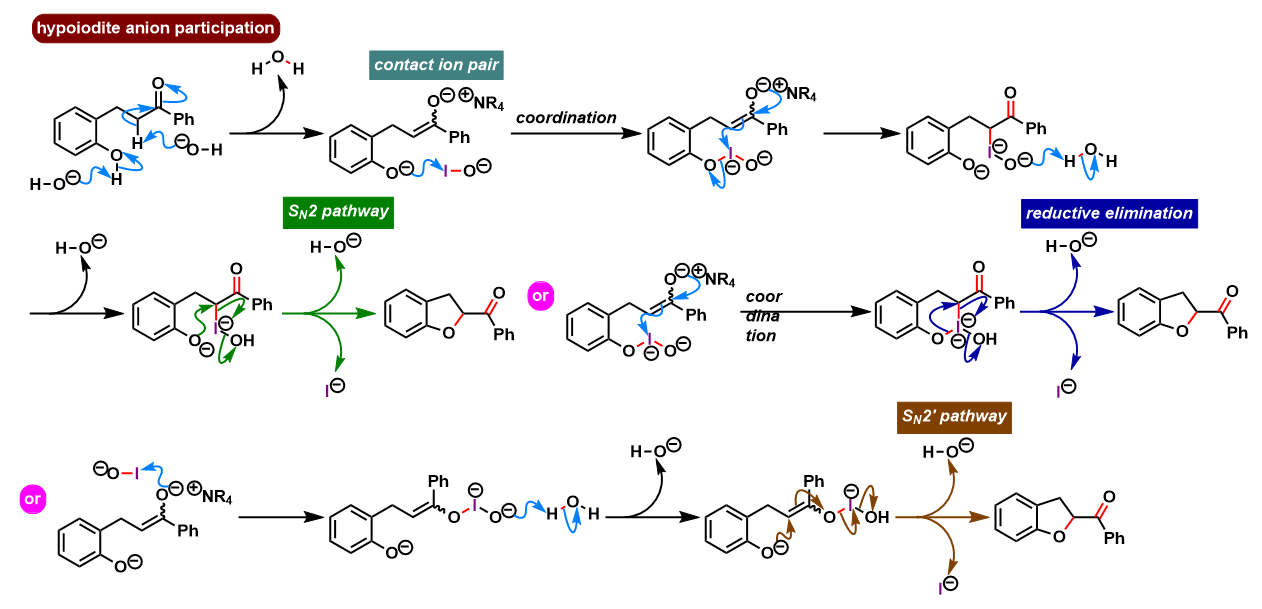
反应机理
参考文献
- [1] M. Uyanik, K. Ishihara, Chem. Cat. Chem. 2012, 4, 177. doi: 10.1002/cctc.201100352.
- [2] X. Li, C. Zhou, X. Xu, ARKIVOC 2012, (ix), 150. doi: 10.3998/ark.5550190.0013.913.
- [3] X. Wu, J. Gong, X. Qi, Org. Biomol. Chem. 2014, 12, 5807. doi: 10.1039/C4OB00276H.
- [4] P. Finkbeiner, B. J. Nachtsheim, Synthesis 2013, 45, 979. doi: 10.1055/s-0032-1318330.
- [5] Z. Liu, J. Zhang, S. Chen, E. Shi, Y. Xu, X. Wan, Angew. Chem. Int. Ed. 2012, 51, 3231. doi: 10.1002/anie.201108763.
- [6] W. Xu, B. J. Nachtsheim, Org. Lett. 2015, 17, 1585. doi: 10.1021/acs.orglett.5b00466.
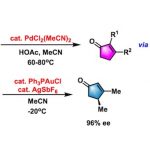
反应实例
tocopherols的不对称合成[1]
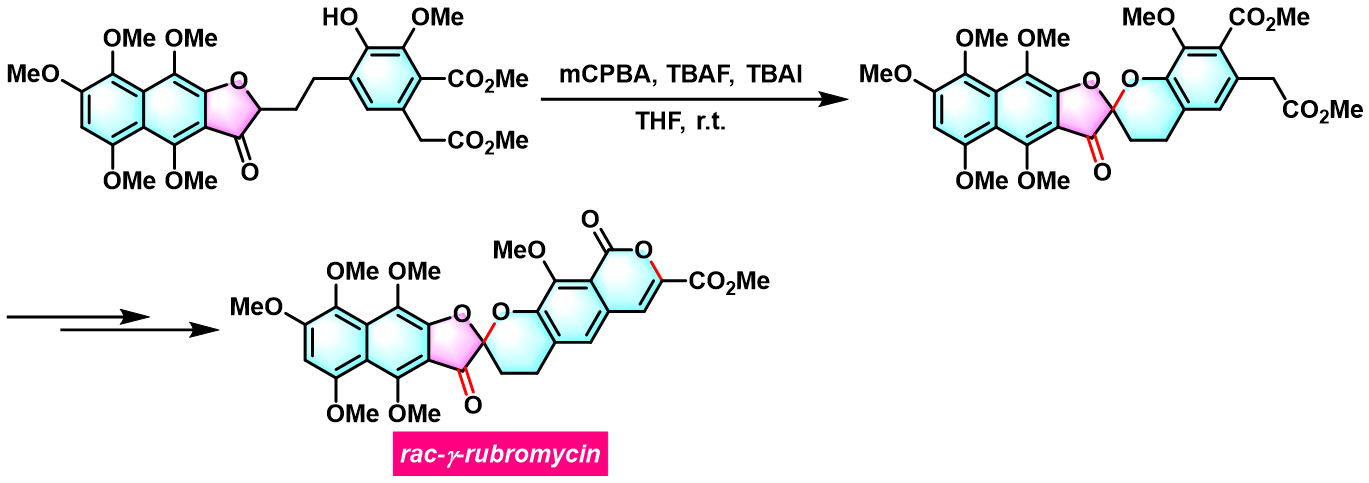
rac-γ-rubromycin的合成[2]
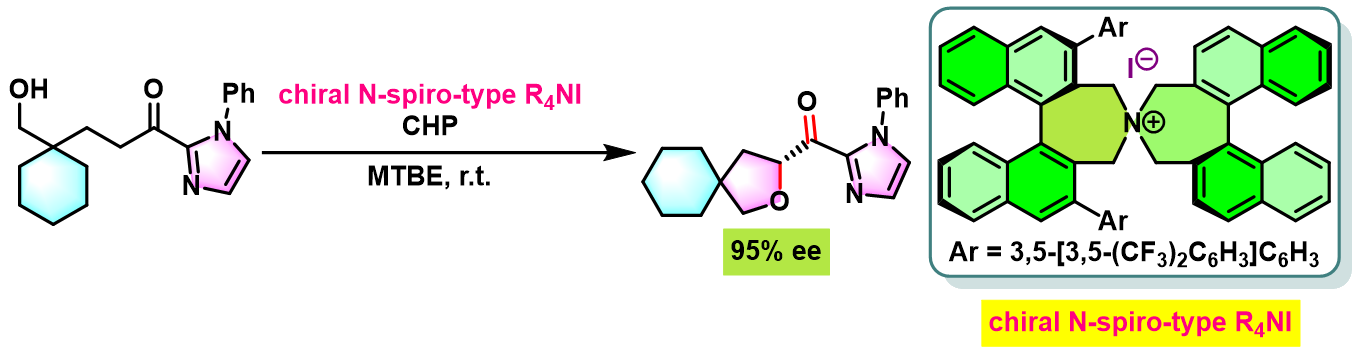
2-酰基四氢呋喃的对映选择性合成[3]
实验步骤
Ishihara 环醚化
室温下,向酮酚 (1 eq.)与TBAI (0.10 eq.)的THF或乙腈溶液(维持底物浓度为0.2 M) 中加入质量分数为30 %的过氧化氢 (2 eq.)水溶液。将上述反应混合物在室温下进行搅拌,通过TLC监控,直至反应结束。反应结束后,将上述混合物加水稀释,随后,加入乙酸乙酯进行萃取。将合并的有机相依次通过饱和亚硫酸钠溶液、饱和食盐水及水进行洗涤。再加入无水硫酸钠进行干燥后,减压除去溶剂。将残余物通过短硅胶柱 (正己烷/乙酸乙酯 5:1 v/v 作为洗脱剂)进行纯化,获得最终目标产物。
过氧化氢参与的Ishihara环醚化
室温下,向酮酚 (1 eq.)与手性N-螺环季铵盐 (0.10 eq.)的乙醚-水溶液(体积比为5:1,维持底物浓度为0.02 M)中加入质量分数为30 %的过氧化氢 (2 eq.)水溶液。将上述反应混合物在室温下进行搅拌,通过TLC监控,直至反应结束。反应结束后,将上述混合物加水稀释,随后,加入乙酸乙酯进行萃取。将合并的有机相依次通过饱和亚硫酸钠溶液、饱和食盐水及水进行洗涤。再加入无水硫酸钠进行干燥后,减压除去溶剂。将残余物通过短硅胶柱 (正己烷/乙酸乙酯 5:1 v/v 作为洗脱剂)进行纯化,获得相应手性产物。最后,通过HPLC测定其ee%。
TBHP参与的Ishihara环醚化
室温下,向酮酚 (1 eq.)与手性N-螺环季铵盐 (0.01 eq.)的乙醚溶液(维持底物浓度为0.1 M)中加入无水TBHP (5.5 M 癸烷溶液, 2 eq.)。将上述反应混合物在室温下进行搅拌,通过TLC监控,直至反应结束。反应结束后,将上述混合物加水稀释,随后,加入乙酸乙酯进行萃取。将合并的有机相依次通过饱和亚硫酸钠溶液、饱和食盐水及水进行洗涤。再加入无水硫酸钠进行干燥后,减压除去溶剂。将残余物通过短硅胶柱 (正己烷/乙酸乙酯 5:1 v/v 作为洗脱剂)进行纯化,获得相应手性产物。最后,通过HPLC测定其ee%。
参考文献
- [1] M. Uyanik, H. Hayashi, K. Ishihara, Science 2014, 345, 291. doi: 10.1126/science.1254976.
- [2] L. Wei, J. Xue, H. Liu, W. Wang, Y. Li, Org. Lett. 2012, 14, 5302. doi: 10.1021/ol3024874.
- [3] M. Uyanik, H. Hayashi, H. Iwata, K. Ishihara, Chem. Lett. 2016, 45, 353. doi: 10.1246/cl.160004
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.