作者:杉杉
导读:
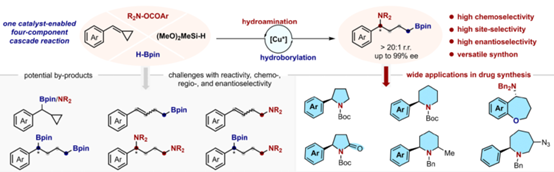
近日,南开大学的苏波课题组在J. Am. Chem. Soc.中发表论文,报道一种全新的铜催化arylidenecyclopropanes(ACPs)的串联氢硼化与氢胺化反应,首次实现了对映选择性1,4-borylamination反应,合成了一系列手性4-氨基烷基硼酸酯,具有高度的化学、位点与对映选择性等特点。同时,通过对机理的初步研究,进一步阐明反应的途径、可能的中间体以及高度化学与位点选择性的起源。
Enantioselective 1,4-Borylamination via Copper-Catalyzed Cascade Hydroborylation and Hydroamination of Arylidenecyclopropanes
Y. Zhu, Y. Guo, Y. Zhu, B. Su, J. Am. Chem. Soc. 2024, ASAP. doi: 10.1021/jacs.4c12852.
正文:
烷基硼是有机合成中一种重要的中间体,可促进各种重要化学键的转化,如C–C、C–O与C–N键(Scheme 1A, left)。同时,手性胺骨架广泛存在于各类药物与天然产物等(Scheme 1A, right)。其中,对映选择性borylamination反应能够同时引入硼基与氨基,是一种极具价值的方法。前期,诸多研究团队已经成功设计出多种对映选择性1,2-/1,1-borylaminations反应[1],但对于1,3-/1,4-borylaminations反应却尚未有相关的研究报道(Scheme 1B)。受到近年来对于硼化官能团化[2]相关研究报道的启发,作者试图开发一种对映选择性远端borylamination反应。最初,作者探索了一种铜催化苯基取代1,3-联烯(C4-合成子)的对映选择性1,4-borylamination反应 (Scheme 1C, left)。然而,这种方法未能生成所需的1,4-borylamination产物,主要是由于在实现足够的反应性与控制多重选择性方面存在挑战。然后,作者将注意力转向arylidenecyclopropanes (ACPs),这是一类不同的C4-合成子,其在过渡金属催化下很容易通过各种C–C键断裂途径进行开环反应[3]。最近,诸多研究团队的研究主要集中于烯丙基单官能团化反应,以及1,3-或1,4-位的双氨基化或双硼化反应[4] (Scheme 1C, right)。然而,由于难以实现所需的活性与化学、位点与对映体选择性的控制,在远端位置同时引入两个不同的官能团极具挑战。基于前期该课题组对于炔烃参与对映选择性串联1,1-borylallylation反应的研究成果[2]以及开环与官能团化策略的启发[4],这里,南开大学的苏波课题组报道了一种全新的铜催化ACPs的四组分串联氢硼化与氢胺化反应,首次实现了对映选择性1,4-borylamination反应,合成了一系列手性1,4-borylamination产物(Scheme 1D)。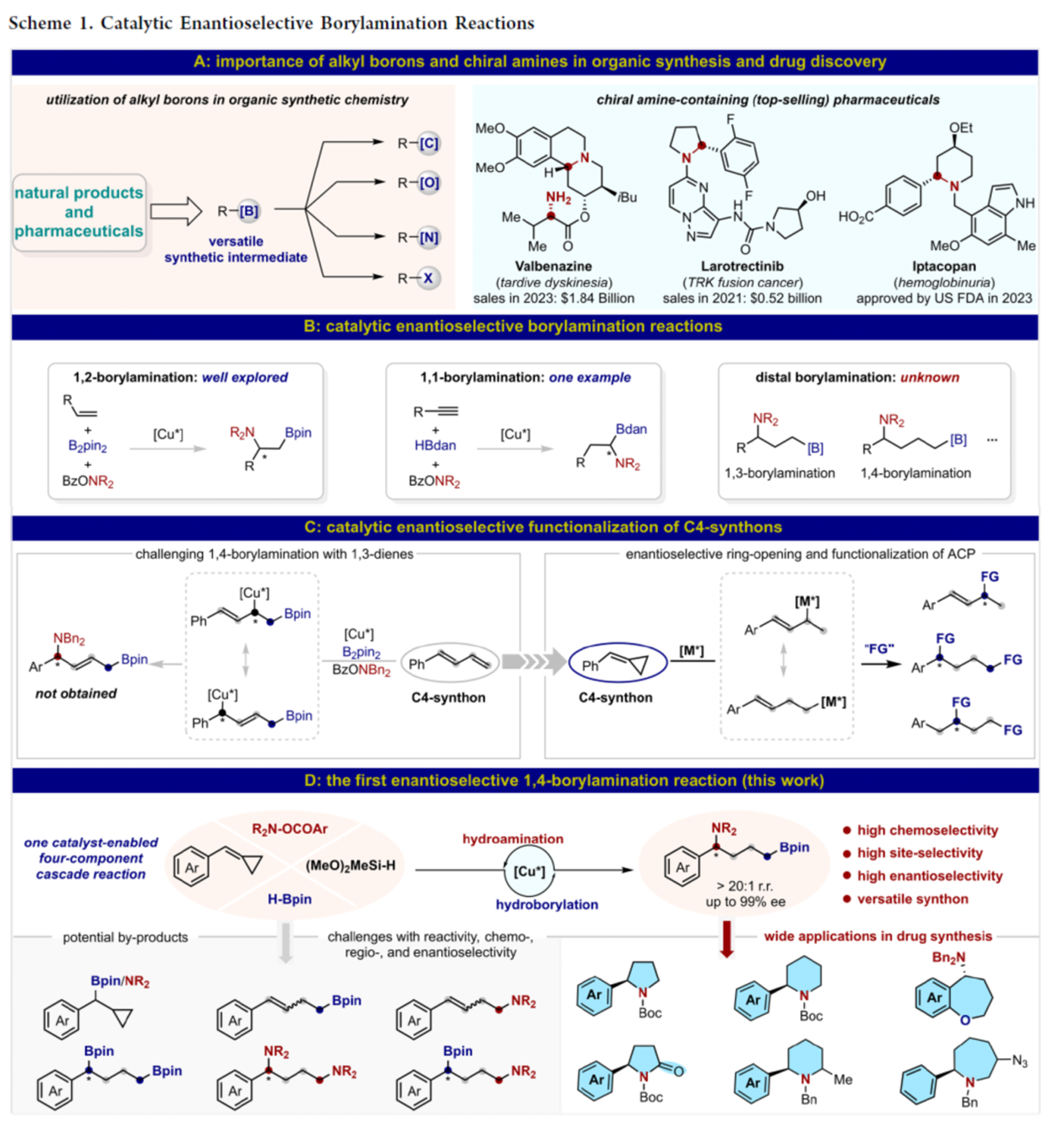
首先,作者采用4-甲基取代的ACP (1a)作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用BzONBn2(O-benzoyl-N,N-dibenzylhydroxylamine,2a)作为亲电胺试剂,HBpin作为硼源,Cu(OAc)2作为催化剂,L1作为手性配体,(MeO)2MeSiH作为氢化物源,tBuOK作为碱,在THF反应溶剂中,反应温度为室温,最终获得93%收率的产物3a(99% ee)。其中,不同的硅烷作为氢化物源,对于反应有着显著的影响。碱的加入,也显著提高了反应的收率。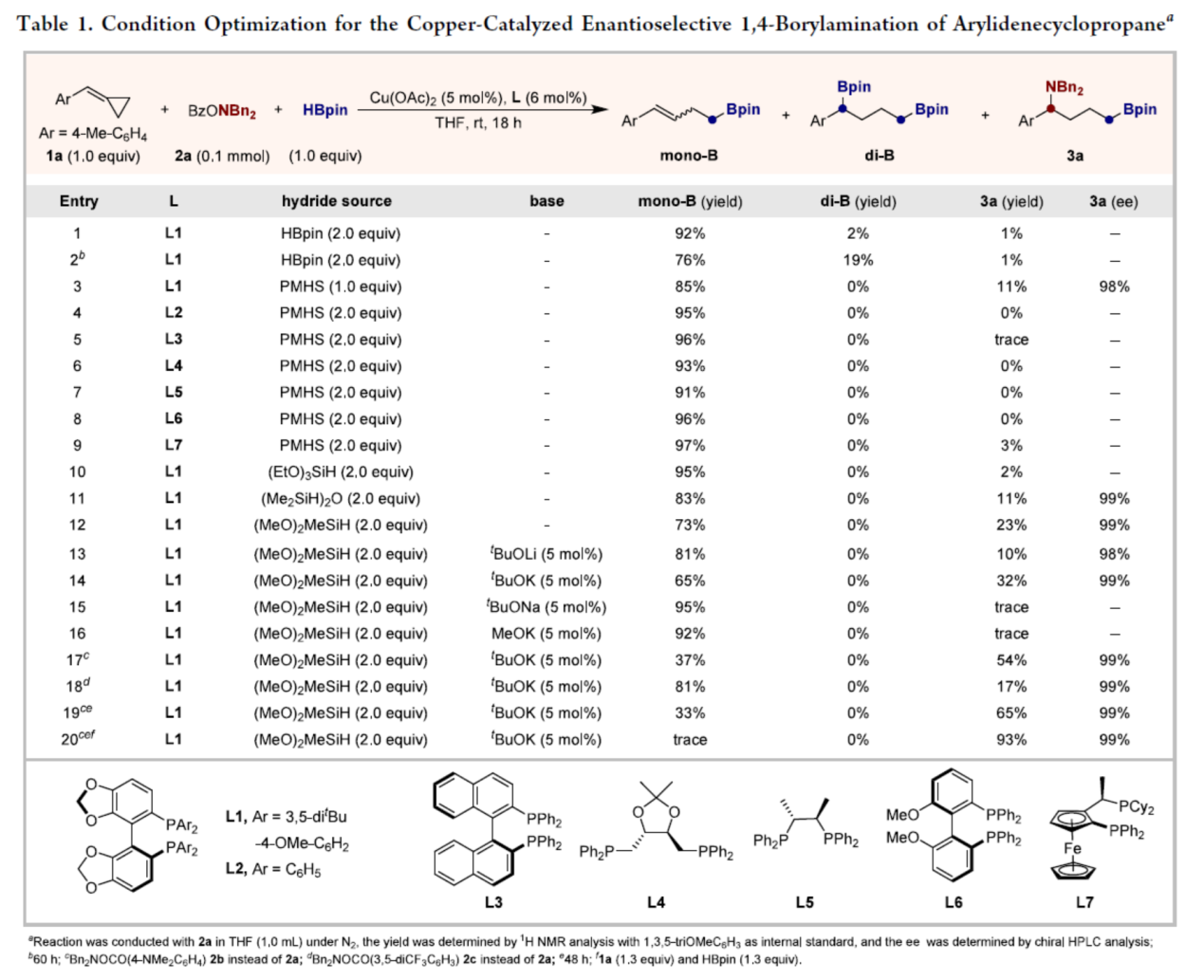
在上述的最佳反应条件下,作者对一系列底物的应用范围进行深入研究(Table 2)。首先,不同电性取代的ACPs,可以优异的化学与位点选择性进行反应,并以高收率与对映选择性(91-99%ee)获得相应的1,4-borylamination产物。其中,部分1,4-borylamination产物3在柱纯化过程中不稳定,导致分离的产率偶尔低于其NMR产率;在这种情况下,在硼基原位氧化后分离并表征化合物。值得注意的是,该策略具有广泛的官能团耐受性。同时,芳环上取代基的电子性质对对映选择性没有显著影响。含有喹啉、吡啶与噻吩等杂芳基的methylenecyclopropanes也与反应相容,尽管含吡啶的底物产生了具有中等对映选择性(61%ee)的产物。值得注意的是,烷基取代的methylenecyclopropane容易发生开环硼化形成内烯烃,但由于内烯烃的低反应性,不会进行氢胺化。其次,除了N,N-二苄基羟胺酯2b外,具有取代苄基的羟胺酯(如Br、Cl、Me、iPr)也是有效的底物,可以高收率与高对映体选择性(96−99%ee)获得相应的1,4-borylamination产物(3y−3zc)。此外,环状(吗啉)与二乙基取代的胺化试剂,也能够顺利进行反应,可以优异的对映选择性获得产物4zd与4ze。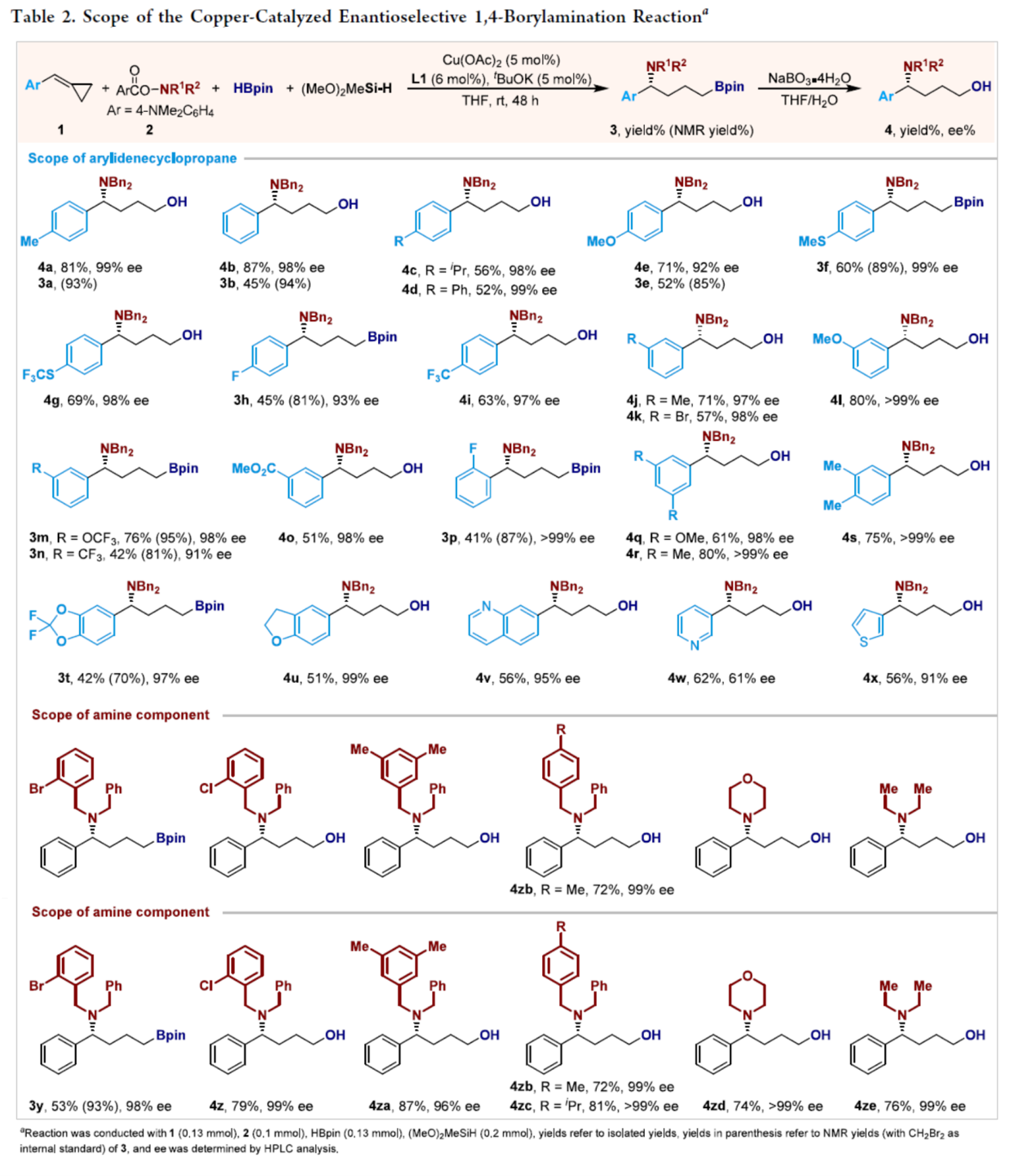
之后,作者对反应的实用性进行了研究 (Figure 1)。首先,3b经氧化、钯催化氢化以及Boc2O保护后,得到手性4-氨基醇衍生物5。化合物5在碱性条件下进行分子内SN2取代,得到2-苯基吡咯烷衍生物6。这种骨架存在于美国FDA批准的几种畅销药物中,如Larotrectinib与Ombitasvir。化合物5通过氧化可形成手性4-苯基吡咯烷酮化合物7。其次,3b经同系化与氧化后,生成5-氨基醇8,其是6-芳基哌啶药物(如lptacopan、Avacopan与Valbenazine)的前体。化合物3p经氧化与分子内SNAr取代,生成tetrahydrobenzoxepine化合物9。此外,3b经Zweifel-乙烯基化,生成6-氨基烯烃10,这是2,6-二取代哌啶与2-苯基七元N-杂环的前体。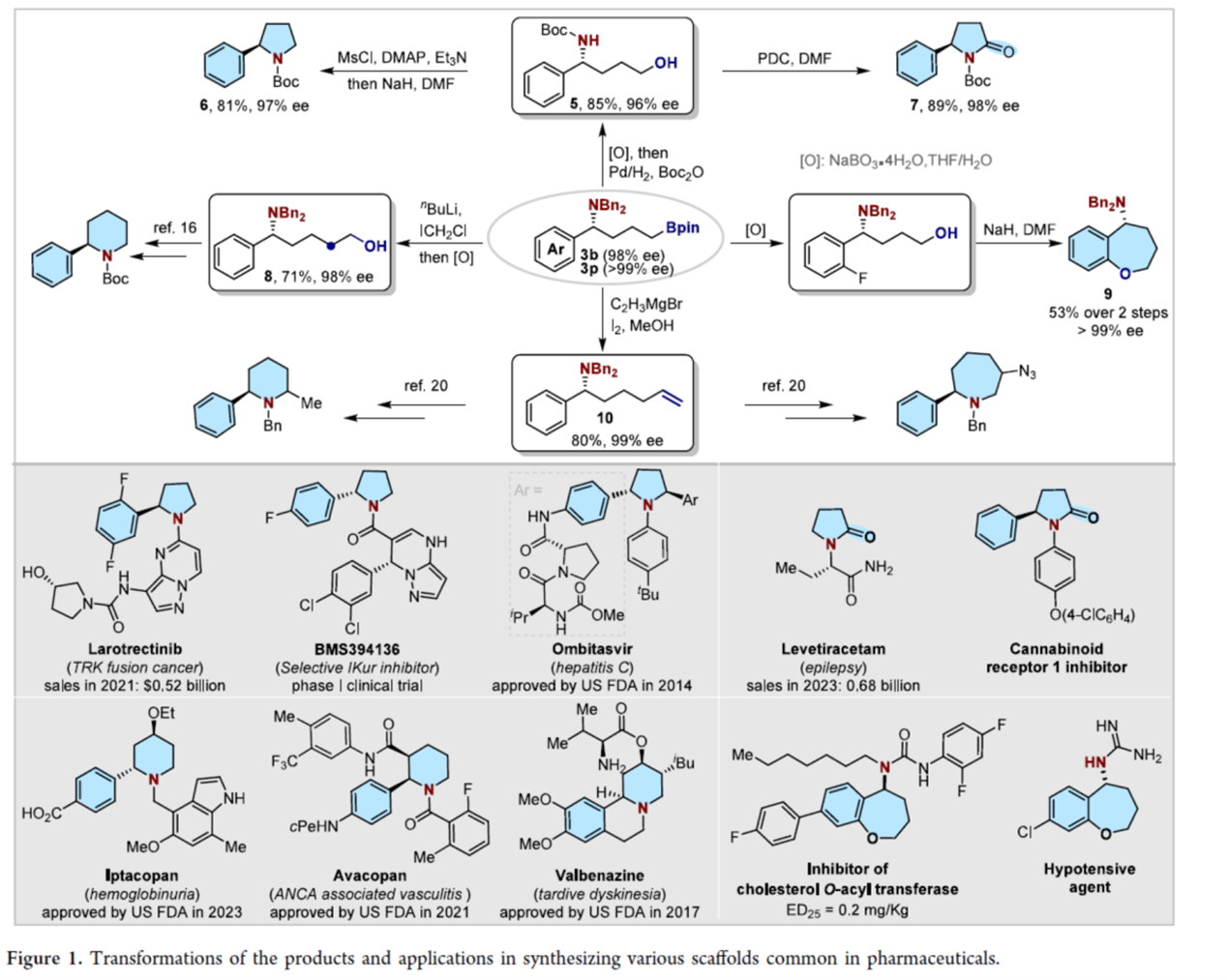
接下来,作者对上述反应的机理进行进一步研究 (Scheme 2)。首先,对反应的监测表明,最初ACP 1b经快速开环氢硼化(Scheme 2a),在1小时内实现了完全转化,并生成开环中间体mono-B,为E/Z异构体的混合物(E/Z为1.4:1)。然后,mono-B的两种异构体缓慢进行氢胺化,得到1,4-borylaminated产物3b。逐步反应为这一途径提供了进一步的支持(Scheme 2b)。因此,反应过程是通过初始开环氢硼化,然后是区域与对映选择性氢胺化,其中mono-B是关键中间体。
为了研究高度的化学与位点选择性的起源,作者比较了串联中各个步骤的初始速率(Scheme 2c and 2d)。开环一级alkyl–Cu配合物优先与硼试剂(HBpin)而不是亲电胺试剂2b反应,从而解释了在初始开环氢官能团化步骤中观察到的化学选择性。此外,mono-B的后续氢胺化过程比竞争性氢硼化过程快约88倍(eqs 5 and 6)。这表明,在mono-B的氢铜化过程中产生的二级alkyl–Cu物种对胺化的反应性明显高于硼化,进一步阐明了开环中间体mono-B氢官能团化的化学选择性。一级alkyl–Cu对硼化与二级alkyl–Cu对胺化的明显高反应性共同解释了串联中观察到的高位点选择性,最终形成1,4-borylaminated产物。
为了阐明硅烷在反应中的重要作用,作者比较了在有无硅烷的情况下,mono-B的初始氢胺化速率(eqs 6 and 7)。引人注目的是,mono-B在硅烷存在下的氢胺化反应比其不存在时快约300倍。虽然硅烷加速氢胺化步骤的确切机制尚不清楚,但它可能涉及亲电胺的活化与/或促进Cu–H再生,从而显著提高整体反应性。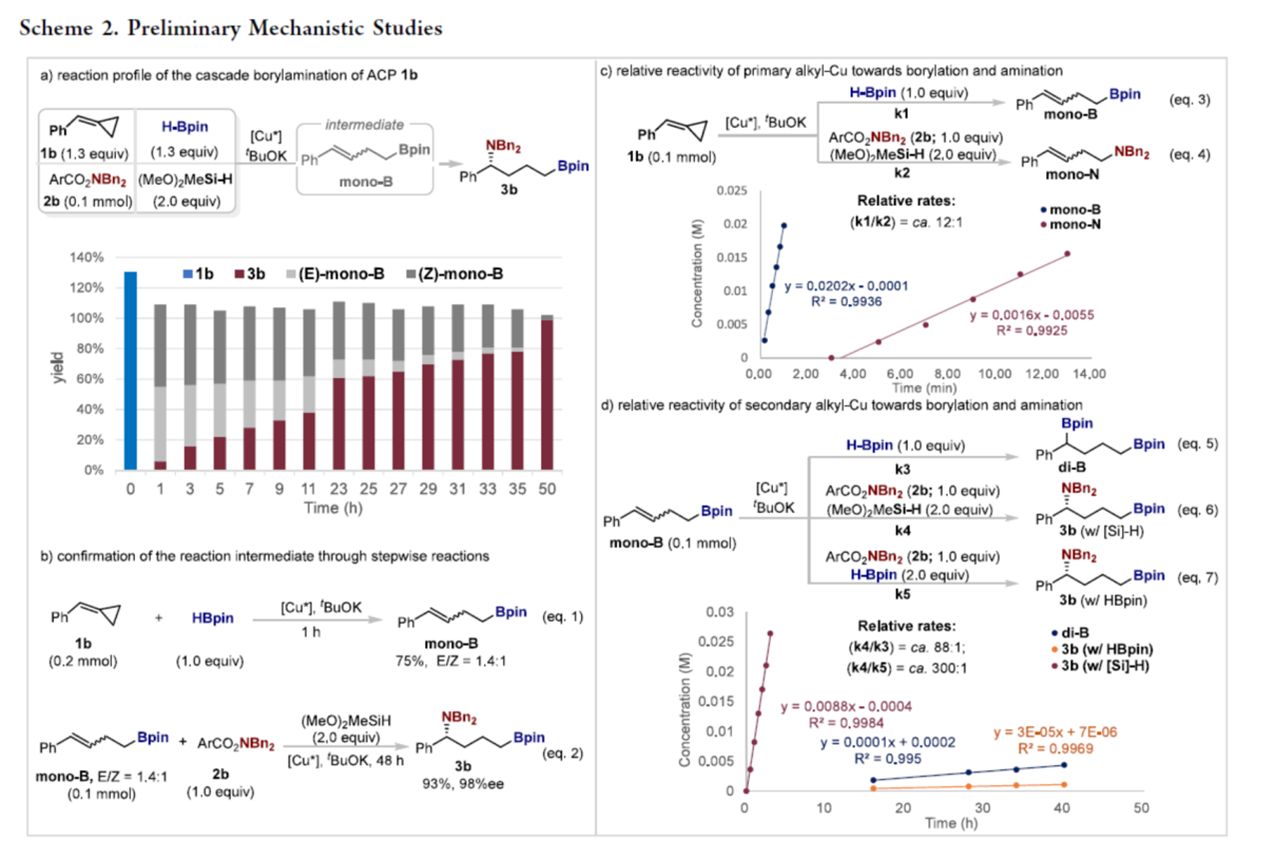
基于上述的实验研究以及前期相关的文献报道[4],作者提出如下合理的反应机理 (Scheme 3)。首先,铜盐、手性配体与氢化物试剂反应,生成氢化铜([Cu*]–H)配合物。[Cu*]–H配合物通过APC 1的区域选择性氢铜化启动开环氢硼化循环,形成alkyl–Cu中间体I,然后进行β-碳消除,生成一级alkyl–Cu配合物II。其次,配合物II通过σ-键复分解选择性地与HBpin反应,生成硼化中间体mono-B,同时再生[Cu*]–H配合物。在随后的氢胺化循环中,mono-B经历区域与对映选择性氢铜化反应,生成手性二级alkyl–Cu配合物III。该物种优先与羟胺酯2反应,获得目标1,4-borylamination产物3与铜中间体[Cu*]OCOAr。该铜中间体随后与硅烷试剂反应以再生[Cu*]–H催化剂。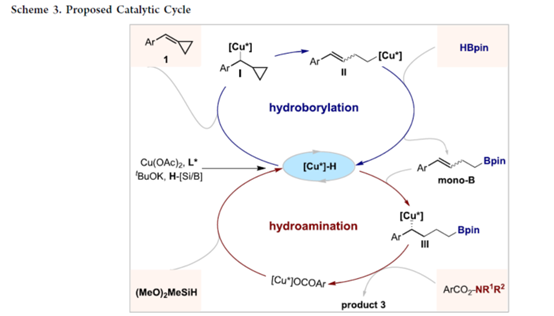
总结:
南开大学的苏波课题组报道了一种全新的铜催化四组分串联氢硼化与氢胺化反应,合成了一系列手性1,4-borylamination产物,具有高度的化学、位点与对映选择性等特点。机理研究表明,一级alkyl–Cu对硼化反应明显,二级alkyl–Cu对胺化反应明显不同,这解释了该过程中观察到的高水平化学与位点选择性。
参考文献:
- [1] N. Matsuda, K. Hirano, T. Satoh, M. Miura, J. Am. Chem. Soc. 2013, 135, 4934. doi:10.1021/ja4007645.
- [2] S. Liu, K. Ding, B. Su, ACS Catal. 2024, 14, 12102. doi:10.1021/acscatal.4c03735.
- [3] G. Fumagalli, S. Stanton, J. F. Bower, Chem. Rev. 2017, 117, 9404. doi:10.1021/acs.chemrev.6b00599.
- [4] J. Zhou, Q. Yang, C. S. Lee, J. J. Wang, 2022, 61, e202202160. doi:10.1002/anie.202202160.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.
关注Chem-Station抖音号:79473891841




















No comments yet.