本文作者:杉杉
导读
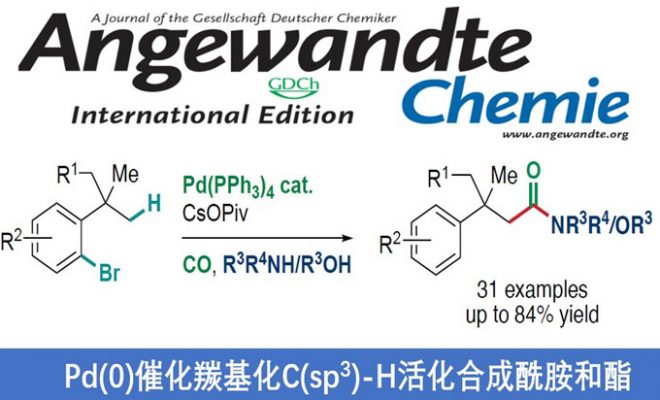
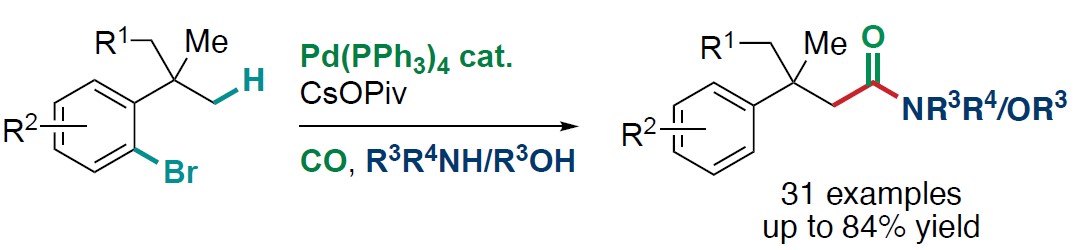
1,4-Pd迁移策略可直接实现远程C-H键的功能化。近日,巴塞尔大学Olivier Baudoin教授课题组在Angew. Chem. Int. Ed.上发表论文,通过C(sp3)-H活化,1,4-Pd迁移和氨基或烷氧基羰基化的多米诺反应,合成多种具有β-季碳中心的酰胺和酯衍生物。机理研究表明,使用PPh3作为配体时,σ-烷基钯中间体的氨基羰基化反应快,生成酰胺化合物,而不是茚满酮产物(先前报道)。
Synthesis of Amides and Esters by Pd0-Catalyzed CarbonylativeC(sp3)-H Activation
TomášČarný, Ronan Rocaboy, Antonin Clemenceau, and Olivier Baudoin*
Angew. Chem. Int. Ed. 2020, 59, 18980-18984. DOI:10.1002/anie.202007922
正文
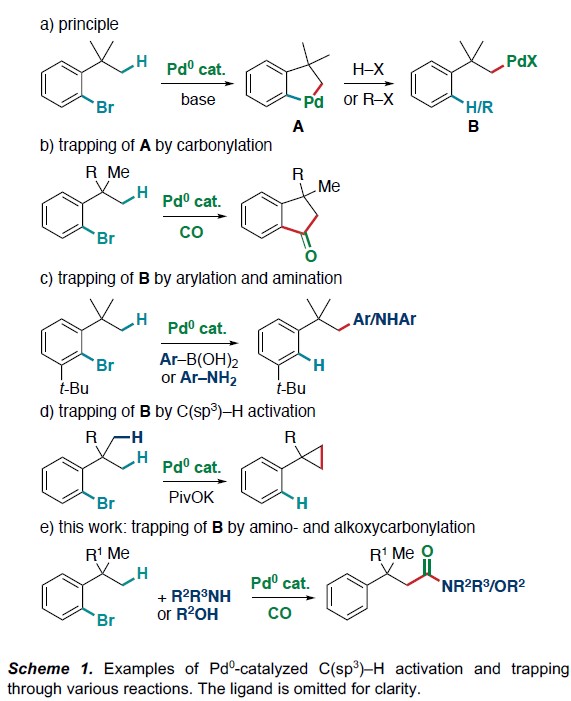
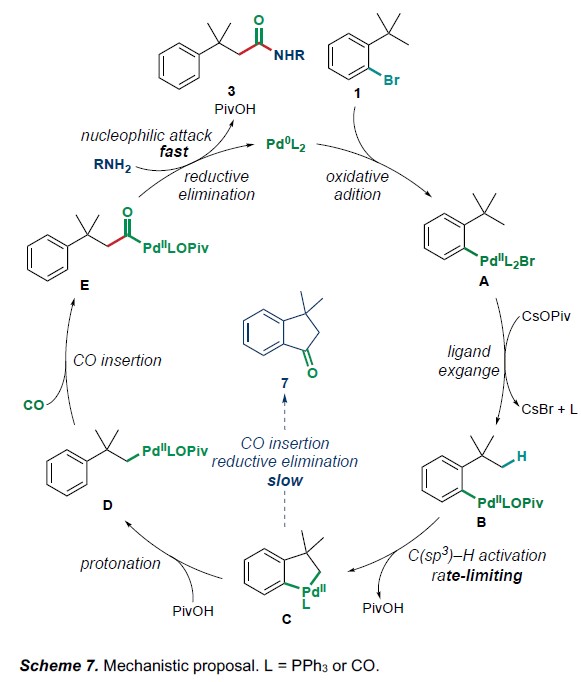
在过去的二十年中,Pd0催化C(sp3)-H键活化作为构建C(sp2)-C(sp3)键的有效方法,该方法主要通过C(sp2)-X键氧化加成到Pd(0)上和碱促进C(sp3)-H活化,形成有机钯环A,再经还原消除从而获得目标产物(Scheme 1a)。同时,有机钯环中间体也可形成扩环产物。当通过卡宾插入可实现芳基溴化物与重氮化合物反应,获得四取代茚满酮化合物。使用二溴甲烷与A反应时,也会生成茚满酮化合物。据报道,芳基溴的羰基化C(sp3)-H芳基化反应,若将CO插入,同样产生茚满酮化合物(Scheme 1b)。此外,通过质子化或氧化加成/还原消除对钯环A进行开环,可得到σ-烷基钯配合物B(Scheme 1a),涉及1,4-Pd迁移过程。若经β-H消除则生成烯烃,若被硼酸和苯胺捕获则形成芳基化和胺化产物(Scheme 1c)。同时,分子内去芳化碳钯化形成螺环化产物。烷基钯中间体B可进行二次分子内C(sp3)-H活化,从而生成稠合杂环和环丙烷化合物(Scheme 1d)。在本文中,作者使用CO捕获σ-烷基钯配合物,并实现芳基溴化物与胺或醇的羰基化的多米诺反应,生成具有β-季碳中心的酰胺和酯衍生物(Scheme 1e)。值得注意的是,反应条件的调节有利于1,4-Pd迁移,不利于在钯环 A上插入导致茚满酮化合物的形成(Scheme 1b)。
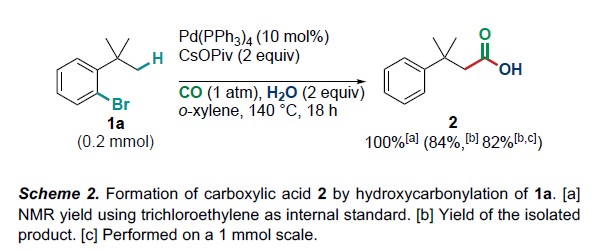
作者以叔丁基溴苯1a作为底物,使用类似于环丙烷化反应的条件(Scheme 1d,Pd(PPh3)4作为催化剂,新戊酸铯作为碱)进行反应(Scheme 2)。当在1个大气压的CO下,使用2当量的水,于140℃下反应,由σ-烷基钯配合物B通过CO插入和水解相应的酰基钯中间体从而生成高收率羧酸2。值得注意的是,尽管存在水,仍未形成原卤代产物。
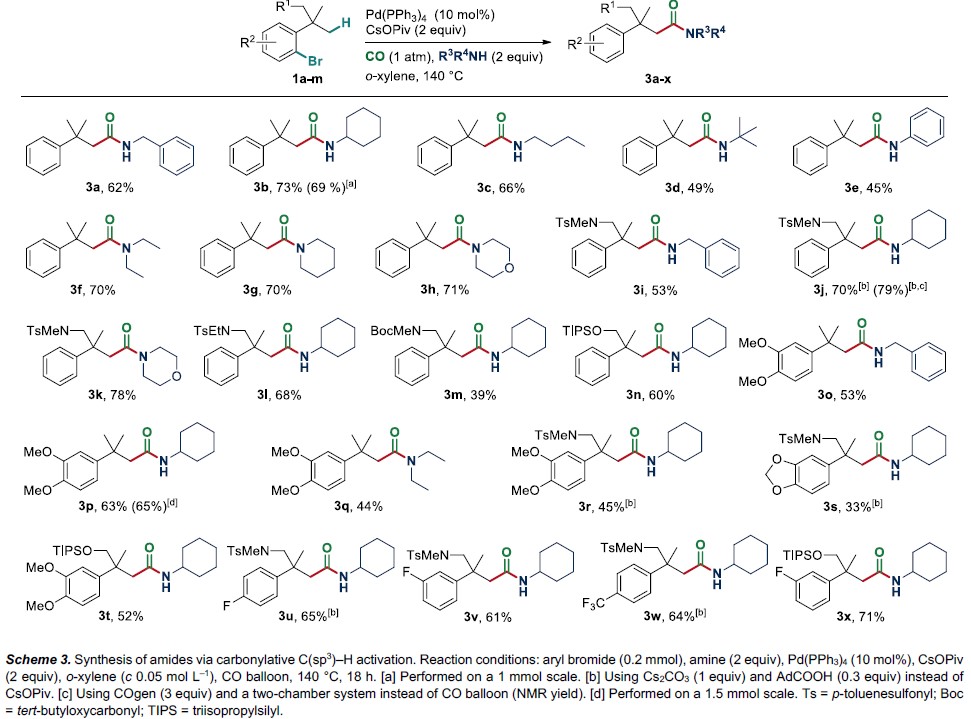
随后,在相同的条件下,使用苄胺(2当量)代替水,以62%的收率获得相应的氨基羰基化产物3a(Scheme 3)。同时,为了验证该前方法的通用性,作者使用(无)环伯胺(苄胺、环己胺、正丁胺、叔丁胺),仲胺(吗啉、哌啶、二乙胺)和苯胺作为亲核试剂,均以45-71%的收率(亲核性高其收率也高)获得具有β-季碳中心酰胺产物3a–3h。同时,当芳基溴化物含有各种官能团如磺酰胺(3i–31)、Boc-氨基甲酸酯(3m)或TIPS保护的醇(3n)取代时,反应不受影响。有趣的是,使用3当量的COgen(9-甲基芴-9-羰基氯)进行反应,同样获得酰胺产物3j。此外,尽管收率降低,但在溴原子的间位或对位的供电子(甲氧基,亚甲二氧基,3o–3t)和吸电子(氟,三氟甲基,3u–3x)取代时,均具有良好的耐受性。对于3j,3r,3s,3u,3w,使用由Cs2CO3和催化AdCO2H原位形成的AdCO2Cs作为碱时,收率比CsOPiv更高。
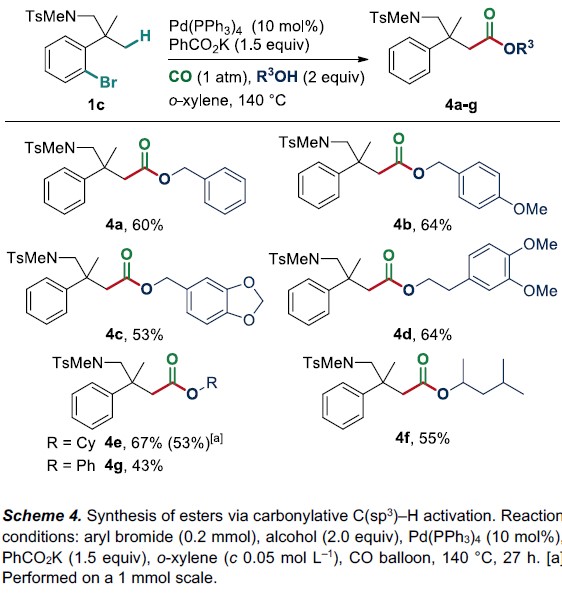
此外,在进行酯的合成中,作者发现,使用苯甲酸钾作为碱,并将反应时间延长至27h,收率可进一步提高,可能是由于醇与胺相比降低了亲核性(Scheme 4)。当醇的底物含有苄基、伯/仲醇、苯酚时,均以43-64%的收率获得相应的酯4a-4g。此外,与环己醇的反应可按比例放大至1 mmol,以53%的收率获得酯4e。
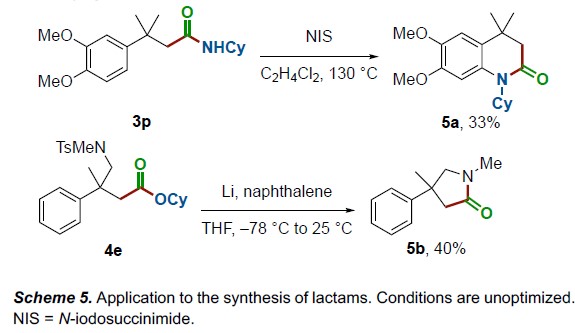
随后,作者对产物进行了相关的后期修饰(Scheme 5)。当酰胺3p在1,2-二氯乙烷中用NIS处理后,通过分子内C-H酰胺化反应形成δ-内酰胺5a。当使用Li /萘将甲磺酰基裂解后,酯4e可环化成γ-内酰胺5b。
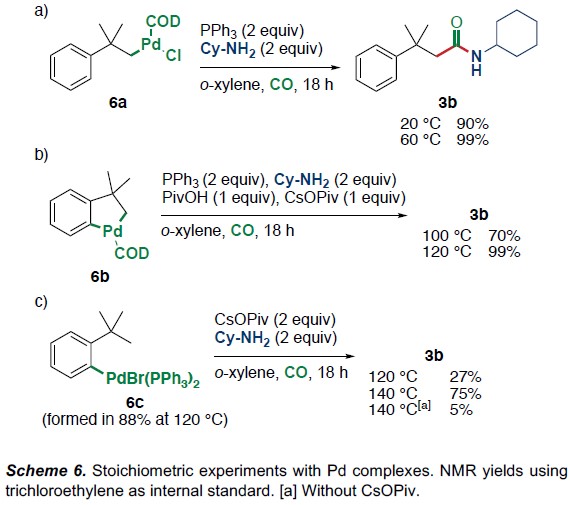
为了进一步了解反应机理,作者进行了相关的对照实验(Scheme 6)。首先,σ-烷基钯络合物6a作为底物,在PPh3、环己胺和CO存在下反应,在室温下获得90%收率的3b,而在60℃获得几乎定量收率的3b,从而表明氨基羰基化步骤的势垒低(Scheme 6a)。紧接着,使用五元钯环 6b作为底物,在PPh3、CyNH2、CO、新戊酸和新戊酸铯的存在下反应,同样可在120℃下获得几乎定量收率的3b,说明酰胺3b的形成是由于钯环质子化和所得到的σ-烷基钯络合物的氨基羰基化所致(Scheme 6b)。最后,将由2-叔丁基溴苯1a和Pd(PPh3)4在甲苯中于120℃以88%的收率制备的氧化加成配合物6c与CsOPiv和CyNH2反应,酰胺3b的形成需要比其他配合物更高的温度,在120℃时只有27%,在140℃时只有75%,从而说明氧化加成后C(sp3)-H活化为限速步骤(Scheme 6c)。
基于上述的总结,作者提出了一种可能的反应机理(Scheme 7)。首先,芳基溴1经氧化加成生成配合物A,再与新戊酸酯进行配体交换形成配合物B。随后,配合物B通过协同的金属化-去质子化机理经限速C(sp3)-H活化,从而形成五元钯环中间体C。紧接着,经PivOH质子化形成σ-烷基钯配合物D。最后,经CO插入、胺的亲核进攻,从而形成目标酰胺产物3。此外,中间体E经还原消除,再生Pd(0),从而完成催化循环。有趣的是,Wang课题组使用IMesMe(一种N-杂环卡宾)作为配体,在相似的底物上和相似的条件,通过CO的插入和还原消除从钯环 C产生化合物7。而在使用PPh3作为配体,且不存在胺时,可形成羧酸2,未形成茚满酮化合物7。而在胺存在时,也未观察到茚满酮化合物。
总结
巴塞尔大学Olivier Baudoin教授课题组开发了第一个通过C(sp3)-H活化,1,4-Pd迁移和氨基或烷氧基羰基化的多米诺反应,合成多种具有β-季碳中心的酰胺和酯衍生物。机理研究表明,使用PPh3作为配体时,σ-烷基钯中间体的氨基羰基化反应很快,避免了茚满酮化合物的生成,从而获得目标酰胺和酯产物。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.