投稿作者 漂泊
地球上99%的溴元素以Br–的形式存在于海水中,所以人们也把溴称为“海洋元素”。从海水中提取的溴可以制成各种化合物,用作阻燃剂、杀虫剂、染料。尽管溴的很多化合物都具有毒性,但是一些溴化合物如溴化钾也可以用于医药领域,制造三溴合剂;红药水中也含有溴。溴元素在我们的生产生活中发挥着重要的作用。
溴的基本物理性质
| 分类 | 第Ⅶ主族▪非金属 |
| 原子序号・原子量 | 35(79.90) |
| 电子配置 | 4s24p5 |
| 密度 | 3119kg / m 3 |
| 熔点 | -7.2°C |
| 沸点 | 58.76°C |
| 色・形状 | 红色发烟液体 |
| 丰度 | 0.37ppm(地壳) |
| 发现者 | Antoine Balard,Carl Löwig |
| 主要的同位素 | 79Br,81Br |
| 用途例 | 阻燃物,杀虫剂 |
| 前后的元素 | 硒-溴-氪 |
溴的发现
溴元素是一种非常重要的卤素,它和自然界其他的卤素一样,基本没有单质状态存在,而且它的化合物常常和氯的化合物混杂在一起,存在于盐卤和海水之中。由于溴的浓度很低,因此提取有一定困难。考虑到世界上海水的量很大,溴的整体储量还是非常可观的:整个大洋水体的溴储量可达100万亿吨。电解制盐工业的浓缩盐卤水或海水制溴是现代工业提溴的主要途径。
溴元素分别被两个科学家安东尼·巴拉尔(Antoine Balard)和卡尔·罗威(Carl Löwig)在1825年与1826年所发现。1824年,法国一所药学专科学校的22岁青年学生巴拉尔正在研究他家乡蒙彼利埃(Montpellier)盐沼中生长的海苔燃烧灰烬中的物质,他用浸泡萃取的方法把灰烬制成了母液,并进行了许多实验。当母液中通入氯气时,液体变成红棕色。最初,巴拉尔认为这是一种氯的碘化物溶液,他希望找到这些废弃母液的组成元素。但他尝试了种种办法也没法将这种物质分解,所以他断定这是一种和氯以及碘相似的新元素。巴拉尔把它命名为muride,来自拉丁文muria(盐水)。1826年8月14日法国科学院组成委员会审查巴拉尔的报告,肯定了他的实验结果,把muride改称bromine,来自希腊文brōmos(恶臭),因为溴具有刺激性臭味。实际上所有卤素都具有类似臭味。溴的拉丁名bromium和元素符号Br由此而来。[1-2]
事实上,在巴拉尔发现溴的前几年,有人曾把一瓶取自德国克鲁兹拉赫(Keluzilahe)盐泉的红棕色液体样品交给化学家李比希鉴定,李比希并没有进行细致的研究,就断定它是“氯化碘”,几年后,李比希得知溴的发现之时,立刻意识到自己的错误,于是他把那瓶液体放进一个柜子,并在柜子上写上“耻辱柜”以警示自己,此事成了化学史上的一桩趣闻。
卡尔·贾古柏·罗威在1825年从巴特克罗伊茨纳赫村里的水泉中分离出了溴。罗威用了一个有饱和氯的矿物盐溶液,并用乙醚提取出了溴。在醚蒸发后,留下了一些棕色的液体。他用此液体作为他工作的样本申请了一个在里欧波得·甘末林(Leopold Gmelin)的实验室的职位。由于发现的公开被延迟了,所以巴拉尔率先发表了他的结果。 [3-4]
在法国科学家路易斯·尼可拉斯·瓦奎宁(Louis Nicolas Vauquelin)和路易斯·贾奎斯·瑟纳德(Louis Jacques Thénard)与约瑟夫·路易·盖-吕萨克证实了年轻药剂师巴拉尔的实验之后,结论出现在法国科学院的一场演讲上,并被发表在化学纪实上。在他发表的论文中,巴拉尔说他基于安格拉达的建议把新元素的名字从muride改成bromine。其他的说法则认为法国的化学与物理学家吕萨克基于它蒸气的独特气味建议了这个名称。溴直到1860年才被大量的制造。[5-6]
单质溴
尤斯图斯·冯· 李比希
李比希是德国化学家、有机化学之父。他作过大量的有机化合物的准确分析,改进了有机分析的若干方法,发现并分析了大批化合物:1829年发现并分析马尿酸;1831年发现并制得氯仿和氯醛……他还发现了同分异构现象,与F.维勒共同发现安息香基并提出基团理论,为有机结构理论的发展作出贡献;1839年李比希还提出了多元酸理论。
李比希在生物化学和农业化学也做出过重要的贡献。他用实验方法证明:植物生长需要碳酸、氨、氧化镁、磷、硝酸以及钾、钠和铁的化合物等无机物;人和动物的排泄物只有转变为碳酸、氨和硝酸等才能被植物吸收。这些观点是近代农业化学的基础。他大力提倡用无机肥料来提高收成。他还认为动物的食物不但需要一定的数量,还需要各种不同的种类,或有机物或无机物,而且须有相当的比例。他又证明糖类可生成脂肪。还提出发酵作用的原理。
李比希还是一位著名的化学教育家。他在任吉森大学的化学教授期间,着手实施了改革德国的传统化学教育体制与教学方式的计划,探索造就新一代化学家的方法。当时德国大学中的化学教育,通常是把化学知识混杂在自然哲学中讲授,而且没有专门的化学教学实验室,学生得不到实验操作的训练。李比希深知,作为一个真正的化学家仅有哲学思辨是不够的,化学知识只有从实验中获得。而这种实验训练在那时的德国大学中还得不到。于是李比希下决心借鉴国外化学实验室的经验,在吉森建立一个现代化的实验室,让一批又一批的青年人在那里得到训练,从中培养出一代化学家。吉森实验室是一座供化学教学使用的实验室,它向全体学生开放,并在化学实验过程的同时进行讲授。李比希为实验室教学编制了一个全新的教学大纲,它规定:开始,学生在学习讲义的同时还要做实验,先使用已知化合物进行定性分析和定量分析,然后从天然物质中提纯和鉴定新化合物以及进行无机合成和有机合成;学完这一课程后,在导师指导下进行独立的研究作为毕业论文项目;最后通过鉴定获得博士学位。李比希这种让学生在实验室中从系统训练逐步转入独立研究的教学体制,在他之
前并未被人们认识到,而它为近代化学教育体制奠定了基础。[7]
Justus von Liebig
溴系阻燃剂
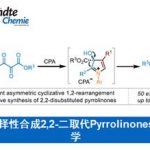
阻燃剂是一类可以延缓起火时间,并抑制火势蔓延的添加物。阻燃剂的种类不同,作用的原理也不同。以氢氧化铝为代表的无机阻燃剂是利用受热产生水吸热,并隔绝氧气的作用来实现阻燃,而溴系阻燃剂则是利用含溴材料本身在燃烧的过程中会释放出溴化氢气体,溴化氢会分解产生自由基,捕获燃烧反应中高度活性的氢氧自由基,阻断链式反应来实现阻燃。由于我们现实生活中使用的很多材料都是易燃的材料,因此通常需要添加阻燃剂来提高其抵抗火焰的能力。目前,阻燃剂主要应用在交通运输、电子电气设备、家具以及建筑材料领域。添加阻燃剂可以延缓燃烧的时间,为人们赢得处理和逃离的时间。
溴系阻燃剂是一种非常重要的阻燃剂,这是一类含溴化合物的总称:包括十溴二苯醚、四溴双酚A等。通常这些溴化合物会以添加剂的形式添加到树脂或其他高分子的聚合反应当中,得到的聚合物就会包含阻燃物质。高温时这些材料会释放溴化氢,阻断燃烧反应。这种阻燃方式可以以很少的阻燃剂添加量产生高效的阻燃效果。同时,密度较大的HBr气体还可以起到隔绝空气的作用。目前,溴系阻燃剂在电子设备、软垫家具、建筑保温材料中都有广泛的应用。溴系阻燃剂也确实提供了其他阻燃剂很难完全替代的良好性能,尽管一些含溴的阻燃剂确实可能带来环境和健康风险,不过在合理使用的情况下,目前批准使用的品种风险依然在可接受范围内。[8-10]
溴系阻燃剂及其阻燃原理
溴的其他工业用途
溴的化合物通常都具有一定的毒性,因此它们可以用作杀虫剂,有毒的溴甲烷被广泛用作农药来用烟熏消毒土壤和熏蒸住房。溴化乙烯也有同样的用途。这些挥发性有机溴化合物对于线虫、真菌等十分有效。但蒙特利尔公约决定到2005年逐渐淘汰这类会破坏臭氧层的化合物。所以溴系杀虫剂不再使用。[11]
溴酚蓝是一种重要的指示剂和染料,在pH 3.0~4.6范围,它的颜色会由黄变蓝。溴酚蓝也常用做电泳指示染料。溴化乙锭(EtBr)也被用在凝胶电泳中,当作DNA的染色剂。[12]
溴化银易感光,常单独或与氯化银和碘化银一起作为照相乳剂的光敏感成分。此外,溴蒸气被用于敏化银版摄影法用的银版的第二步,该版之后会经过汞蒸气的处理。溴的角色是加强刚被碘化的银版的光敏。[13]
含溴化银的胶卷 溴酚蓝
溴的医药用途
生物学家们发现,溴离子通常不会有很大的毒性,但高浓度的溴离子会损坏神经元的膜,削弱传输,导致溴中毒。在人体中注射或吸收少量溴的化合物后,神经便会逐渐被麻痹。这样,溴的化合物——溴化钾、溴化钠和溴化铵,在医学上便被用作镇静剂。通常,都是把这三种化合物混合在一起使用,配成的水溶液就是我们常听到的“三溴合剂”,压成片的便是常见的“三溴片”,是现在最重要的镇静剂之一。
红药水,又称红汞,是含荧光素母体的有机汞二钠盐,分子式为C20H8Br2HgNa2O6,可用作杀菌剂,其2%溶液称为“红药水”。由于含汞且作用较差,现已很少使用。红药水是一种作用较弱的消毒防腐药。其杀菌、抑菌作用较弱但无刺激性,适用于新鲜的小面积皮肤或粘膜创伤(如擦伤、碰伤等)之消毒。它作用的原理是汞离子解离后与蛋白质结合,从而起到杀菌作用,对细菌芽孢无效。
三溴片 红药水
参考文献
[1]Balard, Antoine (1826). “Memoir on a peculiar Substance contained in Sea Water”. Annals of Philosophy. 28: 381–387 and 411–426. [2]Vauquelin, L. N.; Thenard, L.J.; Gay-Lussac, J.L. (1826). “Rapport sur la Mémoire de M. Balard relatif à une nouvelle Substance”[Report on a memoir by Mr. Balard regarding a new substance]. Annales de Chimie et de Physique. 2nd series (in French). 32: 382–384 [3]Löwig, Carl Jacob (1829). “Das Brom und seine chemischen Verhältnisse” [Bromine and its chemical relationships] (in German). Heidelberg: Carl Winter. [4] Landolt, Hans Heinrich (1890). “Nekrolog: Carl Löwig”. Berichte der deutschen chemischen Gesellschaft. 23 (3): 905–909. doi:10.1002/cber.18900230395 [5]On page 341 of his article, A. J. Balard (1826) “Mémoire sur une substance particulière contenue dans l’eau de la mer” [Memoir on a peculiar substance contained in sea water], Annales de Chimie et de Physique, 2nd series, vol. 32, pp. 337–381 [6]Wisniak, Jaime (2004). “Antoine-Jerôme Balard. The discoverer of bromine” (PDF). Revista CENIC Ciencias Químicas. 35 (1): 35–40. [7]https://zh.wikipedia.org/wiki/%E5%B0%A4%E6%96%AF%E5%9B%BE%E6%96%AF%C2%B7%E5%86%AF%C2%B7%E6%9D%8E%E6%AF%94%E5%B8%8C [8] https://www.guokr.com/article/439186/?f=wx. [9]Green, Joseph (1996). “Mechanisms for Flame Retardancy and Smoke suppression – A Review”. Journal of Fire Sciences. 14 (6): 426–442. doi:10.1177/073490419601400602 [10]Kaspersma, Jelle; Doumena, Cindy; Munrob Sheilaand; Prinsa, Anne-Marie (2002). “Fire retardant mechanism of aliphatic bromine compounds in polystyrene and polypropylene”. Polymer Degradation and Stability. 77 (2): 325–331. doi:10.1016/S0141-3910(02)00067-8 [11]Lyday, Phyllis A. “Mineral Yearbook 2007: Bromine” (PDF). United States Geological Survey. Retrieved 2008-09-03. [12]Sabnis R. W. (2007). Handbook of Acid-Base Indicators. CRC Press. ISBN 0-8493-8218-1. [13]Barger, M. Susan; White, William Blaine (2000). “Technological Practice of Daguerreotypy”. The Daguerreotype: Nineteenth-century Technology and Modern Science. JHU Press. pp. 31–35. ISBN 978-0-8018-6458-2. [14]Shorter, Edward (1997). A History of Psychiatry: From the Era of the Asylum to the Age of Prozac. John Wiley and Sons. p. 200. ISBN 978-0-471-24531-5. [15]Ioffe, David and Kampf, Arieh (2002) “Bromine, Organic Compounds” in Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons. doi: 10.1002/0471238961.0218151325150606.a01
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





























No comments yet.