概要
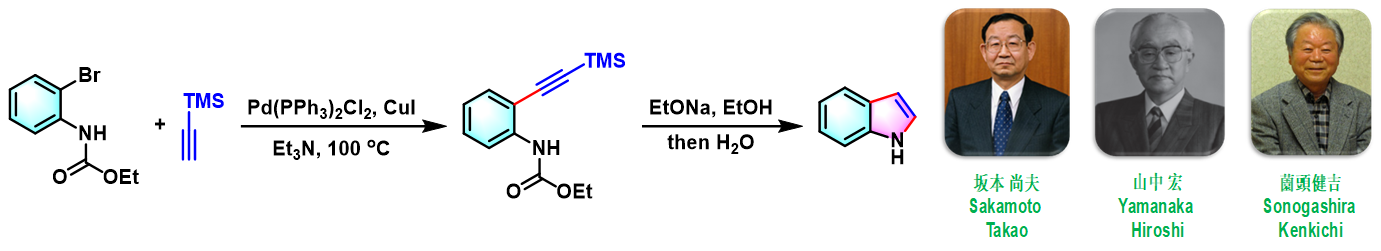
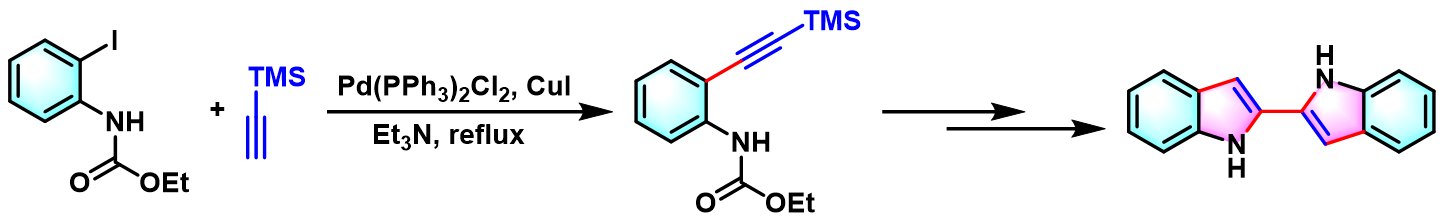
Yamanaka-Sakamoto-Sonogashira吲哚合成 (Yamanaka-Sakamoto-Sonogashira indole synthesis)是首先在钯催化剂存在下,邻卤苯胺与端炔之间发生Sonogashira-Hagihara偶联,随后,通过乙醇钠促进的环化过程,合成吲哚类化合物的反应。该反应由日本东北大学药学研究所 (東北大学大学院薬学研究科, Pharmaceutical Institute, Tohoku University)的山中宏 (山中 宏, Yamanaka Hiroshi)与坂本尚夫 (坂本 尚夫, SakamotoTakao)在1986年首次报道[1]。由于该反应第一步涉及Sonogashira (薗頭健吉, Sonogashira Kenkichi)-Hagihara (萩原信衛, Hagihara Nobue)偶联过程,因此,该反应在文献中称为Yamanaka-Sakamoto-Sonogashira吲哚合成。
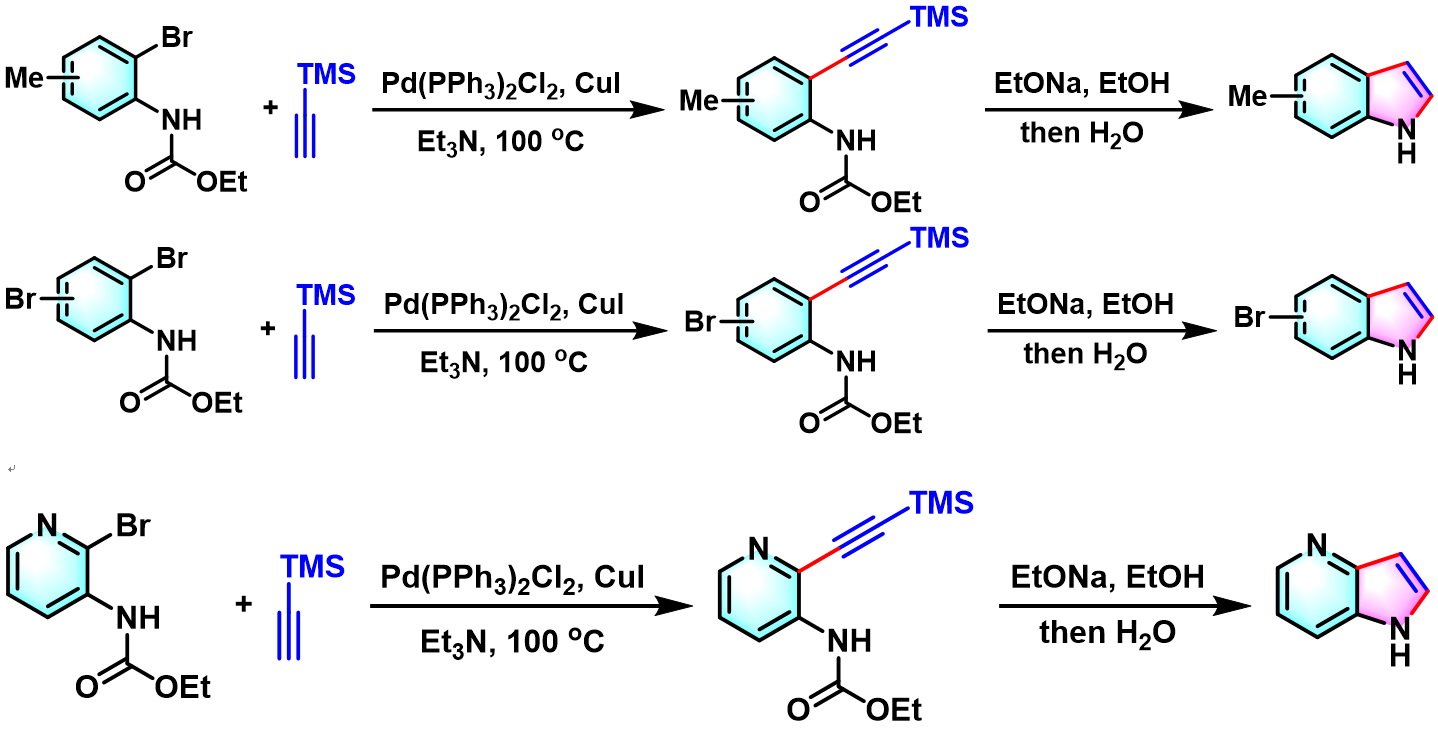
1987年,Yamanaka对该反应进行了更为深入的研究,发现各类取代邻卤苯胺在该反应条件下均能够以良好的收率获得相应吲哚类化合物。同时,Yamanaka研究表明,该反应条件对于卤代杂环芳胺同样适用[2]。
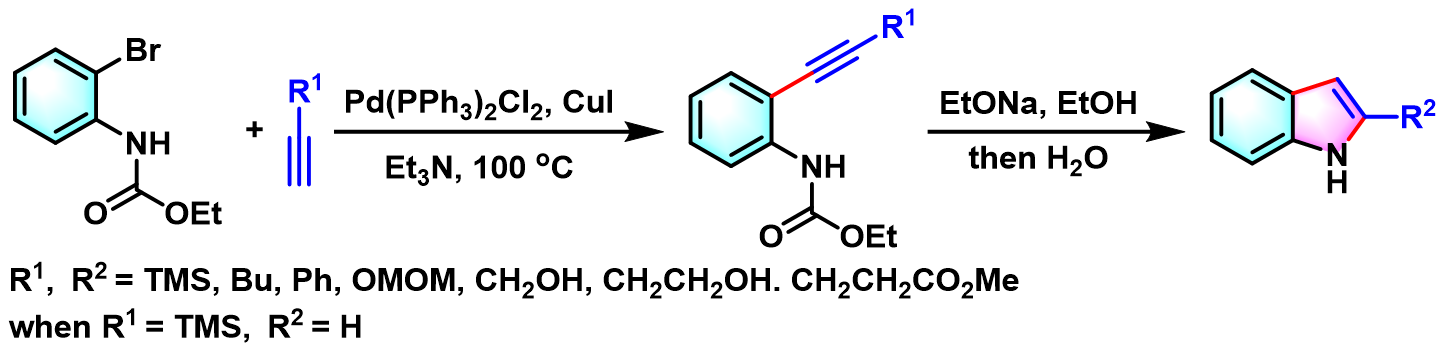
1988年,Yamanaka对端炔范围进行进一步扩展,由最初的三甲基硅基乙炔(trimethylsilylacetylene, TMSA)扩展至各类芳基及烷基取代的端炔[3]。
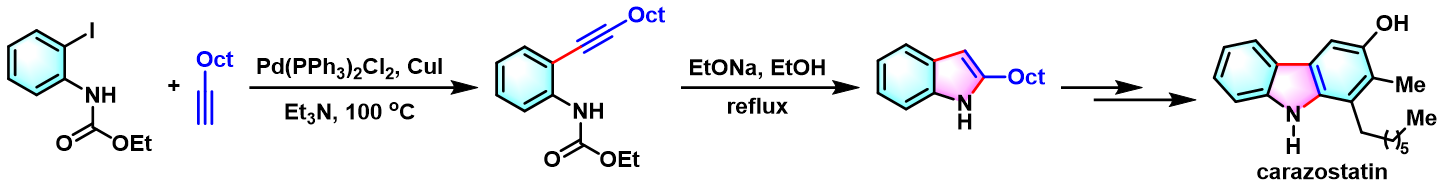
1995年,Ogasawara通过该反应,顺利完成了联吲哚类化合物的构建[4]。
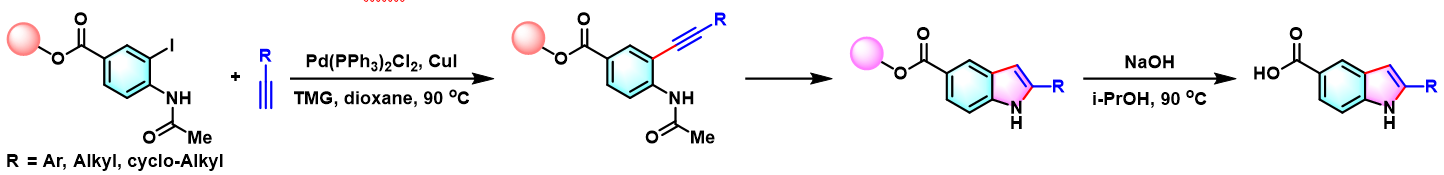
1997年,A. Bedeschi将该反应成功应用于吲哚组合化合物库的固相合成,并获得良好的收率与优良的端炔底物适用性[5]。
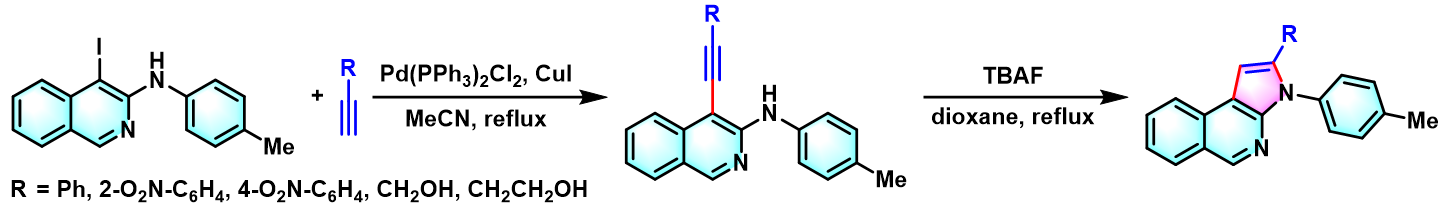
2003年,Sakamoto通过TBAF代替乙醇钠,参与成环过程,成功实现吲哚的一锅合成,具有优良的pot-economy[6]。
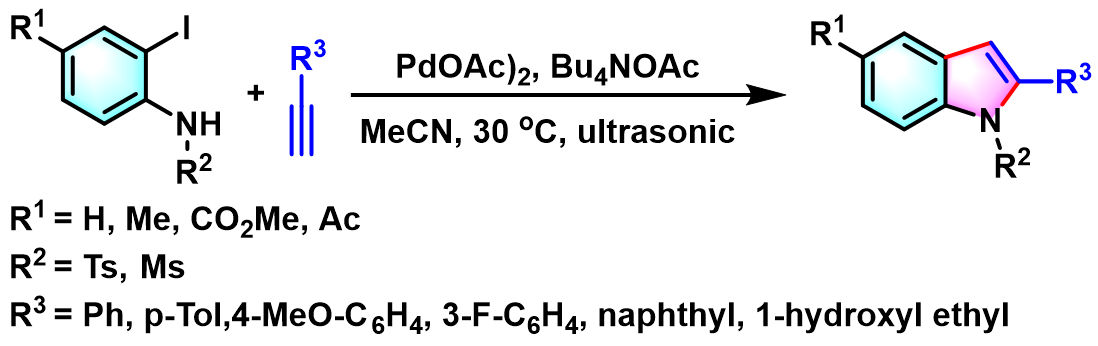
2006年,K.V. Srinivasan采用乙酸钯作为催化剂,通过超声波辐射,实现了无铜条件下吲哚化合物的一锅合成[7]。
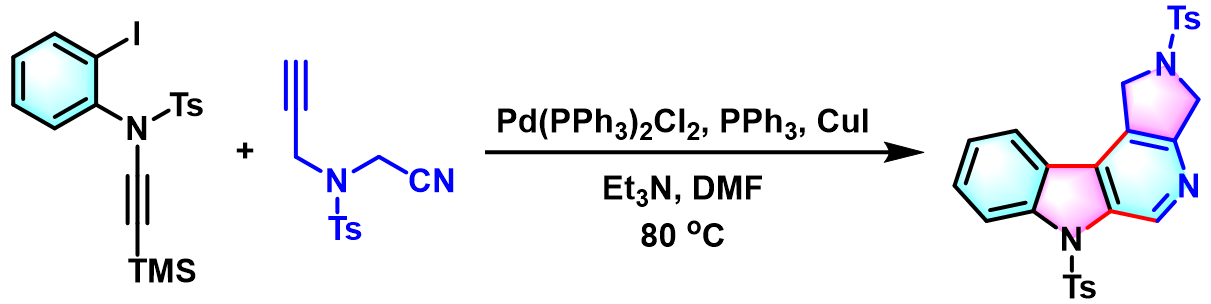
2012年,G. Hajós通过TBAF参与的后续环化过程,将该反应成功应用于稠合吡咯环3H-吡咯[2,3-c]异喹啉骨架的构建[8]。
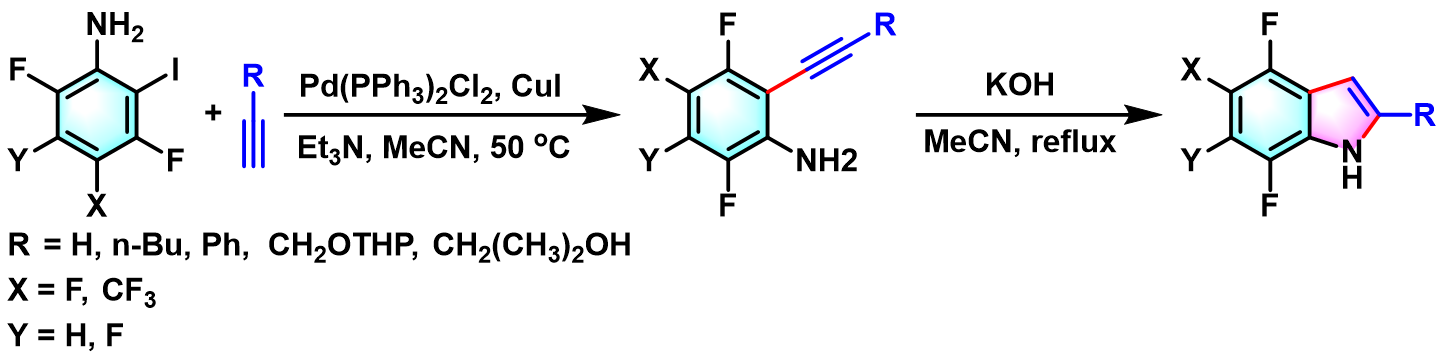
2013年,V. D. Shteingarts通过氢氧化钾促进的成环过程,成功完成多氟苯环取代的吲哚环的一锅构建[9]。
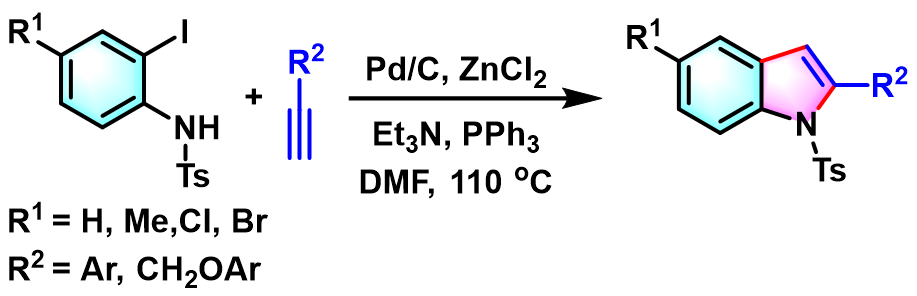
K. Ray 采用ZnCl2与Pd/C催化剂,顺利完成N-甲苯磺酰基-2-碘苯胺的吲哚环化[10]。
目前,该反应已经广泛应用于各类吲哚 [11]-[15]与稠合吡咯骨架[16]-[17]的合成、天然产物如吲哚类生物碱的全合成过程中关键砌块的构建[18]及各类药物分子的设计[19]-[22]。
基本文献
- [1] T. Sakamoto, Y. Kondo, H. Yamanaka, Heterocycles, 1986, 24, 31. doi: 10.3987/R-1986-01-0031.
- [2] T. Sakamoto, Y. Kondo, S. Iwashita, H. Yamanaka, Chem. Pharm. Bull. 1987, 35, 1823. doi: 10.1248/cpb.35.1823.
- [3] T. Sakamoto, Y. Kondo, S. Iwashita, et al., Chem. Pharm. Bull. 1988, 36, 1305. doi: 10.1248/cpb.36.1305.
- [4] K. Shin, K. Ogasawara, Synlett 1995, 859. doi: 10.1055/s-1995-5110.
- [5] M. C. Fagnola, I. Candiani, G. Visentin, W. Cabri, F. Zarini, N. Mongelli, A. Bedeschi, Tetrahedron Lett. 1997, 38, 2307. doi: 10.1016/S0040-4039(97)00300-6.
- [6] N. Suzuki, S. Yasaki, A. Yasuhara, T. Sakamoto, Chem. Pharm. Bull. 2003, 51, 1170. doi: 10.1248/cpb.51.1170.
- [7] S. S. Palimkar, P. Harish, Kumar, R. J. Lahoti, K.V. Srinivasan, Tetrahedron 2006, 62, 5109. doi: 10.1016/j.tet.2006.03.035.
- [8] B. Dixit, J. Balog, Z. Riedl, D. László, G. Hajós, Tetrahedron 2012, 68, 3560. doi: 10.1016/j.tet.2012.03.011.
- [9] L.V. Politanskaya, I. P. Chuikov, V. D. Shteingarts, Tetrahedron 2013, 69, 8477. doi: 10.1016/j.tet.2013.07.037.
- [10] A. Ahmed, M. Ghosh, P. Sarkar, J. K. Ray, Tetrahedron Lett. 2013, 54, 6691. doi: 10.1016/j.tetlet.2013.09.061.
- [11] T. Sakamoto, Y. Kondo, H. Yamanaka, Heterocycles, 1988, 27, 2225. doi: 10.3987/REV-88-392.
- [12] G. W. Gribble, J. Chem. Soc. Perkin Trans. 1, 2000, 1045. doi: 10.1039/A909834H.
- [13] T. Sakamoto, Y. Kondo, H. Yamanaka, Heterocycles 1988, 27, 2225. doi: 10.3987/REV-88-392.
- [14] M. Yamaguchi, K. Manabe, Org. Lett. 2014, 16, 2386. doi: 10.1021/ol500711z.
- [15] H. Zhang, K. K. Brumfield, L. Jaroskova, B. E. Maryanoff, Tetrahedron Lett. 1998, 39, 4449. doi: 10.1016/S0040-4039(98)00844-2.
- [16] M. G. Saulnier, D. B. Frennesson, M. S. Deshpande, D. M. Vyas, Tetrahedron Lett. 1995, 36, 7841. doi: 10.1016/0040-4039(95)01644-W.
- [17] M. M. Heravi, S. Sadjadi, Tetrahedron 2009, 65, 7761. doi: 10.1016/j.tet.2009.06.028.
- [18] G. K. Jana, S. Sinha, Tetrahedron Lett. 2010, 51, 1994. doi: 10.1016/j.tetlet.2010.02.028.
- [19] M. Yamashita, K. Ueda, K. Sakaguchi, K. Sakaguchi, H. Tokuda, A. Iida, Chem. Pharm. Bull. 2011, 59, 1289. doi: 10.1248/cpb.59.1289.
- [20] C. Pramanik, R. Bhumkar, G. Karhade, K. Ganesh, T. Pravinkumar, K. G. Narendra, K. Mukund, Org. Process Res. Dev. 2012, 16, 507. doi: 10.1021/op200284m.
- [21] B. Dulla, E. Sailaja, U. Reddy CH, A. Upendar, K. Madhu, M. Arunasree, S. Bhavani, D. Rambabu, M. V. Rao, P. M. Basaveswara, Tetrahedron Lett. 2014, 55, 921. doi: 10.1016/j.tetlet.2013.12.050.
- [22] A. J. McCarroll, T. D. Bradshaw, A. D. Westwell, et al., J. Med. Chem. 2007, 50, 1707. doi: 10.1021/jm061163m.
反应机理
反应实例
苯并吲哚的合成[1]
自由基捕捉剂carazostatin的合成[2]
环化β-carboline的合成[3]
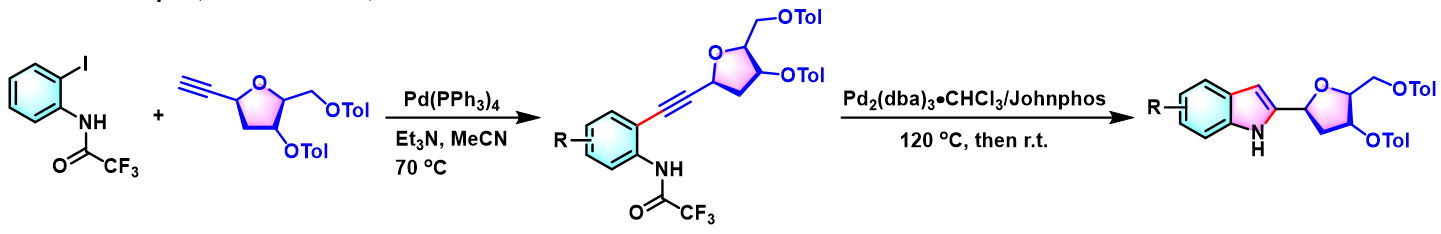
1-α-与1-β-(吲哚-2-基)-2′-脱氧核糖 C-核苷的modular合成[4]
4-官能团化-1H-吲哚的合成[5]
实验步骤
Sonogashira-Hagihara偶联产物的合成:将2-溴-N-乙酰苯胺 (1 eq.)、三甲基硅基乙炔 (1.5 eq.)、Pd(PPh3)2Cl2 (0.04 eq.)、CuI (0.08 eq.)及Et3N (2.9 eq.) 装入封管内。将上述反应混合物在100oC下加热,直至反应结束。反应结束后,将反应混合物加水稀释,再采用乙醚进行萃取。将合并的有机相加入无水硫酸钠进行干燥后,减压除去溶剂。 将残余物通过硅胶柱色谱 (正己烷/丙酮 20:1 v/v或正己烷/苯 3:1 v/v作为洗脱剂)分离,获得粗产物。将粗产物通过重结晶或减压蒸馏进一步纯化,获得相应Sonogashira-Hagihara偶联产物。
乙醇钠促进的环化:向上述Sonogashira-Hagihara偶联产物 (1 eq.)中加入乙醇钠 (5eq.)及无水乙醇 (底物浓度为0.1 M),后将上述混合物加热回流,直至反应结束。反应结束后,减压除去乙醇。将残余物加水稀释,再加入三氯甲烷进行萃取。合并的有机相加入无水硫酸钠进行干燥,减压除去溶剂。粗产物采用硅胶柱色谱 (苯作为洗脱剂) 分离纯化,获得最终吲哚产物。
参考文献
- [1] T. Sakamoto, Y. Kondo, H. Yamanaka, Heterocycles 1986, 24, 1845. doi: 10.3987/R-1986-07-1845.
- [2] K. Shin, K. Ogasawara, Chem. Lett. 1995, 289. doi: 10.1246/cl.1995.289.
- [3] S.P. Mulcahy, J. G. Varelas, Tetrahedron Lett. 2013, 54, 6599. doi: 10.1016/j.tetlet.2013.09.108.
- [4] D. Nečas, D. Hidasová, M. Hocek, M. Kotora, Org. Biomol. Chem. 2011, 9, 5934. doi: 10.1039/C1OB05844D.
- [5] R. Sanz, V. Guilarte, N. García, Org. Biomol. Chem. 2010, 8, 3860. doi: 10.1039/C004360E.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.