概要
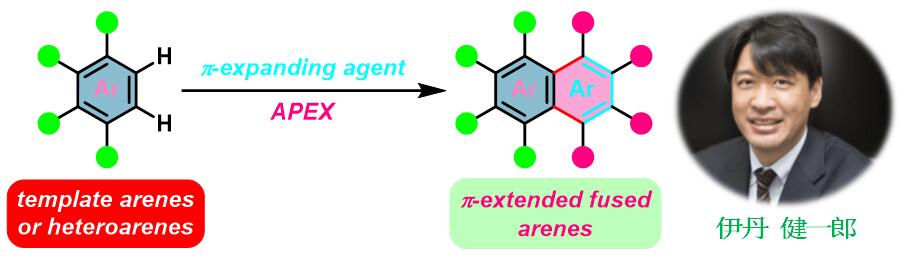
Itami APEX反应[1] (Itami环化π-扩张反应,Itami annulative π-extension reaction)是采用非官能团化的芳香化合物模板 (如多环芳烃菲[1], [7], [20] 、芘[1], [5]、苝[2]、蒄[2] 、corannulene[3]、䓛[7]等)与杂芳香化合物模板 (如吡咯[2], [18]、噻吩[3], [6], [33]、苯并噻吩[4], [6], [20], [33]、吲哚[2], [6]、呋喃[6]及苯并呋喃[6], [26], [28]、硒吩(selenophene)[33]等)及芳炔[2], [24] (既可以作为芳香化合物模板[24]也可以作为π-扩张试剂[2])与各类π-扩张试剂 (π-expanding agent , 又称为π-扩张单元 (π-extension unit),如二甲基二苯并噻咯[1]-[6], [24] (dimethyldibenzosilole)、二苯并锗杂环戊二烯[6] (dibenzogermole)、二卤联芳[3], [7]-[8]、烯烃[9]-[14]、苯炔[15]-[16]及炔烃[17]-[20]等) 作用,进行的一锅 (single-step, , one-pot or one-shot)快速合成π-扩张的稠环芳烃 (π-extended fused arene)及稠杂环芳烃的反应。
这一全新的合成方法学概念由日本名古屋大学理学院化学系 (名古屋大学理学研究科化学系,Department of Chemistry, Graduate School of Science, Nagoya University)的伊丹健一郎 (伊丹 健一郎,Itami Kenichiro) 研究室在2015年首次提出[1]。与传统的稠环芳烃合成方法相比,APEX反应无需任何前官能团化 (prefunctionalization,如卤化、金属化等)步骤,实验操作简便,具有优良的区域选择性、步骤及原子经济性 (step/atom economy),为π-扩张的稠环芳烃及稠环芳烃材料的快速合成提供了十分有价值的方法[1]-[9], [24]。
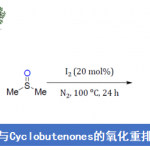
目前,APEX反应所用的芳香化合物模板已由多环芳烃扩展至结构简单的芳烃苯[19]与萘[19],而π-扩张试剂同样已经扩展至1-乙烯基炔丙醇[21]、α-重氮羰基化合物[22]-[23], [25]、各类酮[26]-[27]、各类酯[28], [29]、环状二芳基碘鎓盐[30]、各类醛[31]-[32]及缩醛[33]-[34]、酸酐[35]、二氢呋喃类[36]、二醇[37]、过氧化物[38]及phenanthroselenophenes[39]等多种不同的有机结构单元。同时,Itami APEX 反应已经广泛应用于采用传统方法难以合成的各类复杂稠环芳烃[1]-[9]、单手性碳纳米管(Single-chirality carbon nanotubes, CNTs) [40] (nanographenes)及石墨烯纳米带[41](GNR, graphene nanoribbons)的快速构建。本文中,小编着重介绍Itami研究组发展的芳香、杂芳香化合物模板及π-扩张单元。涉及其它芳香、杂芳香化合物模板与π-扩张单元的相关反应将在下篇文章中进行详细介绍。
基本文献
- [1] K. Ozaki, K. Kawasumi, M. Shibata, H. Ito, K. Itami, Nat. Commun. 2015, 6, 6251. doi: 10.1038/ncomms7251.
- [2] H. Ito, K. Ozaki, K. Itami, Angew. Chem., Int. Ed. 2017, 56, 11144.
- doi: 10.1002/anie.201701058.
- [3] K. Kato, Y. Segawa, K. Itami, Can. J. Chem. 2017, 95, 329. doi: 10.1139/cjc-2016-0467.
- [4] H. Ito, Y. Segawa, K. Murakami, K. Itami, J. Am. Chem. Soc. 2019, 141, 3. doi: 10.1021/jacs.8b09232.
- [5] Y. Yano, H. Ito, Y. Segawa, K. Itami, Synlett 2016, 27, 2081. doi: 10.1055/s-0035-1561455.
- [6] K. Ozaki, W. Matsuoka, H. Ito, K. Itami, Org. Lett. 2017, 19, 1930. doi: 10.1021/acs.orglett.7b00684.
- [7] W. Matsuoka, H. Ito, K. Itami, Angew. Chem., Int. Ed. 2017, 56, 12224. doi: 10.1002/anie.201707486.
- [8] H. Kitano, W. Matsuoka, H. Ito, K. Itami, Chem. Sci. 2018, 9, 7556. doi: 10.1039/C8SC02802H.
- [9] K. Ozaki, H. Zhang, H. Ito, A. Lei, K. Itami, Chem. Sci. 2013, 4, 3416. doi: 10.1039/C3SC51447A.
- [10] T. Guo, Q. Jiang, F. Huang, J. Chen, Z. Yu, Org. Chem. Front. 2014, 1, 707. doi: 10.1039/c4qo00122b.
- [11] A. K. Verma, A. K. Danodia, R. K. Saunthwal, M. Patel, D. Choudhary, Org. Lett., 2015, 17, 3658. doi: 10.1021/acs.orglett.5b01476.
- [12] J. K. Laha, N. Dayal, Org. Lett., 2015, 17, 4742. doi: 10.1021/acs.orglett.5b02265.
- [13] R. K. Saunthwal, K. M. Saini, M. Patel, A. K. Verma, Tetrahedron, 2017, 73, 2415. doi: 10.1016/j.tet.2017.03.028.
- [14] E. H. Fort, L. T. Scott, Angew. Chem. Int. Ed. 2010, 49, 6626. doi: 10.1002/anie.201002859.
- [15] B. Schuler, S. Collazos, L. Gross, G. Meyer, D. Pérez, E. Guitián, D. Peña, Angew. Chem. Int. Ed. 2014, 53, 9004. doi: 10.1002/anie.201403707.
- [16] E. H. Fort, L. T. Scott, Tetrahedron Lett. 2011, 52, 2051. doi: 10.1016/j.tetlet.2010.10.033.
- [17] B. M.M. Yamashita, H. Horiguchi, K. Hirano, T. Satoh, M. Miura, J. Org. Chem., 2009, 74, 7481. doi: 10.1021/jo9016698.
- [18] Y. Matsuda, S. Naoe, S. Oishi, N. Fujii, H. Ohno, Chem. Eur. J., 2015, 21, 1463. doi: 10.1002/chem.201405903.
- [19] Y. Wu, K. Huang, C. Shin, T. Wu, Chem. Eur. J. 2008, 14, 6697. doi: 10.1002/chem.200800538.
- [20] E. H. Fort, M. S. Jeffreys, L. T. Scott, Chem. Commun. 2012, 48, 8102. doi: 10.1039/c2cc33885h.
- [21] N. Thies, C. G. Hrib, E. Haak, Chem. Eur. J., 2012, 18, 6302. doi: 10.1002/chem.201200188.
- [22] S. G. Dawande, V. Kanchupalli, J. Kalepu, H. Chennamsetti, B. S. Lad, S. Katukojvala, Angew. Chem,. Int. Ed., 2014, 53,4076. doi: 10.1002/anie.201400161.
- [23] K. S. Rathore, M. Harode, S. Katukojvala, Org. Biomol. Chem., 2014, 12, 8641. doi: 10.1039/c4ob01693a.
- [24] K. Ozaki, K. Murai, W. Matsuoka, K. Kawasumi, H. Ito, K. Itami, Angew. Chem. Int. Ed. 2017, 56, 1361. doi: 10.1002/anie.201610374.
- [25] J. Wu, Z. Yang, S. Zhang, C. Jiang, Q. Li, Z. Huang, H. Wang, ACS Catal., 2015, 5, 6453. doi: 10.1021/acscatal.5b01801.
- [26] S. Paria, O. Reiser, Adv. Synth. Catal., 2014, 356, 557. doi: 10.1002/adsc.201301069.
- [27] M. Abid, A. Spaeth, B. Török, Adv. Synth. Catal. 2006, 348, 2191. doi: 10.1002/adsc.200606200.
- [28] J. A. Clement, R. Sivasakthikumaran, A. K. Mohanakrishnan, S. Sundaramoorthy, D. Velmurugan, Eur. J. Org. Chem. 2011, 569. doi: 10.1002/ejoc.201001174.
- [29] Y. Wu, X. Peng, Y. Nagase, T. Miyamura, K. Inoue, T. Tsuchimoto, Chem. Lett. 2013, 42, 1170. doi: 10.1246/cl.130402.
- [30] B. Luo, F. Wu, B. Liu, F. Song, P. Huang, S. Wen, Org. Biomol. Chem., 2014, 12, 9777. doi: 10.1039/C4OB02170C.
- [31] M. L. Deb, B. Baruah, P. J. Bhuyan, Synthesis 2008, 286. doi: 10.1055/s-2008-1000849.
- [32] R. Tang, J. Li, Chem. Eur. J. 2010, 16, 4733. doi: 10.1002/chem.201000133.
- [33] S. M. Rafiq, R. Sivasakthikumaran, A. K. Mohanakrishnan, Org. Lett. 2014, 16, 2720. doi: 10.1021/ol501006t.
- [34] A. Suárez, P. García-García, M. P. Fernández-Rodríguez, R. Sanz, Adv. Synth. Catal. 2014, 356, 374. doi: 10.1002/adsc.201300868.
- [35] E. Clar, M. Zander, J. Chem. Soc. 1957, 4616. doi: 10.1039/JR9570004616.
- [36] J. Zhao, P. Li, C. Xia, F. Li, Chem. Eur. J. 2015, 21, 16383. doi: 10.1002/chem.201503260.
- [37] A. Kulkarni, P. Quang, B. Török, Synthesis 2009, 4010. doi: 10.1055/s-0029-1217052.
- [38] X. Zheng, L. Lv, S. Lu, W. Wang, Z. Li, Org. Lett. 2014, 16, 5156. doi: 10.1021/ol5025053.
- [39] X. Shi, S. Mao, T. Roisnel, H. Doucet, J.-F. Soulé, Org. Chem. Front., 2019, 6, 2398. doi: 10.1039/C9QO00218A.
- H. Fort, P. M. Donovan, L. T. Scott, J. Am. Chem. Soc. 2009, 131, 16006. doi: 10.1021/ja907802g.
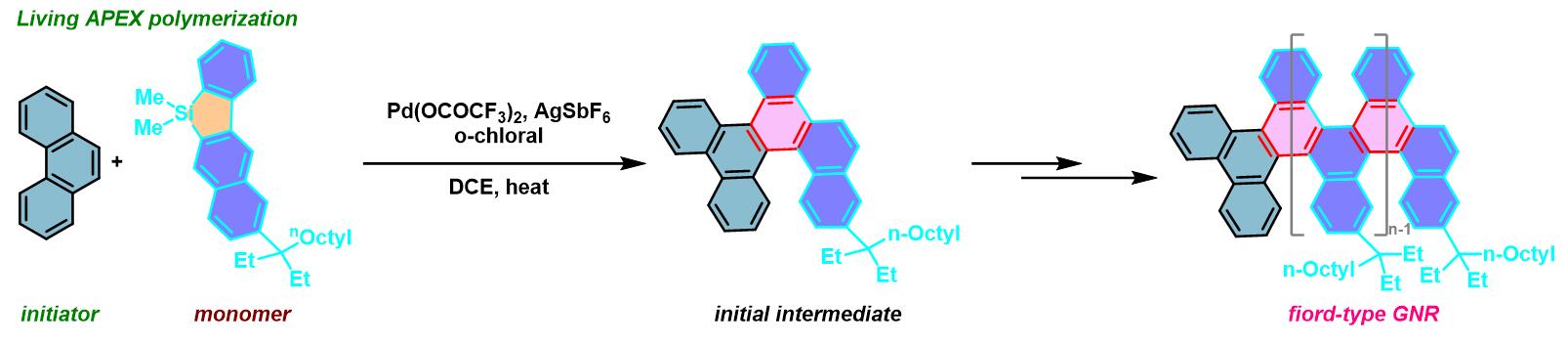
- Yano, N. Mitoma, K. Matsushima, F. Wang, K. Matsui, A. Takakura, Y. Miyauchi, H. Ito, K. Itami, Nature, 2019, 571, 387. doi: 10.1038/s41586-019-1331-z.
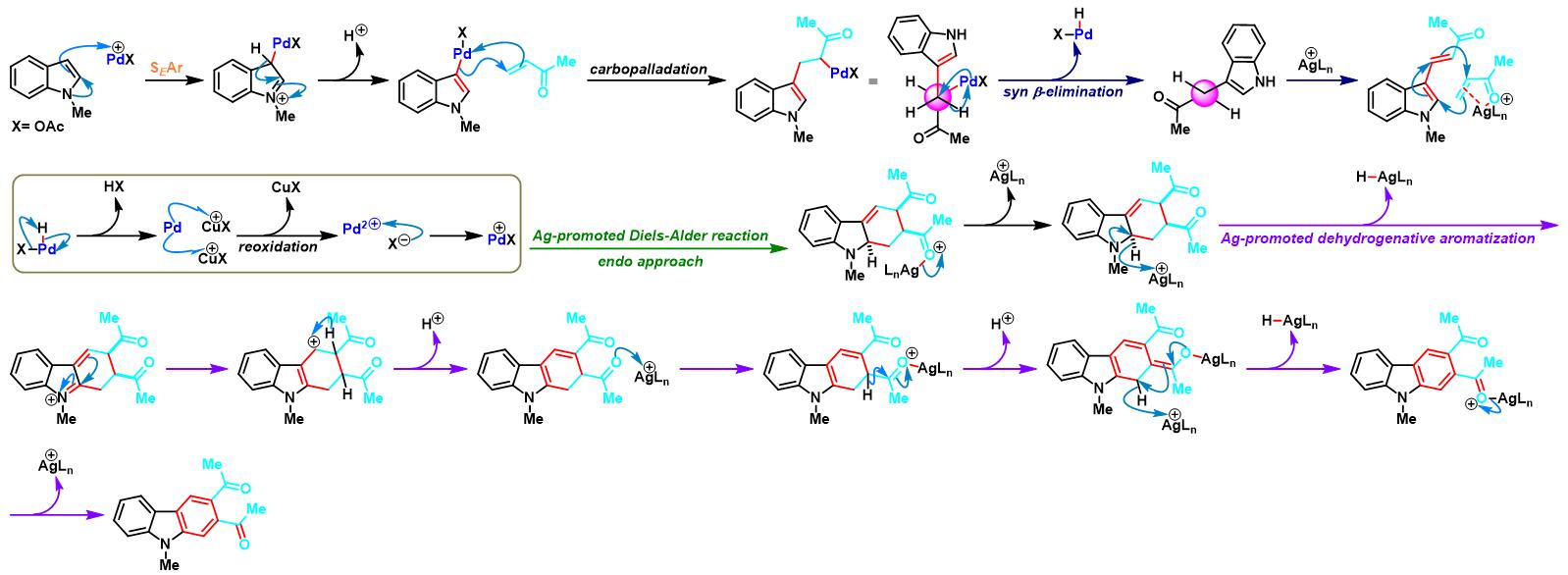
反应机理
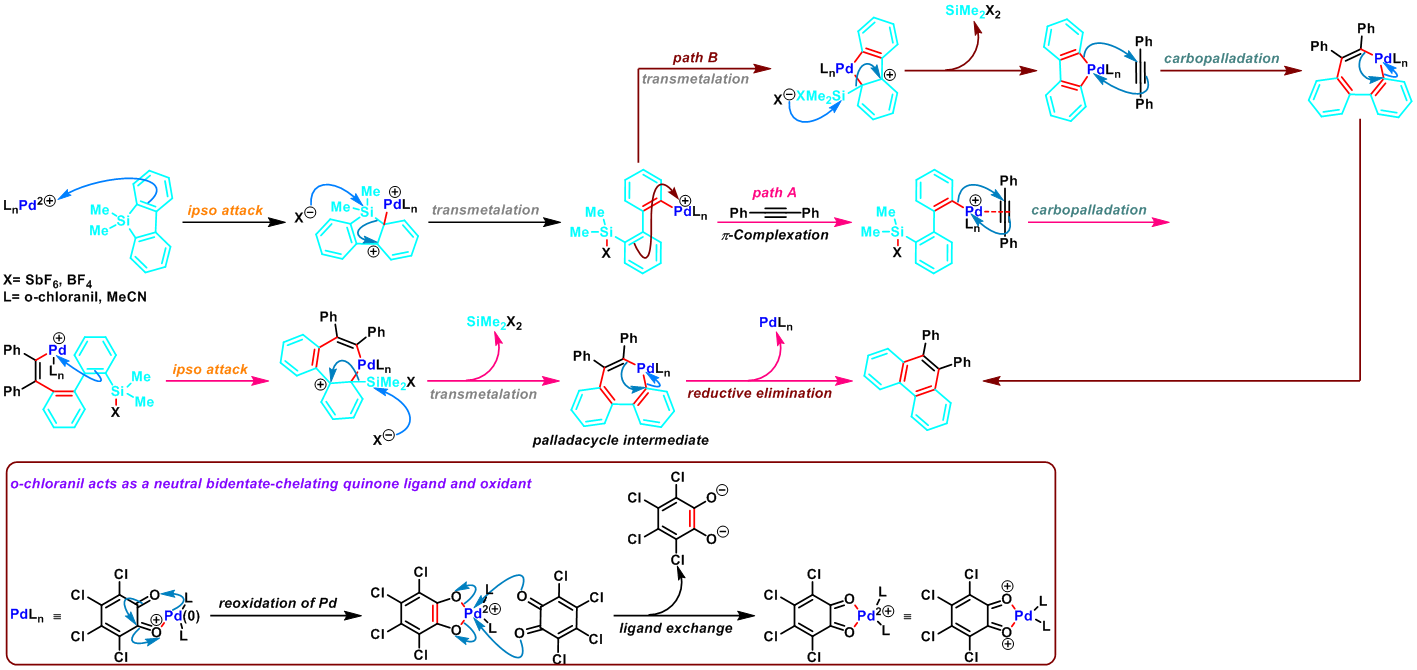
二苯并噻咯参与的APEX反应[1]:
共轭烯酮参与的APEX反应[2]-[3]:
芳基卤参与的APEX反应[4]-[5]:
炔烃参与的APEX反应[6]:
基本文献
- [1] M. Shibata, H. Ito, K. Itami, J. Am. Chem. Soc. 2018, 140, 2196. doi: 10.1021/jacs.7b11260.
- [2] N. P. Grimster, C. Gauntlett, C. R. A. Godfrey, M. J. Gaunt, Angew. Chem., Int. Ed., 2005, 44, 3125. doi: 10.1002/anie.200500468.
- [3] M. Liu, H. Wang, H. Zeng, C. Li, Sci. Adv. 2015, 1, e1500020. doi: 10.1126/sciadv.1500020.
- [4] H. Kitano, W. Matsuoka, H. Ito, K. Itami, Chem. Sci. 2018, 9, 7556. doi: 10.1039/C8SC02802H.
- [5] C. Jia, W. Lu, J. Oyamada, T. Kitamura, K. Matsuda, M. Irie, Y. Fujiwara, J. Am. Chem. Soc. 2000, 122, 7252. doi: 10.1021/ja0005845.
- [6] K. Ozaki, K. Murai, W. Matsuoka, K. Kawasumi, H. Ito, K. Itami, Angew. Chem. Int. Ed. 2017, 56, 1361. doi: 10.1002/anie.201610374.
反应实例
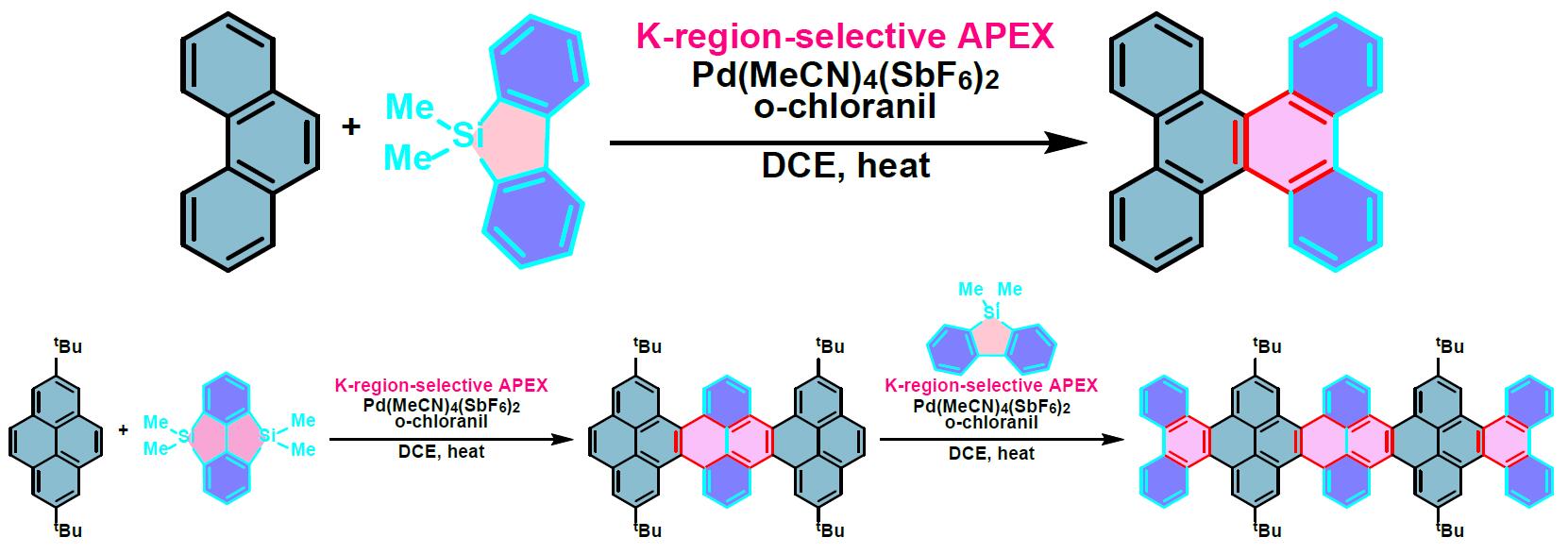
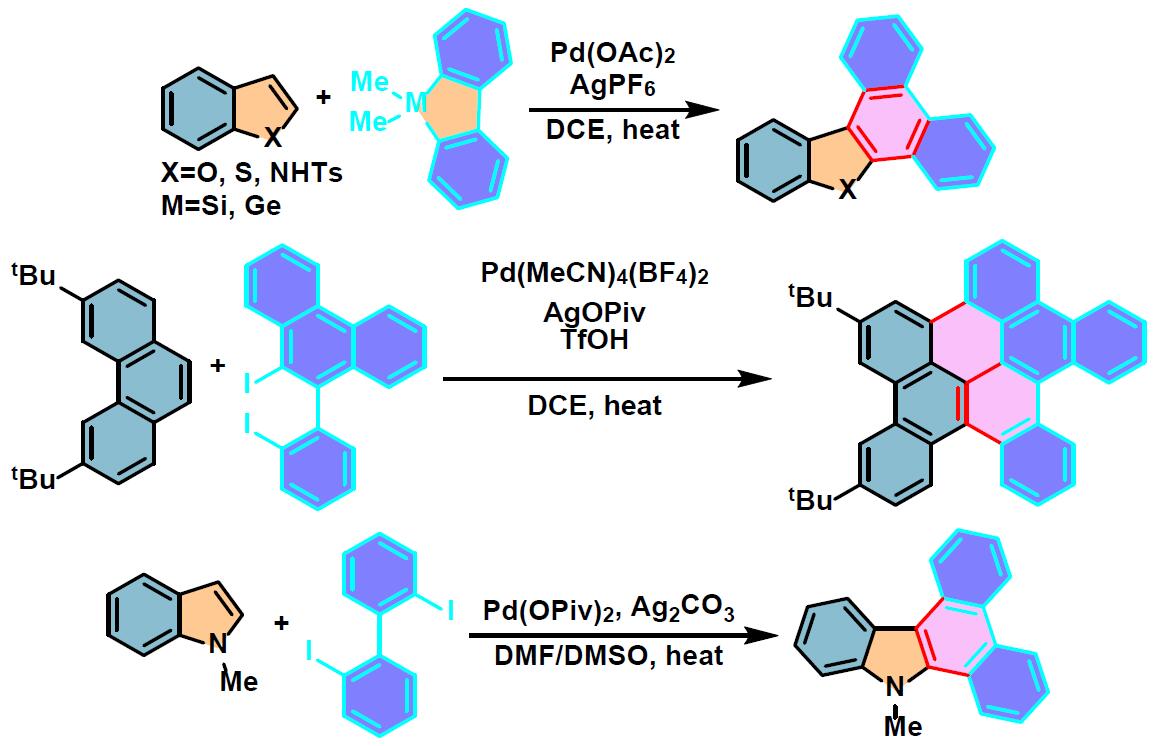
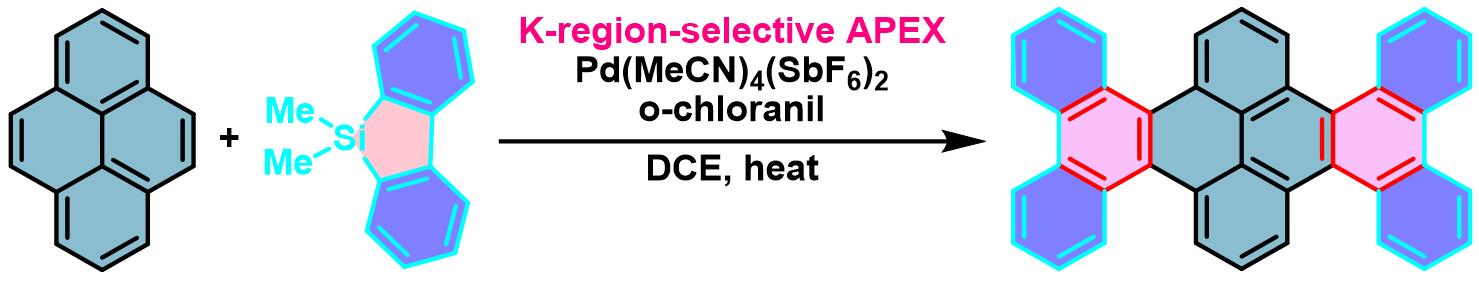
phenanthro[9,10-a]corannulene的合成[1]
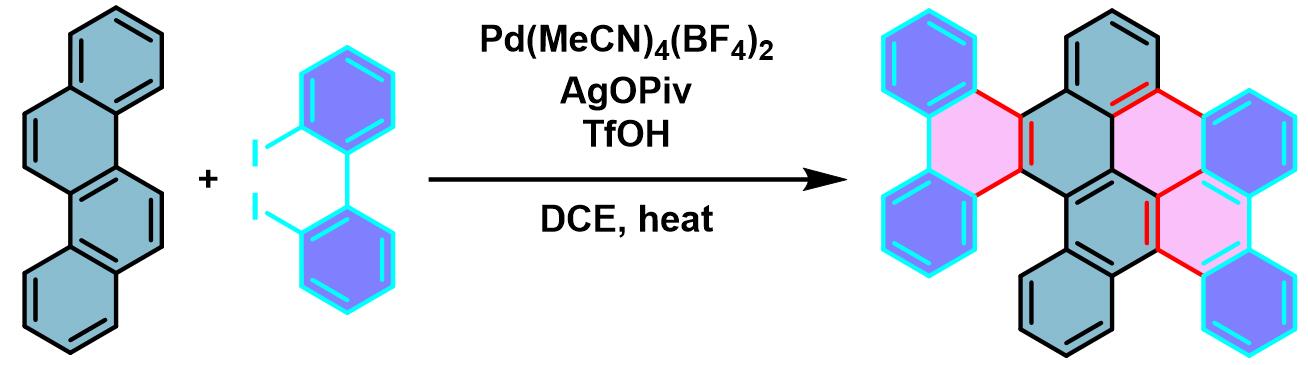
六苯并[a,c,fg,j,l,op]并四苯的合成[2]
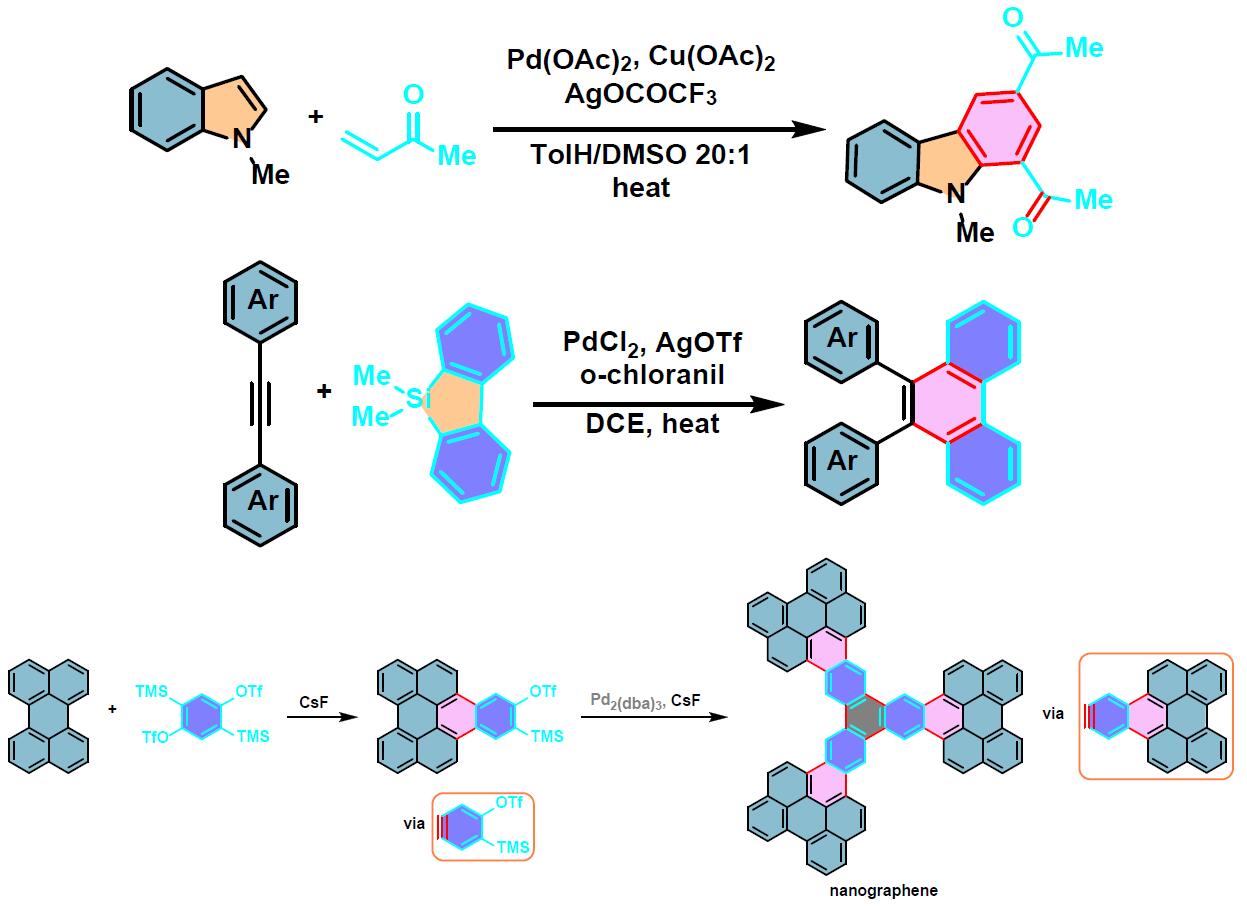
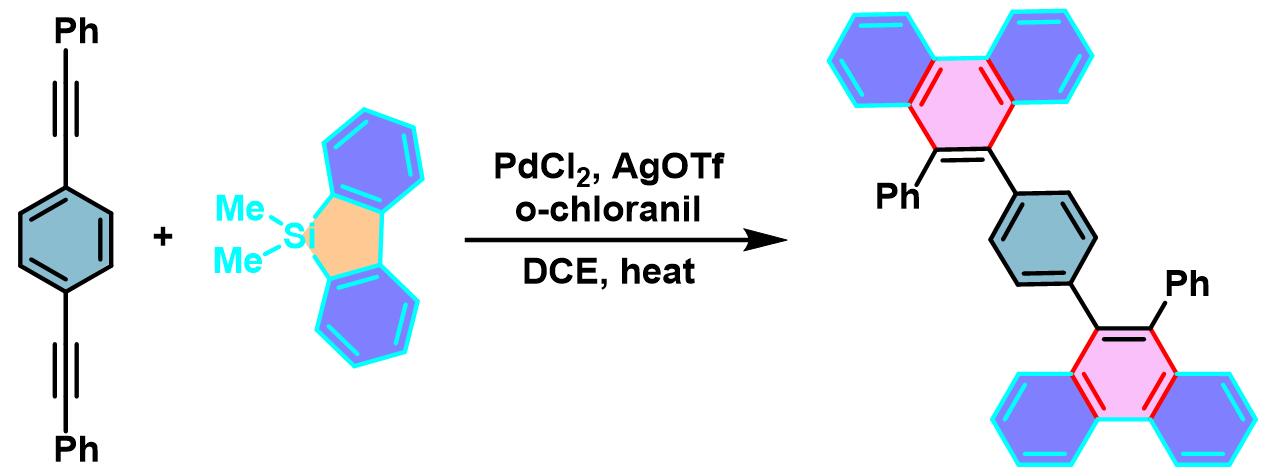
π-扩张稠环芳烃的合成[3]
双重APEX反应[4]
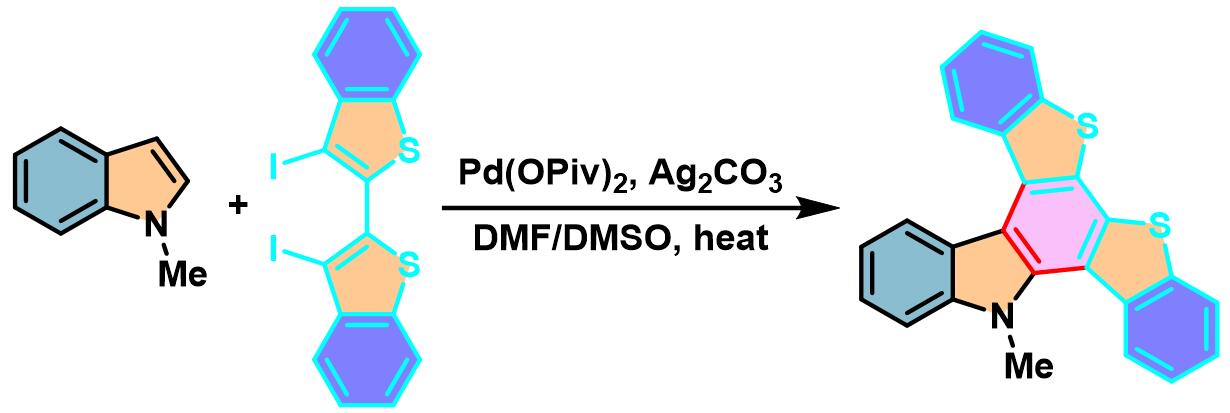
N-S-PACs的合成[5]
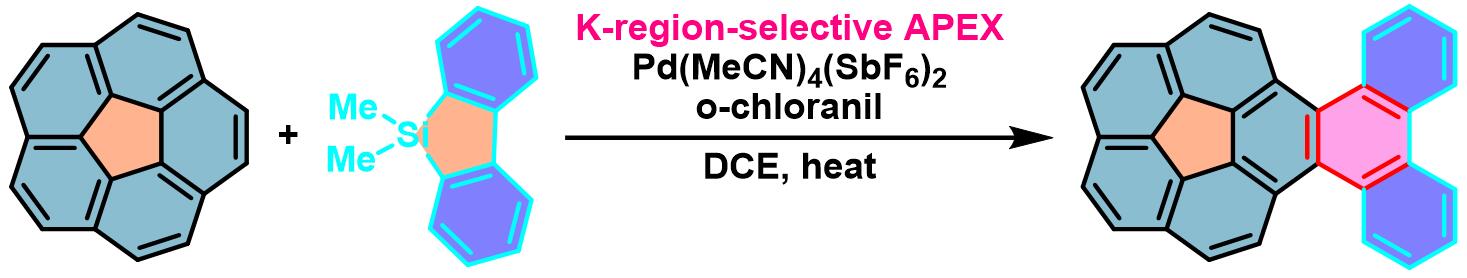
GNR的合成[6]
实验步骤
二苯并噻咯参与的APEX反应
将菲 (1 eq.)、二苯并噻咯 (1.5 eq.)、Pd(CH3CN)4(SbF6)2 (0.05 eq.)、四氯对苯醌 (2.0 equiv)及搅拌子装入螺口试管(screw cap test tube, screw-top test tube)中。将试管用有孔塑料盖 (perforated plastic cap)密封,通过长针减压排除试管内的空气。充入氩气后,加入1,2-二氯乙烷 (底物浓度为0.1M),随后移出长针,并密封试管,将其置于铝加热器(aluminum heating block)中,维持温度为80oC,对上述反应混合物进行加热搅拌,直至反应结束。反应结束后,将反应混合物冷却至室温,通过硅藻土进行过滤,并用DCM进行洗涤。减压除去溶剂后,将残余物采用硅胶柱色谱(正己烷作为洗脱剂)进行分离纯化,获得相应π-扩张产物。
共轭烯酮参与的APEX反应
将装有搅拌子的螺口试管在真空条件下,采用热风枪(heat-gun)加热的方式进行干燥。待试管冷却后,在空气存在下,将Pd(OAc)2 (0.01 eq.)、Cu(OAc)2 (0.02 eq.)、AgOCOCF3 (4 eq.) 、甲基乙烯基酮 (10 eq.)、N-甲基吲哚 (1 eq.)、甲苯 (底物浓度为0.1M)及DMSO (与甲苯体积比为20:1 v/v)加入试管中。试管密封后,将上述反应混合物在100oC下进行加热搅拌,直至反应结束。反应结束后,将反应混合物冷却至室温,通过硅藻土进行过滤,并用乙酸乙酯进行洗涤。减压除去溶剂后,将残余物采用硅胶柱色谱进行分离纯化(正己烷/乙酸乙酯3:1 v/v 作为洗脱剂)获得相应π-扩张产物。
二卤联芳参与的APEX反应
在空气存在下,向装有搅拌子的螺口试管中加入吲哚或吡咯 (1 eq.)、二碘联芳 (1.5 eq.)、Ag2CO3 (1.5 equiv)、Pd(OPiv)2 (0.05 eq.)、DMF (底物浓度为0.3M)及DMSO (与DMF体积比为7:3)。试管密封后,将上述反应混合物在80oC下进行加热搅拌,直至反应结束。反应结束后,将反应混合物冷却至室温,通过硅藻土进行过滤,并用乙酸乙酯或三氯甲烷进行洗涤。减压除去溶剂后,将残余物采用MPLC (开始时采用纯正己烷,之后采用正己烷/三氯甲烷9:1 v/v 作为洗脱剂,进行梯度洗脱)进行分离纯化获得相应π-扩张产物。
炔烃参与的APEX反应
在手套箱中,将AgOTf (0.01 eq.)加入装有搅拌子的螺口试管中。后将螺口试管移出手套箱,在氮气气氛下加入二芳基乙炔(1 eq.)、二苯并噻咯(2.0 eq.), PdCl2 (0.05 eq.)、四氯对苯醌(2.0 equiv)及1,2-二氯乙烷 (底物浓度为0.1M)。将上述反应混合物在80oC下进行加热搅拌,直至反应结束。反应结束后,将反应混合物冷却至室温,通过硅藻土进行过滤,并用DCM进行洗涤。减压除去溶剂后,将残余物采用硅胶柱色谱 (正己烷/三氯甲烷9:1 v/v 作为洗脱剂)进行分离纯化获得相应π-扩张产物。
参考文献
- [1] K.Kato, Y. Segawa, K. Itami, Can. J. Chem. 2017, 95, 329. doi: 10.1139/cjc-2016-0467.
- [2] Y. Yano, H. Ito, Y. Segawa, K. Itami, Synlett 2016, 27, 2081. doi: 10.1055/s-0035-1561455.
- [3] W. Matsuoka, H. Ito, K. Itami, Angew. Chem., Int. Ed. 2017, 56, 12224. doi: 10.1002/anie.201707486.
- [4] K. Ozaki, K. Murai, W. Matsuoka, K. Kawasumi, H. Ito, K. Itami, Angew. Chem. Int. Ed. 2017, 56, 1361. doi: 10.1002/anie.201610374.
- [5] H. Kitano, W. Matsuoka, H. Ito, K. Itami, Chem. Sci. 2018, 9, 7556. doi: 10.1039/C8SC02802H.
- [6] Y. Yano, N. Mitoma, K. Matsushima, F. Wang, K. Matsui, A. Takakura, Y. Miyauchi, H. Ito, K. Itami, Nature, 2019, 571, 387. doi: 10.1038/s41586-019-1331-z.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.