之前介绍的是不饱和烃、不饱和醛酮的还原反应,本节主要介绍一系列羧酸衍生物的还原反应。
- 由酯还原得到醛或醇
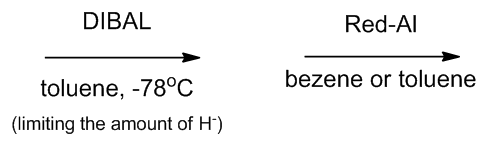
Figure 1 | 可以将醛还原成醇的方法
在这些条件下,环酯会被还原成二醇。反应过程,特别是LAH,会很容易和其他官能团发生反应,并且较难控制;这些反应之后,生成的烷氧基铝在溶剂中是难溶解的,因此活化步骤可能会很麻烦,但是用Na2SO4处理可以很有效的解决这个问题。
Examples:
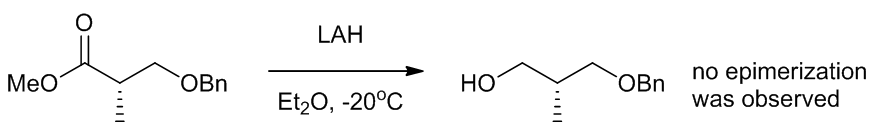
(1)将酯还原成醇1
Scheme 1 | 用 LAH将酯还原成醇例1
Scheme 2 |用 LAH将酯还原成醇例2
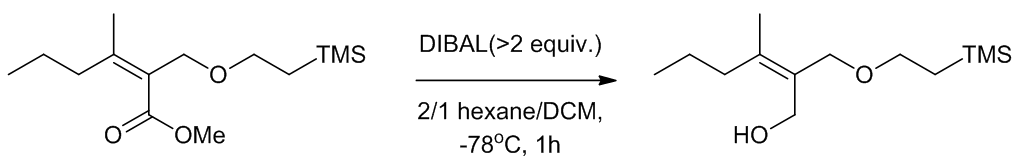
(2)内酯还原成二醇
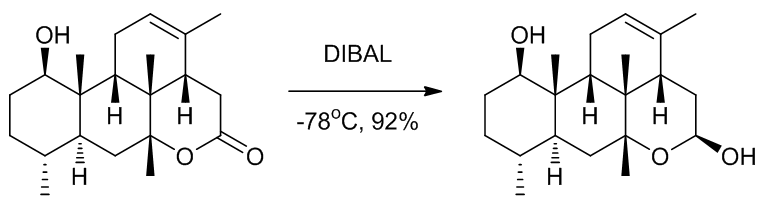
Scheme 3 | DIBAL将酯还原成醇例3
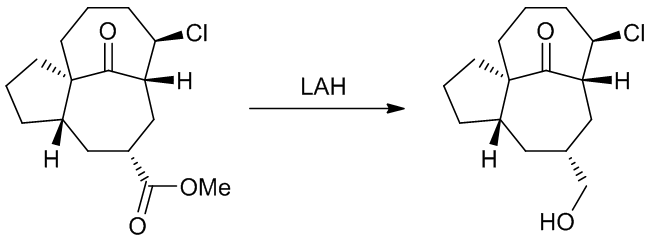
(3)因为氯原子和很大的位阻,酮在反应中不会受到影响3
Scheme 4 | 一个特例
- 生成醛(半还原)
Figure 2 | 生成醛的方法
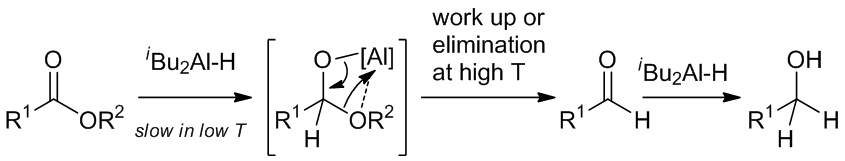
部分还原即是在酯的还原过程中将反应停留在生成醛并且避免过度氧化,这和反应底物有很大的关系,通常需要严格控制还原剂的加入,因为生成的醛发生还原的速度比酯要快。位阻较大的还原剂,例如DIBAL和Red-Al就可以很好的实现反应,但是它们常被用于将酯直接还原成醇的反应。
一般的反应机理:
Scheme 5 | 反应机理
Examples:
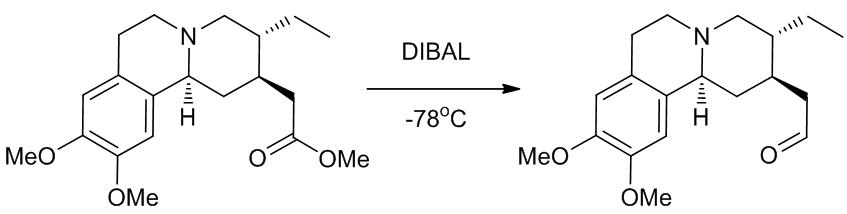
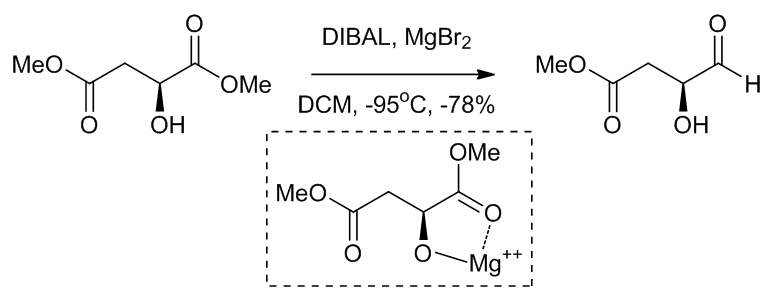
(4)将酯还原成醛4
Scheme 6 | 将酯半还原成醛例1
(5)内酯会还原得到内半缩醛5
Scheme 7 | 将酯半还原例2
(6)镁离子可以使得生成在位阻较大的一侧进攻的产物,是因为五元环相对于六元环更容易生成6
Scheme 8 |将酯半还原例3
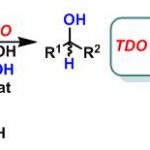
- 由羧酸还原生成醇
a.直接还原法
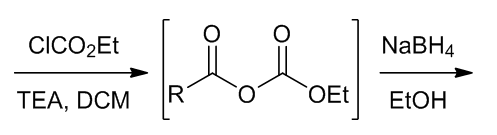
Figure 3 | 将羧酸直接转化成醇的方法
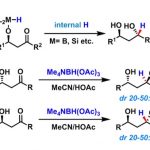
在使用硼烷时需要2 equiv.的硼试剂,此外硼烷还会还原醛,酮,酰胺,炔和烯烃,但是酯,腈,卤代烃,环氧化合物和硝基化合物通常较为惰性。和其他亲核的硼试剂不同,硼烷是亲电的,因此还原羧酸时碱性的条件十分重要;因为酯基的吸电效应而使得酯的活性不好,因此羧酸可以在酯的介质中进行还原。
Examples:
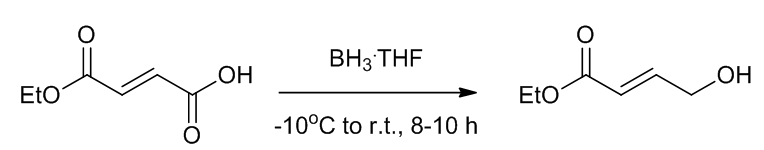
(7)用硼烷将羧酸还原成醇7
Scheme 9 | 用硼烷将羧酸还原成醇例1
(8)See ref. 8
Scheme 10 |用硼烷将羧酸还原成醇例2
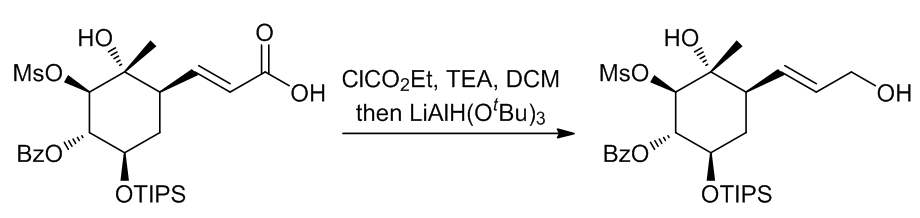
b.间接法
Figure 4 | 将羧酸通过中间体还原成醇
Example:
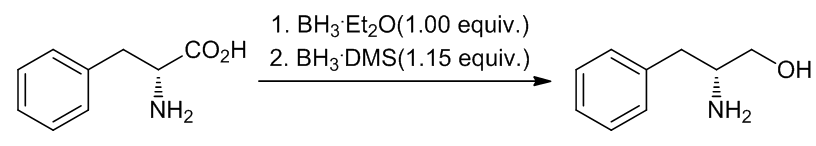
(9)双键不受影响的例子9
Scheme 11 | 间接法还原羧酸化合物
- 酰胺和腈的还原到醛
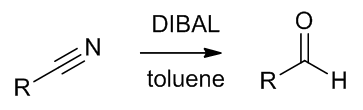
- 由DIBAL得到醛
Scheme 12 | 用DIBAL将腈还原成醛
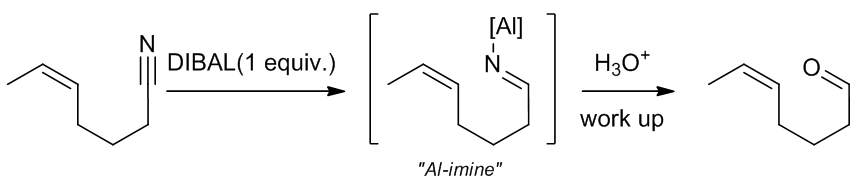
酰胺一般不和DIBAL反应,但是腈可以被还原成醛。通常这个反应会停留在生成烯胺的步骤,之后水解活化就可以得到醛了。
Examples:
(10)
Scheme 13 |用DIBAL将腈还原成醛的例子
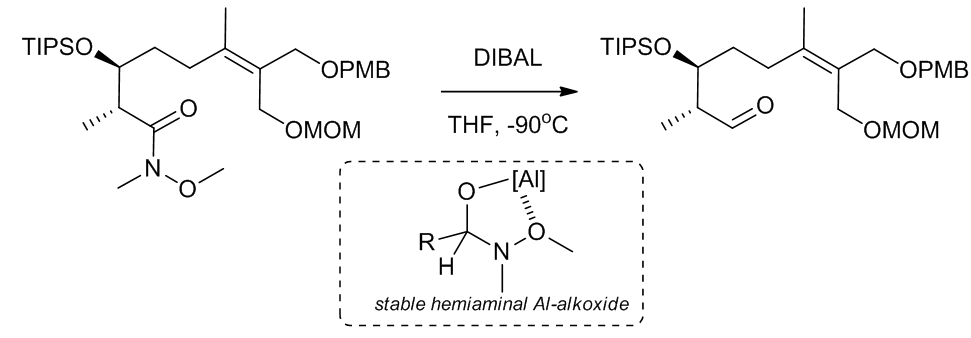
(11)在低温时,中间体非常稳定并且会形成稳定的螯合,之后活化才会得到产物10, 15
Scheme 14 | Unusual example of convert Weinreb amide to aldehyde by using DIBAL
以上的反应中,N-甲基-N-甲氧基酰胺参与了反应,这种酰胺也叫做Weinreb酰胺,这个反应可以很好的防止过度氧化反应的发生。
此外Weinreb酰胺可以通过醛得到14:
Scheme 15 | Weinreb酰胺
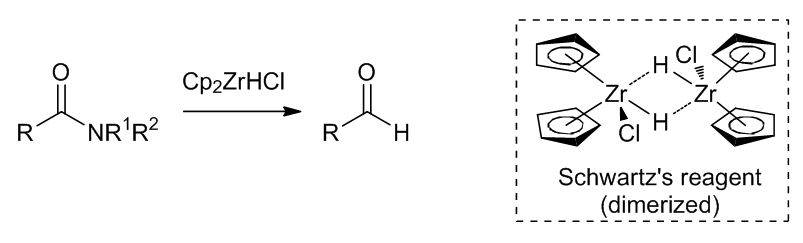
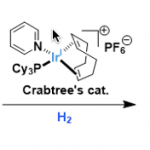
- Schwartz试剂11
Scheme 16 | Schwartz试剂的结构及其应用
Schwartz试剂可以很好的将酰胺还原成对应的醛,即使是在和酯共存的情况下也可以很好的发生反应;并且Schwartz试剂可以讲二级酰胺还原成烯胺。
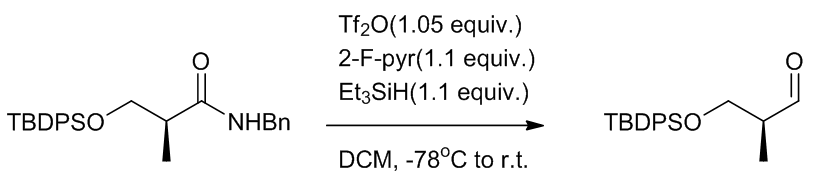
- Tf2O/硅烷还原12
Scheme 17 | N-活化/硅烷方法还原酰胺
这是一个没有金属参与的反应,反应的中间体是磺酸烯醇酯,之后经过不同的后处理可以得到不同的衍生物。
(12)酰胺得到醛12
Scheme 18 | 间接法还原酰胺
- 其他方法
Scheme 19 | Illustration of other methods to convert amindes and nitriles to aldehyde
LiAlH(OAc)3可以使得酰胺的还原停留在半酰胺烯醇盐的步骤,腈的还原也是如此,两者在后期活化即可得到醛。
此外还有钛试剂的还原13。
REFERENCES
- Am. Chem. Soc., 1991, 113 (23), pp 8791–8796, http://dx.doi.org/10.1021/ja00023a029
- Tetrahedron Lett., 1977 18 4171, http://dx.doi.org/1016/S0040-4039(01)83457-2
- Am. Chem. Soc., 2002, 124 (33), pp 9726–9728, http://dx.doi.org/10.1021/ja026600a
- Org. Chem., 1966, 31 (5), pp 1447–1451, http://dx.doi.org/10.1021/jo01343a030
- Am. Chem. Soc., 1984, 106 (12), pp 3539–3548, http://dx.doi.org/10.1021/ja00324a023
- Org. Chem., 1991, 56 (1), pp 417–420, http://dx.doi.org/ 10.1021/jo00001a076
- Synth. 1986, 64, 104, http://dx.doi.org/10.15227/orgsyn.064.0104
- Synth 1989 68 77, http://dx.doi.org/10.15227/orgsyn.68.77
- Lett., 2001, 3 (15), pp 2289–2291, http://dx.doi.org/ 10.1021/ol010089t
- Org. Chem., 1995, 60 (24), pp 7796–7814, http://dx.doi.org/ 10.1021/jo00129a021
- Am. Chem. Soc., 2000, 122 (48), pp 11995–11996, http://dx.doi.org/10.1021/ja002149g
- Am. Chem. Soc., 2010, 132 (37), pp 12817–12819, http://dx.doi.org/10.1021/ja105194s
- Chem. Int. Ed., 2010, 132, 12817, http://dx.doi.org/10.1002/anie.199615151
- Tetrahedron Lett., 2000 41 37, http://dx.doi.org/1016/S0040-4039(99)01818-3
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




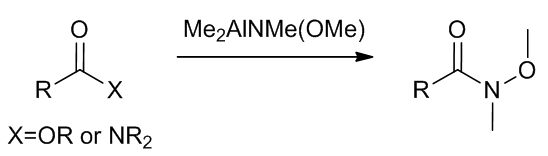

















No comments yet.