1,2,3-三唑或噻二唑可以通过1,3-偶极子的开环-闭环的平衡反应发生异构化得到。
基本文献
Review
- L’abbé, G. Bull. Soc. Chim. Belg. 1990, 99, 281–290. DOI: 10.1002/bscb.19900990410
- El Ashry, E. S. H.; El Kilany, Y.; Rashed, N.; Assafir, H. Advances in Heterocyclic Chemistry 1999, 75, 79–165. DOI: 10.1016/S0065-2725(08)60984-8
Dimroth 重排反应的概要与分类
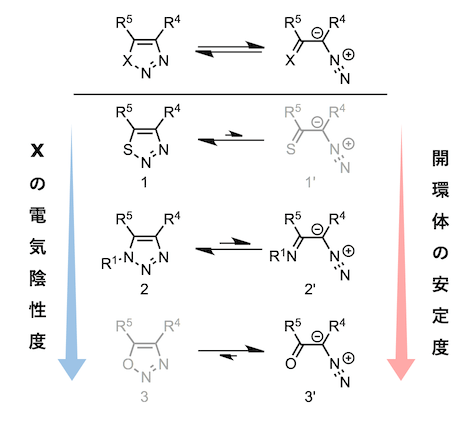
杂环化合物中的环中的杂原子和与环结合的杂原子的位置互换的异构化反应被统称为Dimroth重排反应。Dimroth重排可以从反应底物,反应类型和反应机理的角度分为几种类型,如下图所示[1,2]。
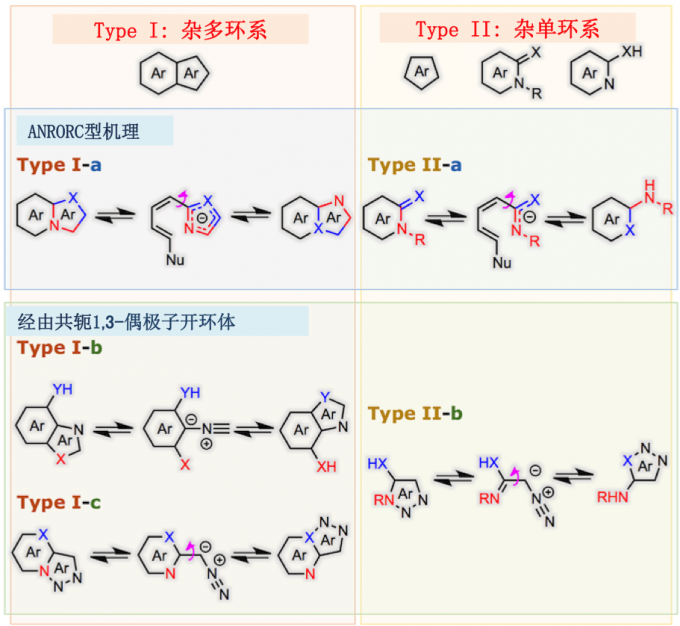
对于Dimroth 重排的分类与概要,请大家重点关注键的断裂与再生成上,在这里为了能够有助于大家理解,在分类上对于多键与氢的位置的严密性上并没有太计较。
这篇文章,叙述对象是经由共轭1,3-偶极子开环体的Dimroth重排反应。
反应机理
简要总结要点:“开环,翻转,闭环“。具体而言,(1)通过挤出亚胺类氮的孤电子对而开环、(2) 围绕单键自由旋转,接下来(3) 关环 这三个阶段组成。在Type I – b中,没有单键自由旋转这一步的情况下进行异构化。
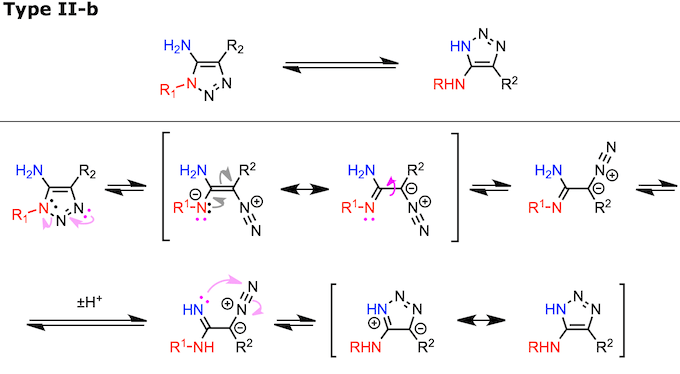
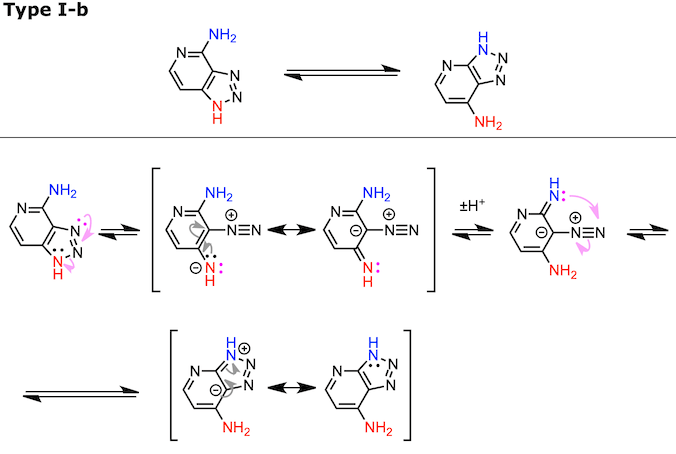
在上面的反应机理中,与π电子系统共轭的孤电子对是黑色的,与之正交的 sp2平面上的孤对电子对以粉红色显示。另外,淡粉色的弯曲箭头表示sp2平面上的电子移动 。 Type I-c 的反应机理与Type II-a 相同,因此在这里省略。
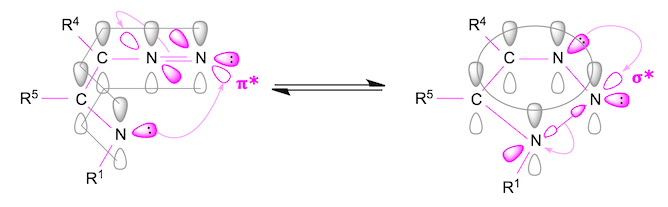
在开环和闭环中,正交于π共轭体系的孤对电子参与反应。关环时候分子轨道的模式图如下图所示[3]。开环体共轭1,3-偶极子中的各个原子,形成一个sp2平面。这个时候1,3-偶极子的一个 π 轨道与烯胺的氮的孤对电子对也排列在该 sp2 平面上。也就是说,孤对电子对”流入”π* 轨道形成σ 键。开环的情况,N3 原子的 sp2 轨道中的孤对电子对流入N1—N2 间的σ* 轨道,σ 键断裂。
底物
该反应在含有三个或更多个杂原子的唑类中是常见的。原因是这些唑类可以看作是共轭重氮化合物的闭环形式,并且可以存在开环 – 闭环平衡反应。该平衡,通常是趋向于更稳定的芳香环结构。但是,吸电子基团可以有助于稳定1,3-偶极子,从而促进开环。如,在以下唑类和重氮化合物中,X = S 的时候,几乎只存在关环体 1 、而当X = O 时候,几乎只存在开环体 3′ (α-重氮酮 )。当该原子变成电负性在S 原子与 O 原子中间的N原子时 (X = NR)、通常以关环体 2 的形式存在、然而当N 原子上的取代基 R是强吸电子的时候,开环侧得到促进,同时存在有开环体。
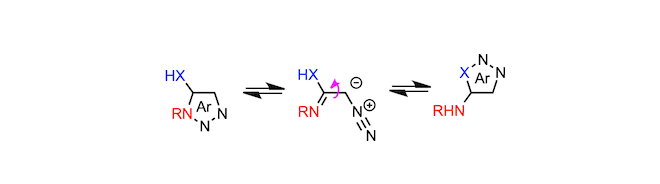
在这些开环体中,如果取代基存在于可以参与反应的位置,则在闭环时它们可以异构化为不同的唑。具体而言,5-氨基-1,2,3-三唑,缩合三唑等引起Dimroth重排是众所周知的。
影响反应的因子
多数 Dimroth 重排是可逆反应。这取决于芳香性与溶剂等因素。
(1) 电子效应
缺电子的唑类由于能够朝着开环方向进行,异构化成富电子的杂环化合物。例如,下图中的1,2,3-三唑并[4,5-c]吡啶硫酮进行Dimroth重排,异构成氨基-1,2,3-噻二唑并[4,5,-b]吡啶。这是因为氨基将电子给予吡啶而不是硫代羰基(或其互变异构体的硫烷基)。但是,当碱反应时,它会发生逆反应生成三唑化合物(具体请参阅下文中的溶剂效应)。

(2) 溶剂效应
吡啶等碱性溶剂可以使得Dimroth重排往生成酸性强的异构体方向进行。例如,下面的从N-芳基-1,2,3-三唑到NH-1,2,3-三唑的平衡在吡啶中是有利的。这是因为三唑的质子比氨基的质子具有更强的酸性。

反应实例

通过Dimroth重排和Smiles重排的组合,将2当量5-卤代-1,2,3-噻二唑和邻苯二胺经过三组分缩合一步形成四环式1,3,6-噻二氮杂4[4]。该合成包括以下六个过程: (1) 对5-卤代-1,2,3-噻二唑的SNAr进攻 、(2)通过 Dimroth重排从噻二唑重排为三唑(3) 硫醇部位对5-卤代-1,2,3-噻二唑的SNAr进攻、(4) Smiles 重排 (分子内 SNAr), (5) 通过Dimroth重排从噻二唑重排为三唑、(6) SH 基团之间的 SNAr反应,分子内环化。

参考文献
- El Ashry, E. S. H.; El Kilany, Y.; Rashed, N.; Assafir, H Advances in Heterocyclic Chemistry 1999, 75, 79–165. DOI: 10.1016/S0065-2725(08)60984-8
- Type II-a 与 Type II-b 是自命名,没有参考文献.
- L’abbé, G. Bull. Soc. Chim. Belg. 1990, 99, 281–290. DOI: 10.1002/bscb.19900990410
- Volkova, N. N.; Tarasov, E. V.; Meervelt, L. V.; Toppet, S.; Dehaen, W.; Bakulev, V. A. J. Chem. Soc., Perkin Trans. 1 2002, 1574–1580. DOI: 10.1039/b203072a
关联反应
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.