本文作者:杉杉
导读
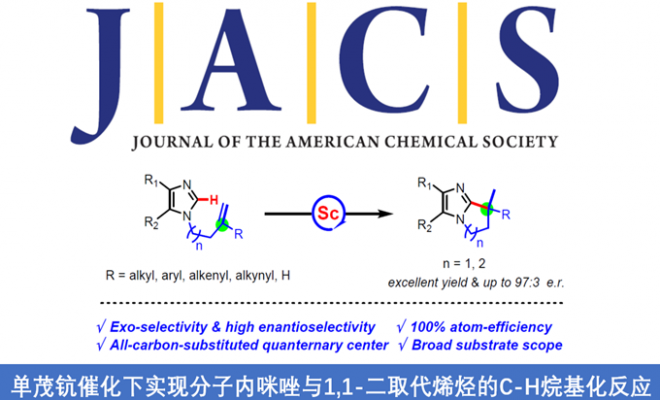
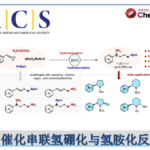
近日,日本理化研究所侯召民教授课题组在JACS发表论文,首次使用单茂钪催化剂,实现了分子内咪唑与1,1-二取代烯烃的C-H外环加成反应。带有1,1-二取代的脂肪族烯烃、苯乙烯、二烯和烯炔的咪唑化合物均可以高收率的转化为全碳四元立体中心双环咪唑衍生物。此外,使用手性单茂钪催化剂,可实现高对映选择性的不对称外环化反应。文章链接DOI:10.1021/jacs.9b12503
正文
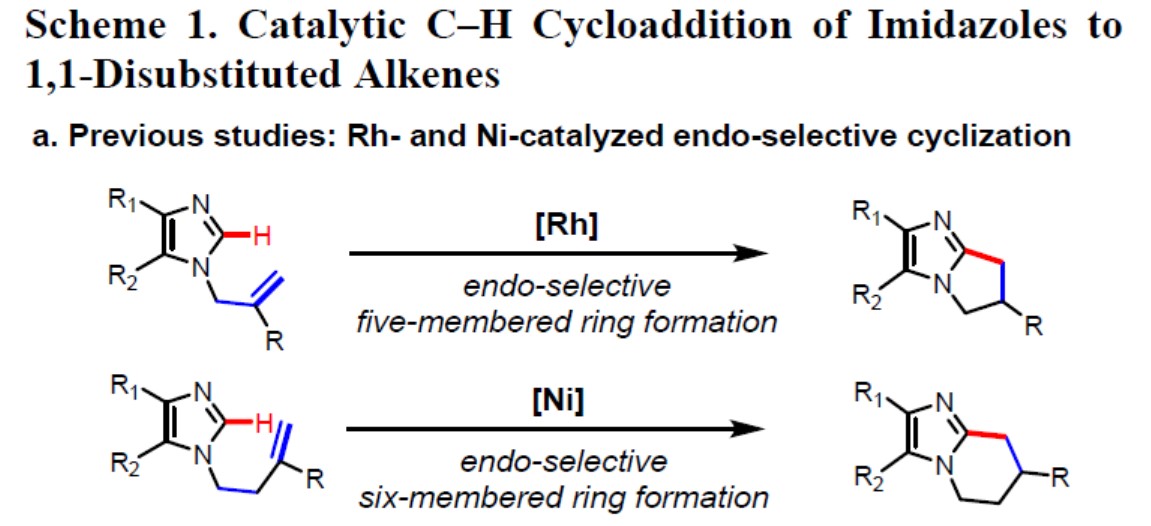
含有全碳四元立体中心的有机分子, 由于具有刚性三维结构,通常显示出独特的生物活性,因此,在过去的几十年中,高效构建全碳四元立体中心的骨架受到广泛的关注。此外,咪唑作为重要的杂环之一,具有广泛的生物学活性和临床应用。因此,合成具有全碳四元立体中心的咪唑化合物具有重要的意义。在已知的方法中,1,1-二取代烯烃上咪唑化合物经Markovnikov选择性C-H加成反应是合成此类骨架的高效方法。尽管在咪唑C-H活化方面已取得一些成果,但迄今为止,通过将咪唑与1,1-二取代的烯烃的C-H活化构建全碳四元立体中心尚未报道。据文献报道,Rh和Ni催化剂可以有效地促进咪唑与1,1-二取代烯烃的C-H环加成反应,但C-C键以内环化方式进行,未形成全碳四元立体中心结构(Scheme 1a)。
稀土催化已经成为C-H活化和功能化的强大方法。特别是单茂钪催化剂,经常在烯烃的C-H活化中表现出独特的活性以及区域和立体选择性。受上述的启发,作者设想,是否可以通过稀土催化剂催化烯烃的C-H活化构建全碳四元立体中心的骨架。在此,作者首次提出通过单茂钪催化剂,实现咪唑对1,1-二取代烯烃的C-H外环加成反应,构建5元或6元环全碳四元立体中心咪唑衍生物(Scheme 1b)。此外,通过使用手性单茂钪催化剂,以高对映选择性实现了不对称环化反应。
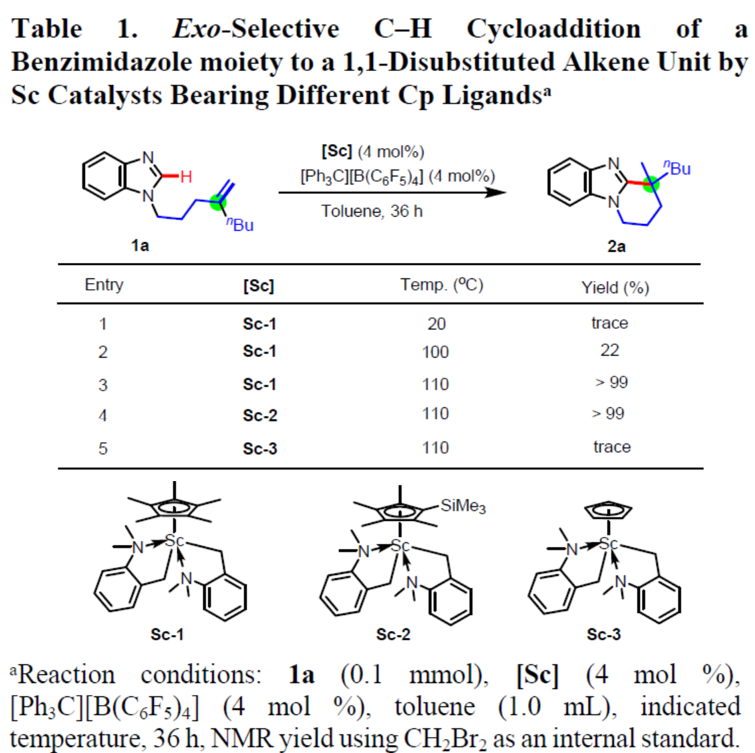
首先,作者以1a作为模型底物,进行了大量的条件筛选(Table 1)。当存在Sc-1(4 mol %)和[Ph3C][B(C6F5)4](4 mol %)在室温下反应36h,仅可获得痕量环化产物2a(Entry 1)。当反应温度升至100℃时,2a的产率增加至22%,而将温度进一步升高到至110℃,获得极高收率的2a(Entries 2-3)。值得注意的是,与之前报道的Rh和Ni催化反应形成了鲜明对比,后者均产生了内环化产物,而未形成全碳四元立体中心的结构(Scheme 1a)。此外,使用空间位阻大的Sc-2不会影响反应(Entry 4),而使用较小的Sc-3在相同条件下未获得目标产物(Entry 5)。
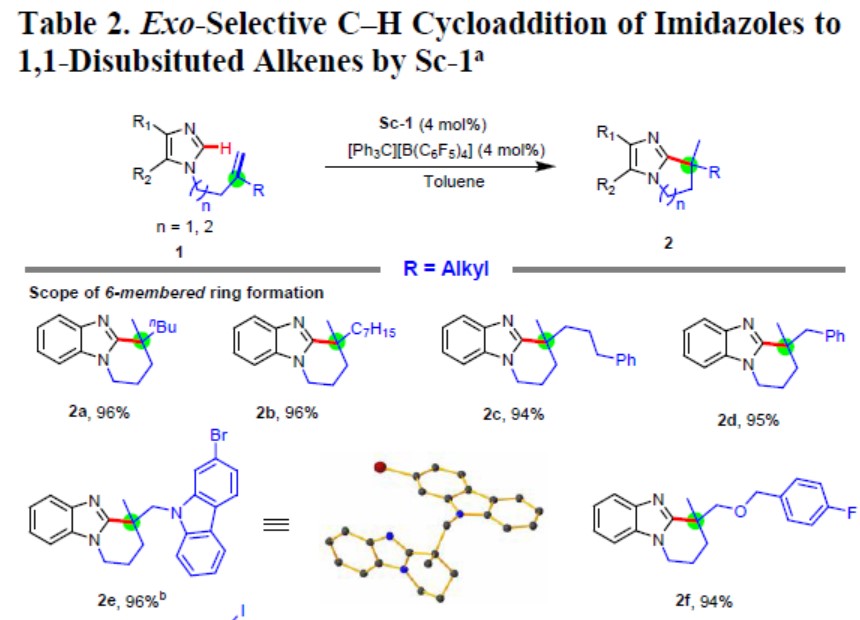
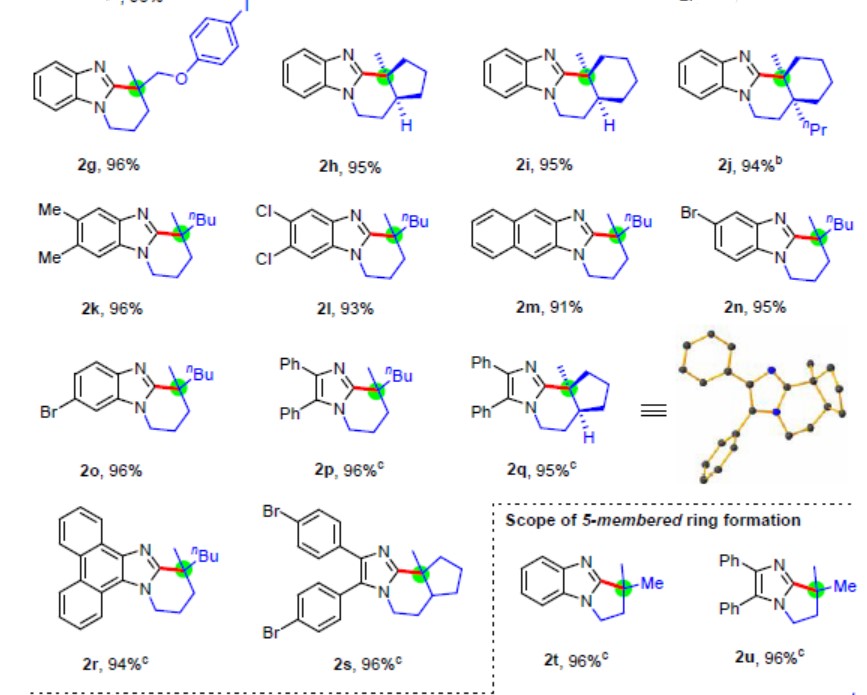
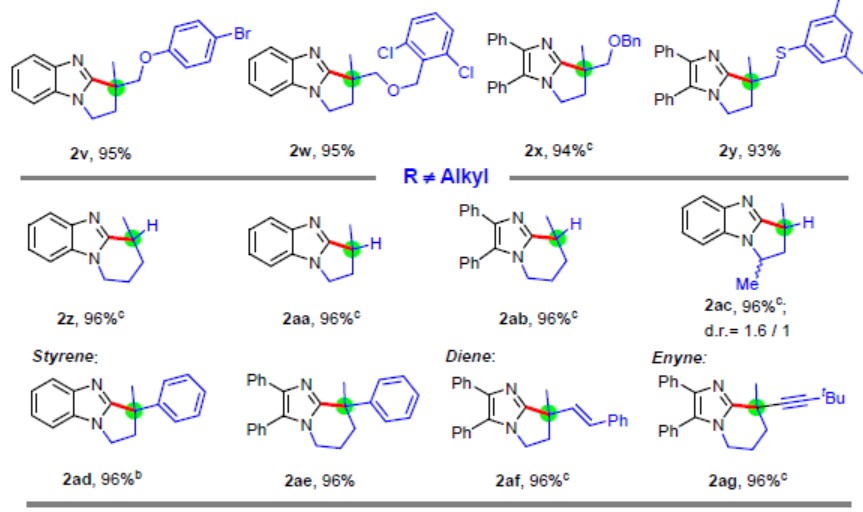
在获得上述最佳反应条件后,作者开始对咪唑底物1进行了扩展(Table 2)。各类1,1-二取代烯烃的苯并咪唑化合物都可进行外环化反应,获得极高收率的全碳四元立体中心苯并咪唑衍生物(2a–2j)。侧链中的杂原子(氧、氮和硫)不会阻碍反应(2e–2g和2v–2y),芳族卤化物(F,Cl,Br,I)也可与反应兼容获得相应的产物(2e–2g,2l,2n,2o,2s,2v和2w)。具有环外烯烃、连续的全碳四元中心的咪唑化合物,也可以优异收率形成了多环咪唑衍生物(2h,2i,2j)。除了苯并咪唑外,其他二取代咪唑和多环芳族咪唑的环化反应也可实现(2p–2s)。此外,还可以通过此方法获得相应的五元环产物(2t–2y),单取代末端烯烃产物(2z,2aa–2ac),1,1-二取代苯乙烯产物(2ad和2ae),烯基产物(2af)和炔基产物(2ag)等。
此外,具有三取代烯烃的咪唑底物3也可发生外环化反应,获得非甲基取代的全碳四元立体中心产物4(Scheme 2)。
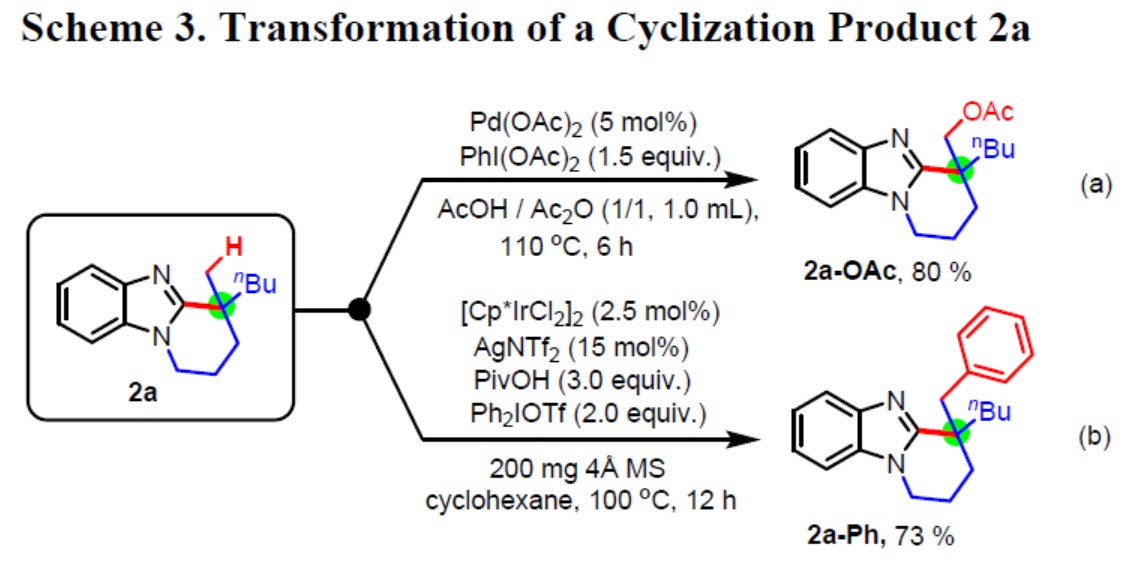
同时,在获得甲基取代的全碳四元立体中心产物后(以2a为例),作者试图将甲基的C(sp3)-H进行相关的官能化反应,如通过钯催化可实现2a中甲基的乙酰氧基化获得相应的乙酰氧基衍生物2a-OAc(Scheme 3,a),通过Ir催化可实现2a的C-H芳基化反应可获得相应的芳基化产物2a-Ph(Scheme 3, b)。这些结果表明,可通过过渡金属催化可实现环化产物中甲基C(sp3)-H官能化反应。
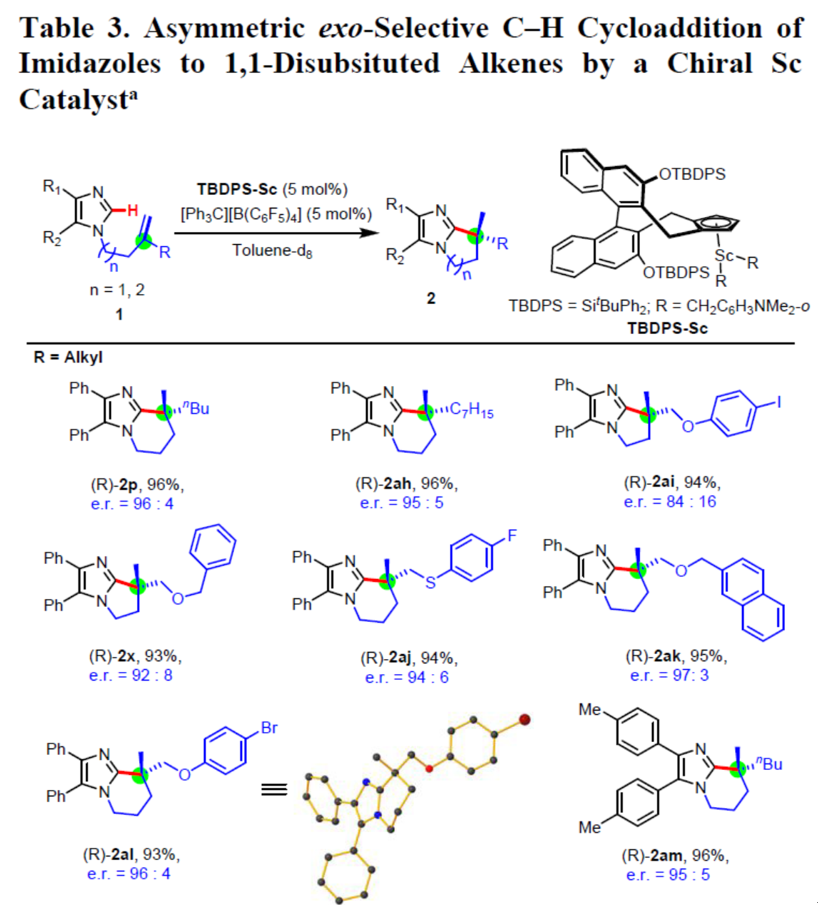
随后,作者开始研究手性单茂钪催化剂的不对称反应(Table 3)。反映结果表明,该反应通常在70℃下甲苯中进行,以高收率(92-96%)和高对映选择性(高达97:3 e.r.)获得手性全碳四元立体中心的双环咪唑衍生物。与非手性转化相似,氟、溴和碘官能团均可获得相应的产物((R)-2ai,(R)-2aj和(R)-2al)。侧链中的氧和硫原子没有影响五元环((R)-2ai,(R)-2x)和六元环(R)-2aj-2al)的对映选择性。同时,具有高度稠合的芳族环咪唑衍生物((R)-2r),单取代的末端烯烃咪唑衍生物((S)-2ab和(S)-2aq),一些带有苯基((R)-2ae)、炔基((R)-2ag)和烯基((R)-2ar)咪唑衍生物均可获得较好的结果。
为了进一步了解反应的机理,作者进行了相关的氘代实验(Scheme 4)。C2上含有氘的咪唑化合物1a-D在110℃下反应24h,获得21%收率的环化产物2a-D,(甲基上含有75%氘,C3-处含有5%氘)。同时在C3-位置还观察到未环化的苯并咪唑化合物(1a-D’)(Scheme 4, a)。这些结果表明去质子化可能发生在苯并咪唑1a的C2-和C3-位置。此外,将1a-D和4,5-二氯苯并咪唑化合物1l混合物在110℃加热下36h,获得在甲基和C3-位置含有氘的环化产物2a-D’和2l-D(Scheme 4, b)。
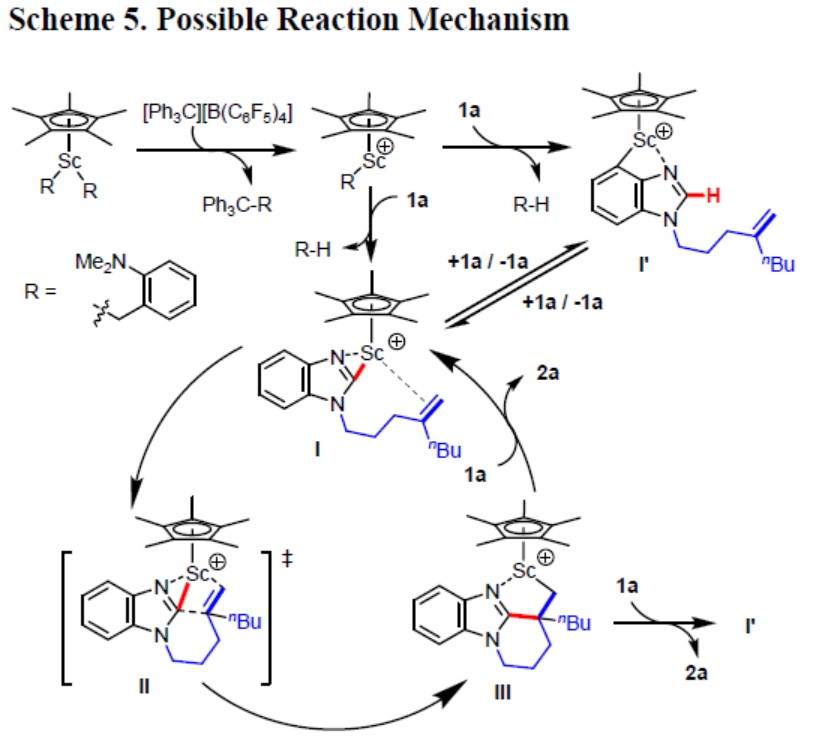
根据上述的实验和相关文献的查阅,作者提出了一种可能的反应机理(Figure 3)。Sc-R配合物去质子作用发生在1a的C2-或C3-位置,分别获得中间体I或I’(中间体I或I’可与1a进行相互转化)。随后,I中C=C向分子内插入(环化)获得中间体II,经Sc-咪唑键的断裂得到中间体III(该转化中同时受空间效应和电子效应的影响)。最后,III中的Sc-C键经抽氢反应,将释放2a并再生I或I’。
总结
日本理化研究所侯召民教授课题,首次使用单茂钪催化剂,实现了分子内咪唑与1,1-二取代烯烃的C-H外环加成反应,合成多种含有全碳四元立体中心的多环咪唑衍生物。该方法具有广泛的底物范围、优异的产率和100%的原子经济性等优点。通过使用手性单茂钪催化剂,还以高对映选择性实现了全碳四元立体中心的不对称合成。此外,通过Pd和Ir催化,可将生成的环化产物(如2a)中的甲基进一步进行C(sp3)-H官能化反应,从而使产物更加多样化。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



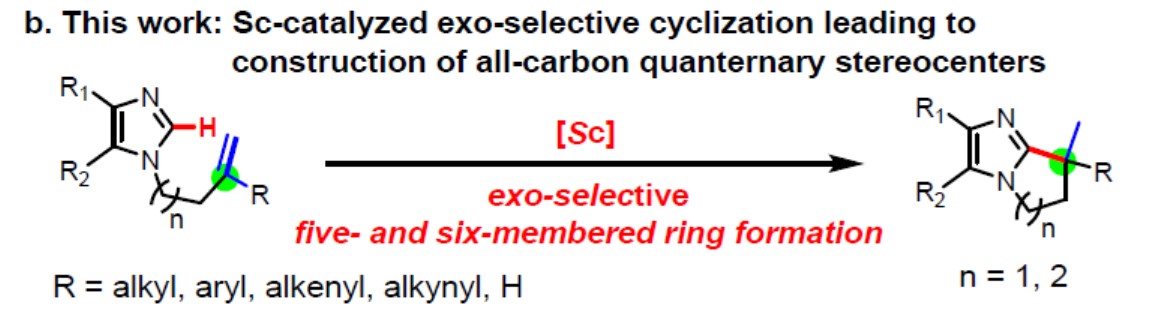






















No comments yet.