本文作者:杉杉
导读
近日,上海有机所梅天胜课题在德国应化发表论文,在无隔膜电解槽的条件下,通过镍催化电化学还原,实现芳基卤化物和烷基卤化物之间的偶联。该反应具有反应条件温和、底物范围广泛等优点,此外,该方案为合成1,1-二芳基烷烃衍生物提供了一种新型途径。
Nickel‐Catalyzed Electrochemical Reductive Relay Cross‐Coupling of Alkyl Halides to Aryl Halides
Ke-Jin Jiao Dong Liu Hong-Xing Ma Hui Qiu Ping Fang Tian-Sheng Mei*
Angew. Chem. Int. Ed. ASAP, DOI:10.1002/anie.201912753
正文
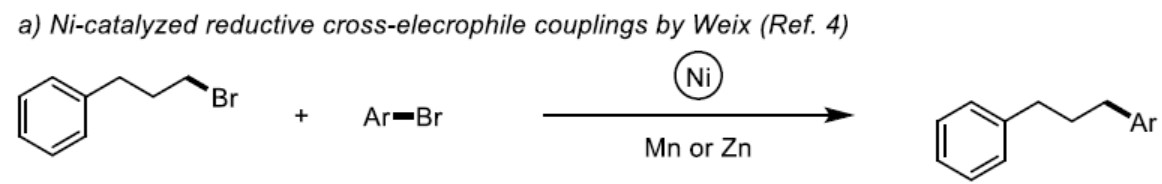
镍催化有机金属试剂和有机卤化物交叉偶联反应已成为构建C(sp2)-C(sp3)键的有效工具。最近,镍催化芳基与烷基亲电试剂之间还原交叉偶联反应(避免了有机金属试剂的使用)也被许多课题组研究。2010年,Weix及其同事报道,使用Mn作为还原剂,实现Ni催化下芳基卤化物与未活化烷基卤化物的交叉偶联(Scheme 1a)。受到这项开创性工作的启发,一些Ni催化的芳基卤化物和烷基卤化物之间的还原性交叉偶联反应已被大量报道。但是,这些反应常需金属还原剂(通常是Mn或Zn)来再生Ni催化剂。化学计量的金属添加剂的使用存在一些缺点:1)金属还原剂(通常是粉末)需要表面活化;2)反应性可能取决于金属粉末的来源;3)一些官能团容易与Zn或Mn反应。为了避免此类问题,有机或无机还原剂和光氧化还原催化已作为流行策略。此外,镍催化的电化学还原偶联(电流用于翻转Ni催化)也作为解决此类难题的有效方案。然而,除了电催化作用,由于在交叉与自偶联产物的选择性困难,芳基卤化物和未活化的烷基卤化物的还原性交叉偶联仍具有挑战性。最近,Hansen及其同事报道,使用dmbpy或脒类作为配体,其中Zn为牺牲阳极,实现了镍催化的芳基溴化物和未活化的烷基溴化物的电化学交叉偶联。但是,据作者所知,镍催化电化学还原进而实现芳基溴化物和烷基溴化物交叉偶联反应尚未被报道,同时通过此方案可以合成多种1,1-二芳基烷烃衍生物,该类结构骨架广泛存在于天然产物和生物活性化合物中。
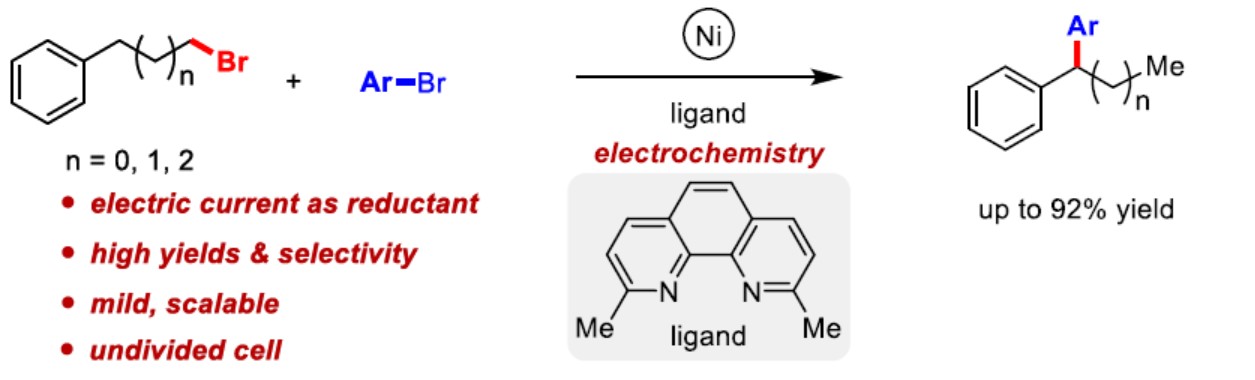
在这里,作者首次报道镍催化电化学还原,实现芳基卤化物和烷基卤化物的偶联,获得高选择性和高收率的1,1-二芳基烷烃衍生物(Scheme 1b)。由于该反应存在多种可能的副反应,包括路径a、b和c,因此,这种预想方案具有巨大的挑战性(Scheme 1c)。
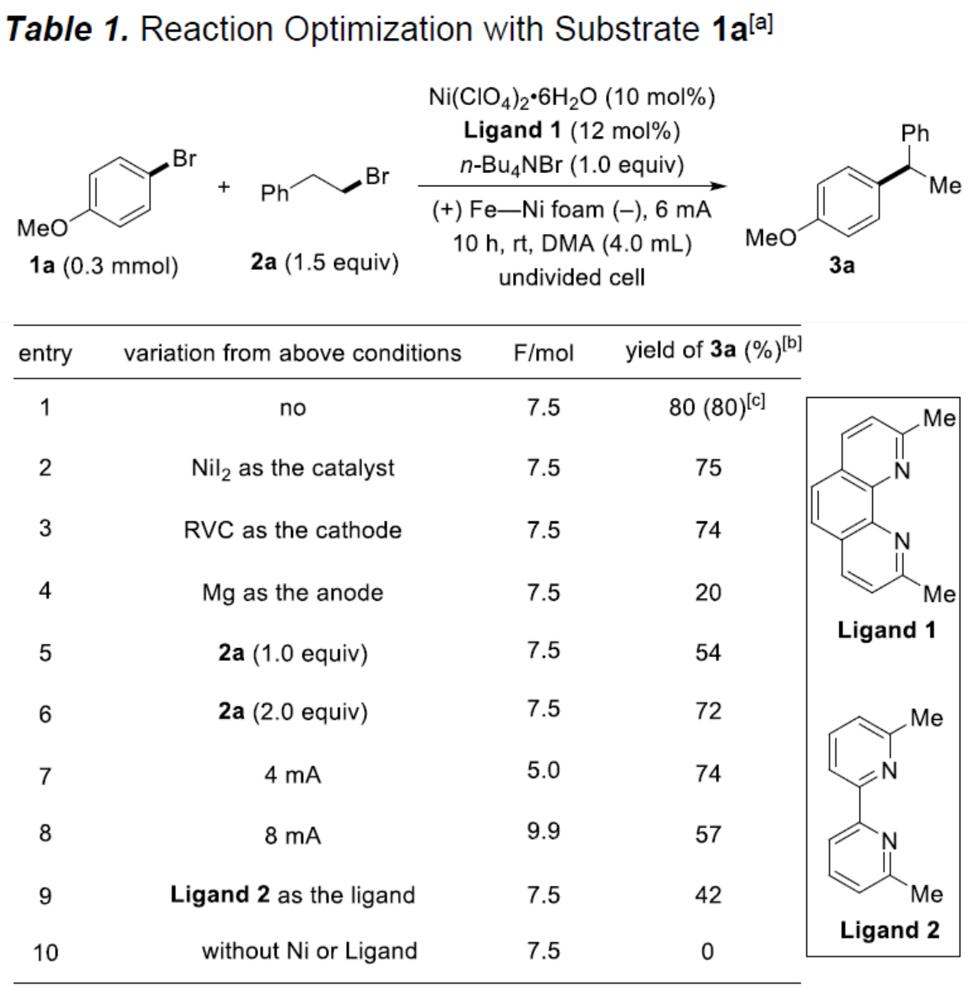
首先,作者使用4-溴苯甲醚(1a)和2-溴乙基苯(2a)作为模型底物,进行反应条件的筛选。令作者高兴的是,使用Ni(ClO4)2•6H2O作为预催化剂、2,9-二甲基-1,10-菲咯啉(Ligand 1)作为配体、n-Bu4NBr作为电解质、N,N-二甲基乙酰胺(DMA)作为溶剂,在室温下条件下,在铁和镍为电极的电解池中以6 mA电流下持续10h,获得80%收率偶联产物(Table 1, entry 1)。使用NiI2作为催化剂会导致产率略低(entry 2),使用网状玻璃碳(RVC)代替泡沫镍作为阴极时,产率降低到74%(entry 3)。此外,当用镁代替铁作为牺牲阳极时,反应效率急剧下降(entry 4),增加或减少2a的量也会降低产率(entries 5-6),当电流达到4 mA或8 mA时同样获得了类似的结果(entries 7-8)。值得注意的是,配体L1和L2上的甲基对于反应至关重要(entry 9),此外,对照实验表明在不存在催化剂或配体的情况下没有产生偶联产物(entry 10)。
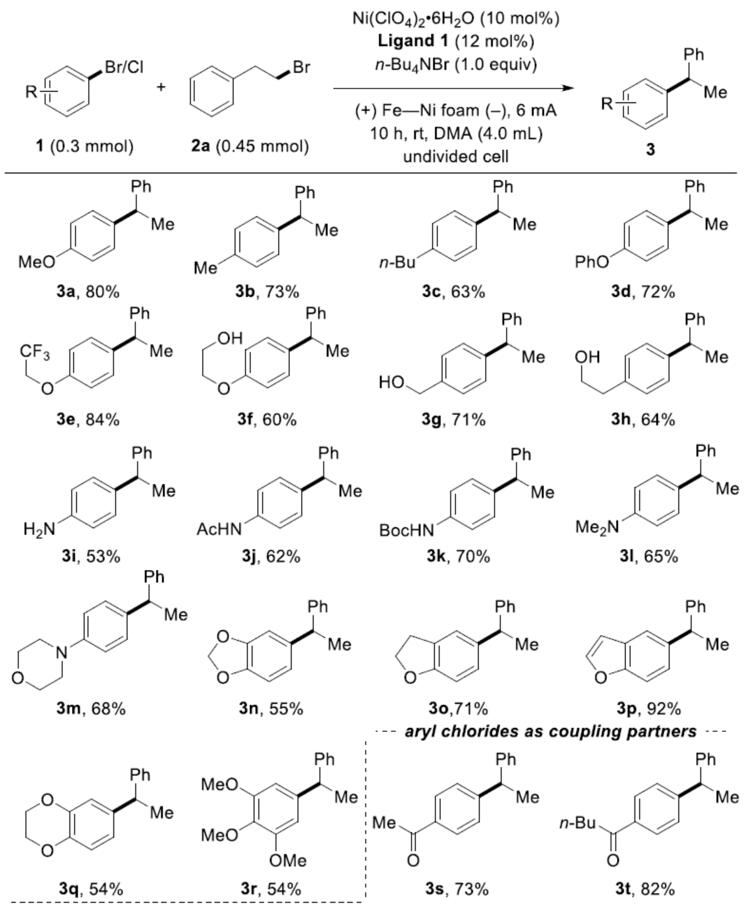
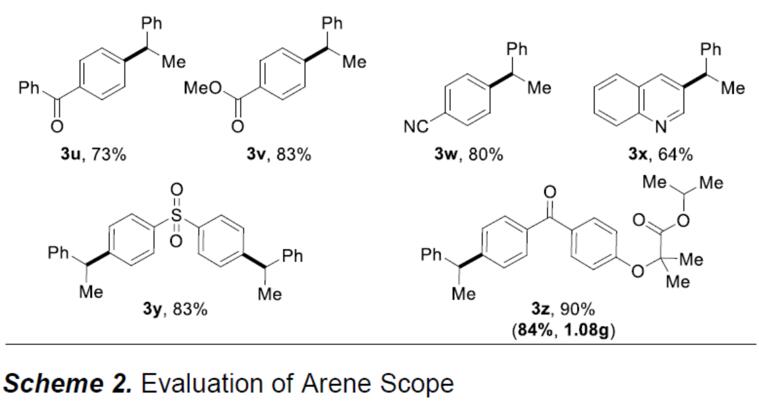
在获得上述最佳反应条件后,作者开始对底物进行了扩展(Scheme 2)。首先作者研究底物1的适用范围,反应结果表明,该催化体系表现出良好的官能团适用性。各种官能团取代芳烃,如烷基、醚、三氟甲基和烯基均可获得相应的偶联产物(3a–3e,3p)。对于那些带有活性基团的底物(如羟基、氨基或受保护的氨基),反应同样可以顺利进行(3f–3l),带有吗啉取代基也取得较好的结果(3m)。此外,对于二或三取代的芳烃,反应也取得较好的结果(3n–3r)。而将溴代芳基底物改为氯代芳基底物时,还原交叉偶联反应依旧可以进行。所述底物上的乙酰基、酯基、腈基和磺酰基基团均提供较高产率的偶联产物(3s–3w,3y),喹啉也具有良好的耐受性(3x)。市售药物(如非诺贝特),用于治疗或预防心血管疾病的药物,可顺利参与电化学还原偶联反应,通过0.3 mmol和3.0 mmol的实验结果,均可获得优异的收率的产物3z,从而证明了该方案的实用性。然而遗憾的是,富电子的芳基氯化物不是有效的底物(如氯苯甲醚)。
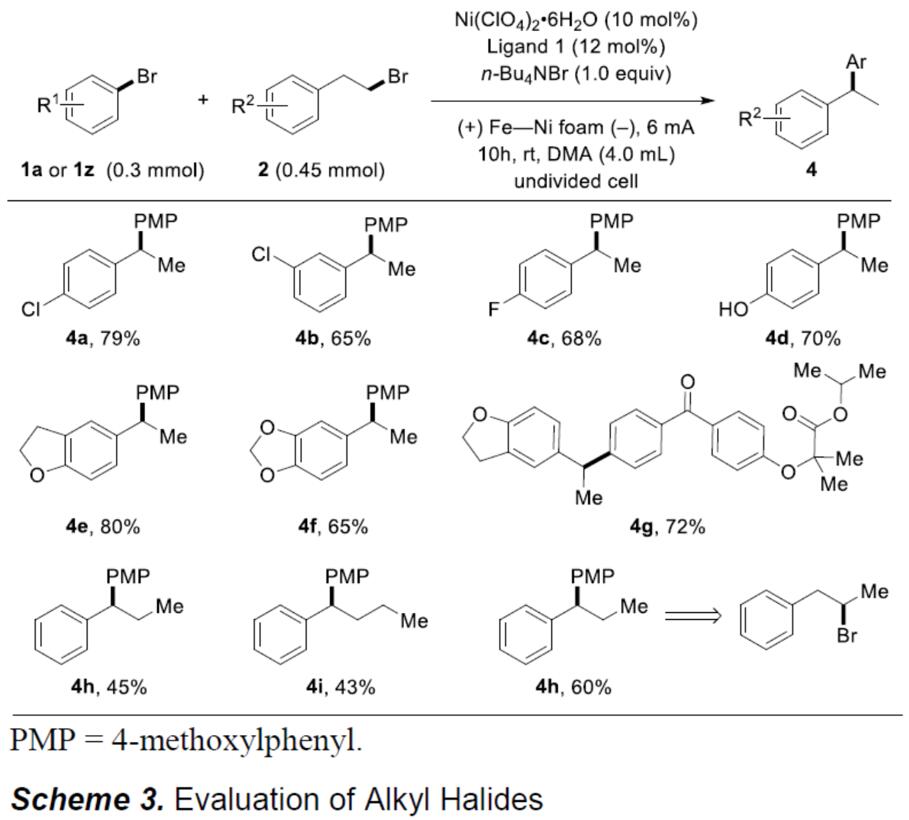
接下来,作者开始对溴代烷基底物2的范围进行了研究(Scheme 3)。反应结果表明,溴代烷基底物被各种官能团,例如氯、氟、醚和羟基等,在标准反应条件,均可获得相应的偶联产物(4a–4g)。而当使用三或四个碳链时,反应依旧可以进行,但收率略有降低(4h、4i)。此外,在标准条件下,即使溴代仲烷基也与体系兼容,获得令人满意的4h偶联产物。
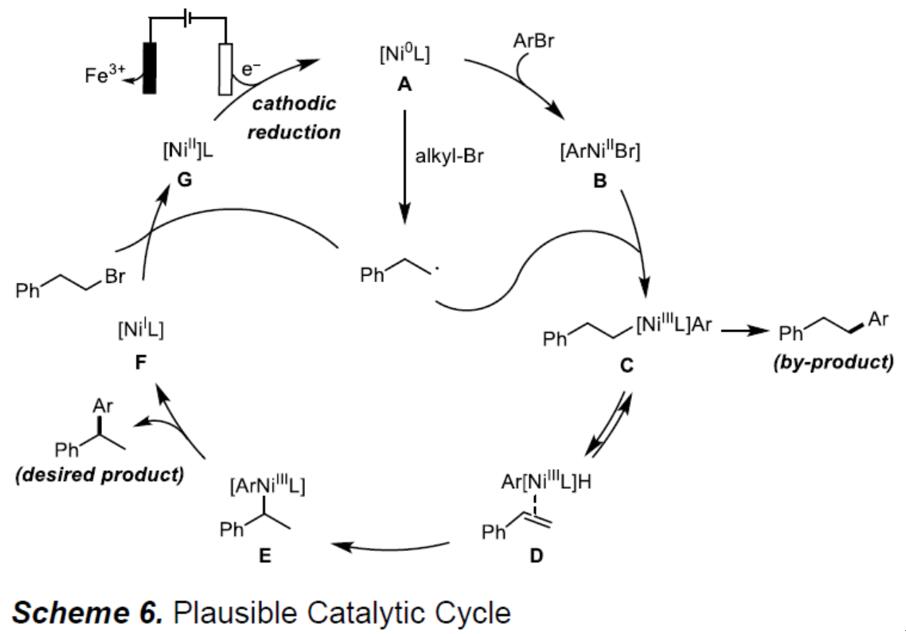
基于文献报道和相关力学研究,作者提出了一种合理的催化机理(Scheme 6)。首先,通过阴极还原将Ni(II)催化剂还原为Ni(0)(A)。然后,将芳基溴化物氧化加成到Ni(0)之后,形成芳基Ni(II)物种(B),该物种可以与烷基自由基反应生成Ni(III)物种(C)。C若直接还原消除则生成副产物,而实际反应中,通过多个β-消除/重新插入步骤获得热力学更稳定的苄基Ni(III)中间体(E)。最后,通过还原消除,形成所需的交叉偶联产物和Ni(I)物质(F),F再通过单电子转移和阴极还原,可再生活性Ni(0)。
总结
上海有机所梅天胜课题在德国应化发表论文,报道了在无隔膜电解槽的条件下,通过镍催化电化学还原,实现芳基卤化物和烷基卤化物之间的偶联反应(此类反应的第一个例子),同时获得高收率和高区域选择性的1,1-二芳基烷烃衍生物(作为合成该类产物的一种新型途径)。该反应具有反应条件温和、底物范围广等优点。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!























No comments yet.