概要
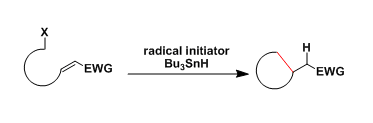
由卤素(或硫族化合物)和自由基引发剂产生的碳自由基具有亲核性。当分子中的适当位置存在有α,β-不饱和羰基化合物,烯烃,炔烃时,引起环化反应产生环化产物。
特别是合成卤代乙缩醛然后进行自由基环化的方法被称为上野 – 鹳环化(Ueno-Stork cyclization)。
基本文献
- Ueno, Y.; Chino, K.; Watanabe, M.; Moriya, O.; Okawara, M. J. Am. Chem. Soc.1982, 104, 5564. DOI: 10.1021/ja00384a082
- Stork, G.; Mook, R.Jr.; Biller, S. A.; Rychnovsky, S. A. J. Am. Chem. Soc. 1983, 105, 3741. DOI: 10.1021/ja00349a082
<review>
- Salom-Roig, X. J.; Denes, F.; Renaud, P. Synthesis 2004, 1903. DOI: 10.1055/s-2004-831161
- Rowland, G. J. Tetrahedron 2009, 65, 8603. doi:10.1016/j.tet.2009.07.001
- Rowland, G. J. Tetrahedron 2010, 66, 1593. doi:10.1016/j.tet.2009.12.023
反应机理
由于许多碳自由基具有亲核性,所以倾向于与缺电子烯烃发生自由基环化反应。
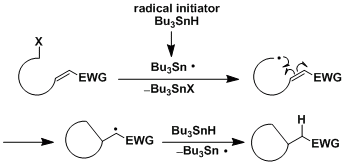
5-exo环化反应大致是6-endo环化的5倍、基本上是选择性的以5-exo进行环化。
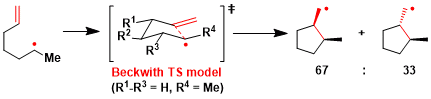
关于5-exo环化的立体选择性来说、可以用Beckwith模型进行说明。但是有极性官能团或者杂原子取代的时候常常不适用。(参考:Aust. J. Chem. 1983, 36, 545.)
反应实例
在比较拥挤的位置引入碳 – 碳键。
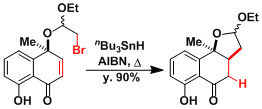
12a-deoxytetracycline的合成[1]: Ueno-Stork环化。
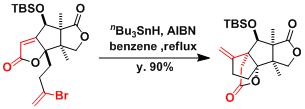
Merrilactone A的合成[2]
Merrilactone A的合成[3]
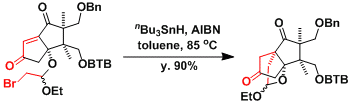
Salinosporamide的合成[4]

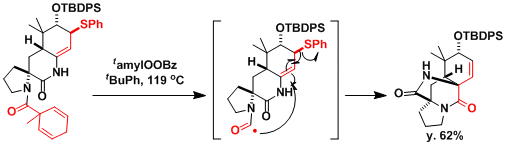
Stephacidin B的合成[5]:反应路线中运用了Jackson等人开发酰基自由基前体[6]。
(-)-Cyanthiwigin F的全合成[7]:醛和烯烃之间的自由基环化是关键反应。反应的立体选择性非常好。

通过串联环化可以一次构建多个环。[9]
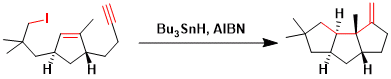
实验步骤
实验技巧
自由基引发剂常常使用的有:BzOOBz、AIBN、Et3B/O2等。特别是使用Et3B/O2的时候、可以在低温条件下生成自由基,所以对复杂化合物的合成是非常实用的。VA-061(半衰期温度61℃)与VA-044(半衰期温度44℃)等水溶性自由基引发剂也是近年来比较受关注的。
参考文献
[1] Stork, G.; La Clair, J. J.; Spargo, P.; Nargund, R. P.; Totah, N.. J. Am. Chem. Soc.1996, 118, 5304.DOI: 10.1021/ja960434n[2] (a) Birman, V. B.; Danishefsky, S. J. J. Am. Chem. Soc. 2002, 124, 2080.DOI: 10.1021/ja012495d (b) Meng, Z.; Danishefsky, S. J. Angew. Chem. Int. Ed. 2005, 44, 1511. doi:10.1002/anie.200462509
[3] (a) Inoue, M.; Sato, T.; Hirama, M. J. Am. Chem. Soc. 2003, 125, 10772. DOI: 10.1021/ja036587+ (b) Inoue, M.; Sato, T.; Hirama, M. Angew. Chem. Int. Ed. 2006, 45, 4843. doi:10.1002/anie.200601358 (c) Inoue, M.; Lee, N.; Kasuya, S.; Sato, T.; Hirama, M.; Moriyama, M.; Fukuyama, Y. J. Org. Chem. 2007, 72, 3065. DOI: 10.1021/jo0700474
[4] Corey, E. J. et al. J. Am. Chem. Soc. 2004, 126, 6230. DOI: 10.1021/ja048613p
[5] Herzon, S. B.; Myers, A. G. J. Am. Chem. Soc. 2005, 127, 5342. DOI: 10.1021/ja0510616
[6] (a)Jacson, L. V.; Walton, J. C. Chem. Commun. 2000, 2327. DOI: 10.1039/b007454n (b) Bella, A. F.; Jacson, L. V.; Walton, J. C.Org. Biomol. Chem. 2004, 2, 421. DOI: 10.1039/b313932h
[7] Enquist, J. A.; Stoltz, B. M. Nature 2008, 453, 1228. doi:10.1038/nature07046
[8] Yoshikai, K.; Hayama, T.; Nishimura, K.; Yamada, K.; Tomioka, K. J. Org. Chem.2005, 70, 681. DOI: 10.1021/jo048275a
[9] Curran, D. P; Chen, M.-H. Tetrahedron Lett. 1985, 26, 4991. doi:10.1016/S0040-4039(01)80834-0
相关反应(本网站)
- Baldwin’s Rule
- Barton Decarboxylation
- Keck Allylation
- Barton-McCombie Deoxygenation
- Masamune-Bergman Reaction
- Fukuyama Indole Synthesis
关联书籍(日亚价格)
Advanced Free Radical Reactions for Organic Synthesis
- 著者Hideo Togo
- 参考価格¥ 36,636
価格¥ 12,091(2017/12/28 02:27時点) - 出版日2004/01/28
- 商品ランキング1,394,889位
- ハードカバー270ページ
- ISBN-100080443745
- ISBN-139780080443744
- 出版社Elsevier Science
外部链接
・Radical Cyclization – Wikipedia
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.