作者:杉杉
导读:
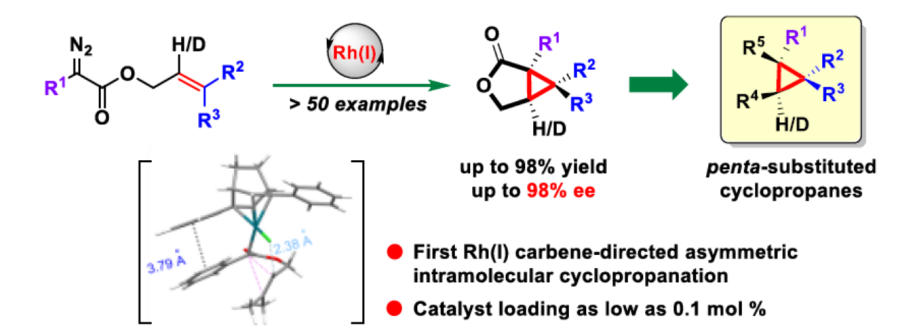
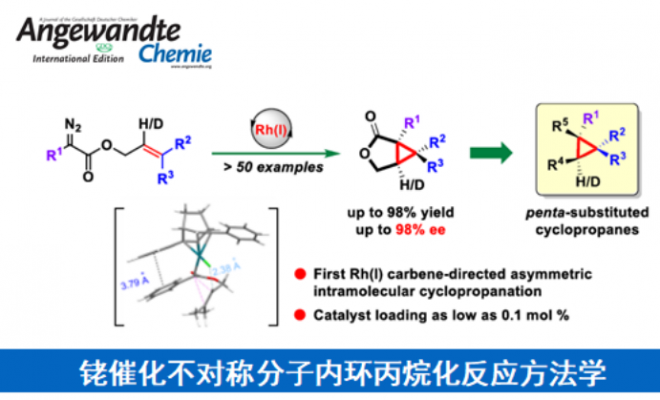
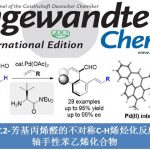
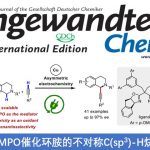
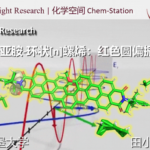
近日,南方科技大学的徐明华课题组在Angew. Chem. Int. Ed.中发表论文,报道了一种全新的铑(I)/手性双烯催化的三取代烯丙基重氮乙酸酯(allylic diazoacetates)的不对称分子内环丙烷化反应方法学,成功实现了一系列具有连续3个立体中心的五取代环丙烷分子的构建。
Low Coordination State Rh(I)-Complex as High Performance Catalyst for Asymmetric Intramolecular Cyclopropanation: Construction of penta-Substituted Cyclopropanes
J.Zhang, W.Xu, M.-H. Xu, Angew. Chem. Int. Ed. 2023, ASAP. doi: 10.1002/anie.202216799
正文:
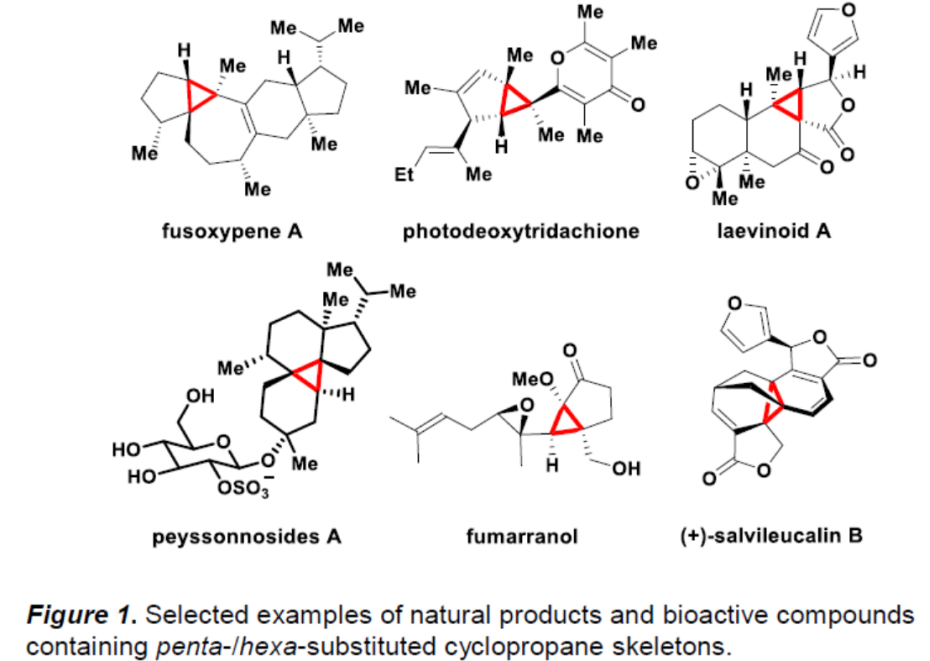
与常见的三或四取代环丙烷一样,五或六取代的环丙烷骨架也广泛存在于各类天然产物以及生物活性分子中(Figure 1)。然而,对于五或六取代的环丙烷骨架的催化不对称反应方法学,目前却很少有相关成功的研究报道[1,2]。
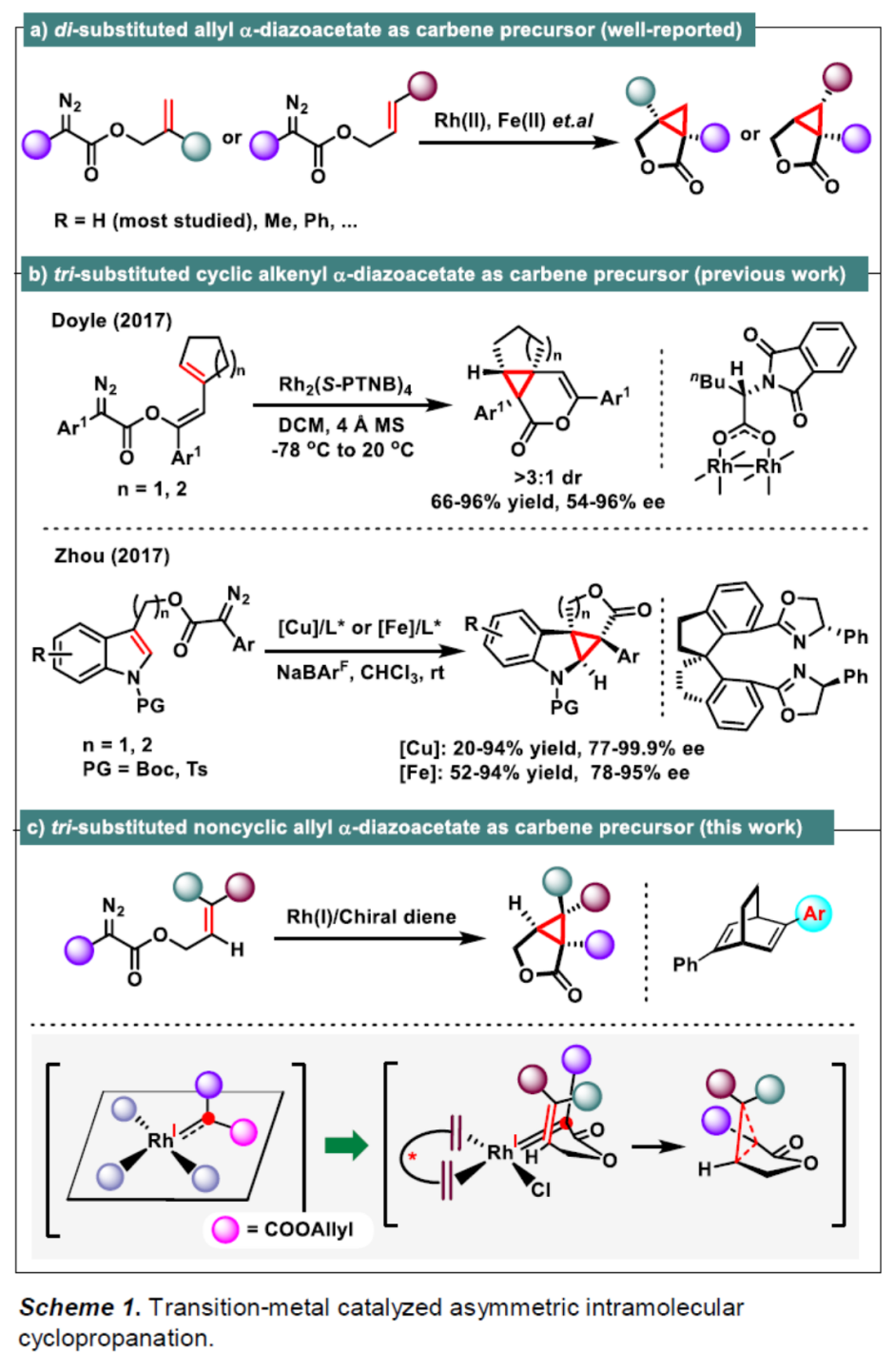
近年来,过渡金属催化的二取代烯丙基重氮乙酸酯作为卡宾前体的分子内不对称环丙烷化反应研究有很多成功的报道[3,4](Scheme 1a),但是三取代烯基重氮乙酸酯作为卡宾前体的研究却很少,文献报道的取得较好结果的仅有两例双键在环内的特殊结构重氮底物的分子内不对称环丙烷化反应[5,6](Scheme 1b)。基于课题组在Rh(I)-卡宾化学研究工作的积累[7-9],南方科技大学的徐明华教授团队报道了一种全新的铑(I)/手性双烯催化的三取代烯丙基重氮乙酸酯衍生物(作为卡宾前体)的不对称分子内环丙烷化方法,成功实现了一系列具有3个连续立体中心的五取代环丙烷分子的构建 (Scheme 1c)。
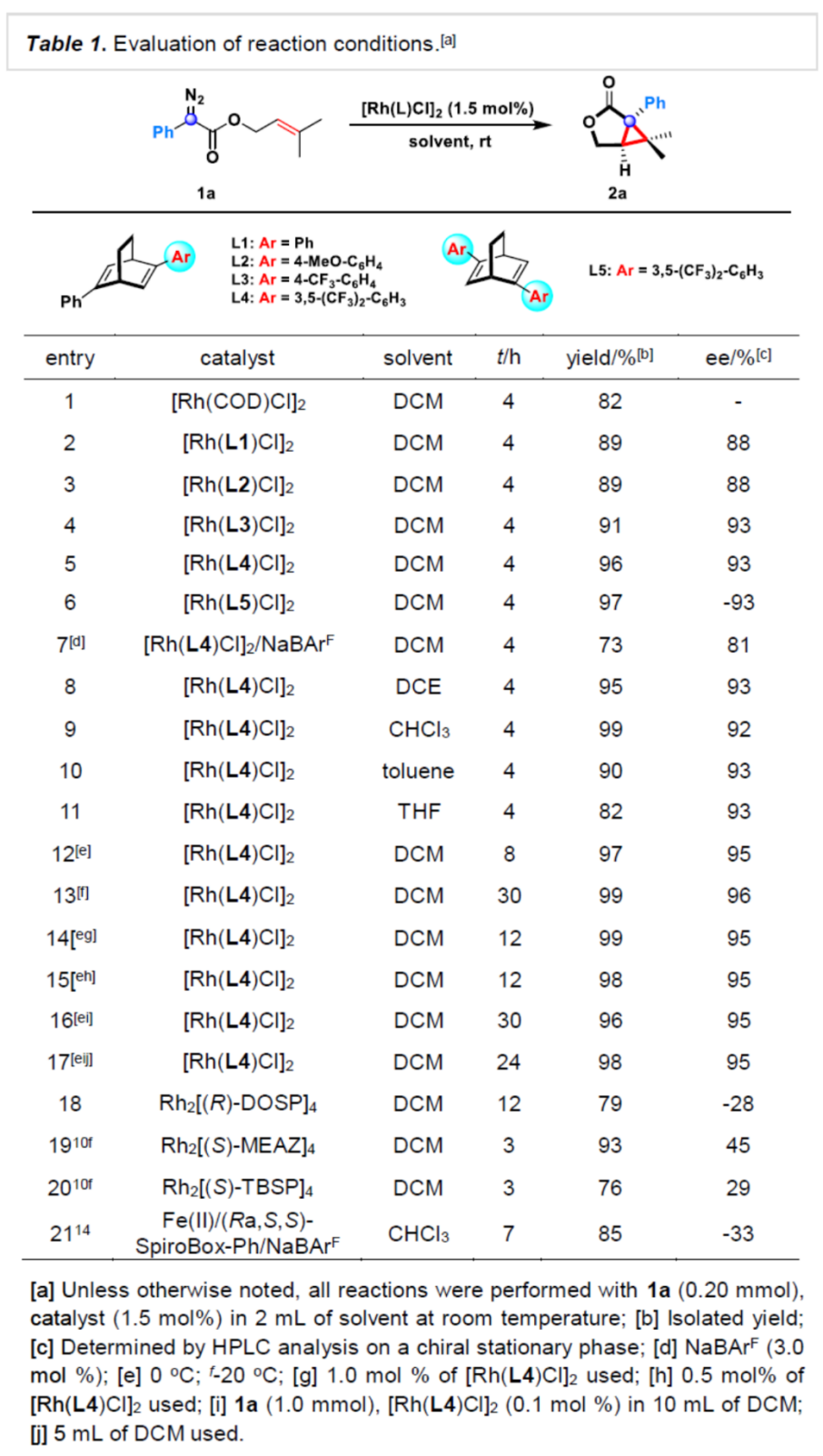
首先,作者采用末端二甲基取代烯丙基α-苯基重氮乙酸酯(1a)作为模型底物,进行相关反应条件的优化筛选(Table 1)。进而确定最佳的反应条件为:采用[Rh(L4)Cl]2作为催化剂,在DCM反应溶剂中,反应温度为0oC,最终获得99%收率的产物2a(95% ee)。
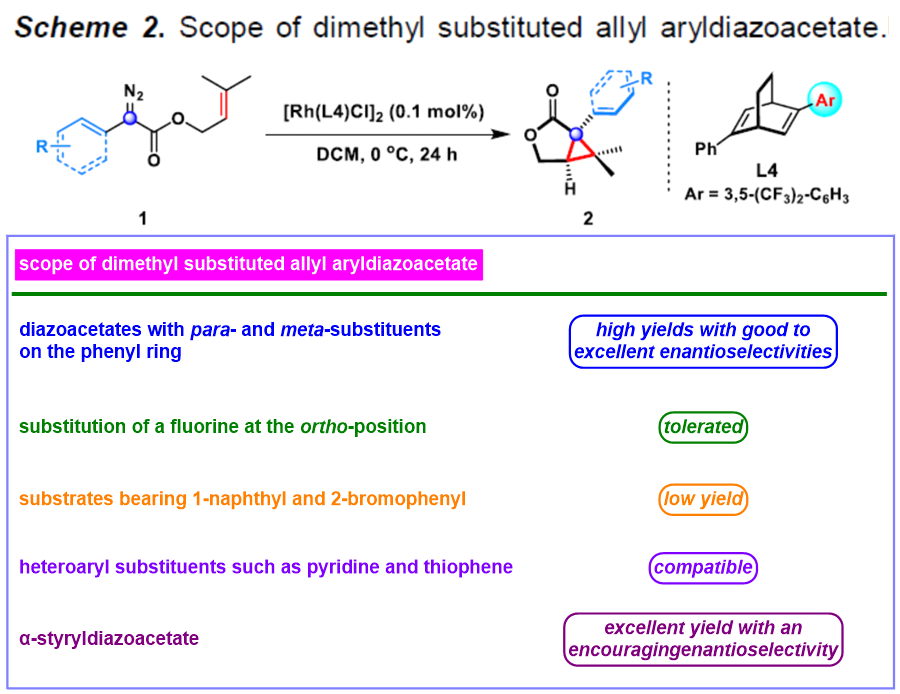
在上述的最佳反应条件下,作者首先对一系列末端二甲基取代烯丙基芳基重氮乙酸酯1的底物(Scheme 2)应用范围进行深入研究。
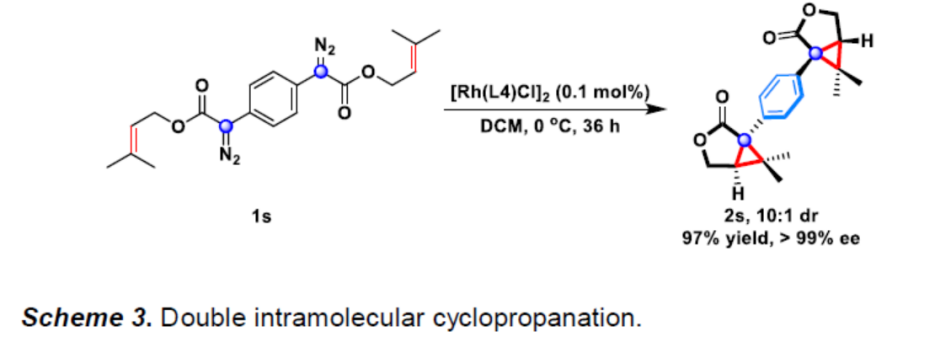
同时,当以1,4-双(烯丙基苯基重氮乙酸酯)1s作为底物时,在标准条件下还可进行立体选择性双重分子内环丙烷化反应,获得含有双(五取代环丙烷)的产物2s,收率为97%,dr为10:1,ee>99%(Scheme 3)。
紧接着,作者对一系列三/二取代烯丙基2-重氮基-3-芳基乙酸酯3的底物(Scheme 4)的应用范围进行深入研究。

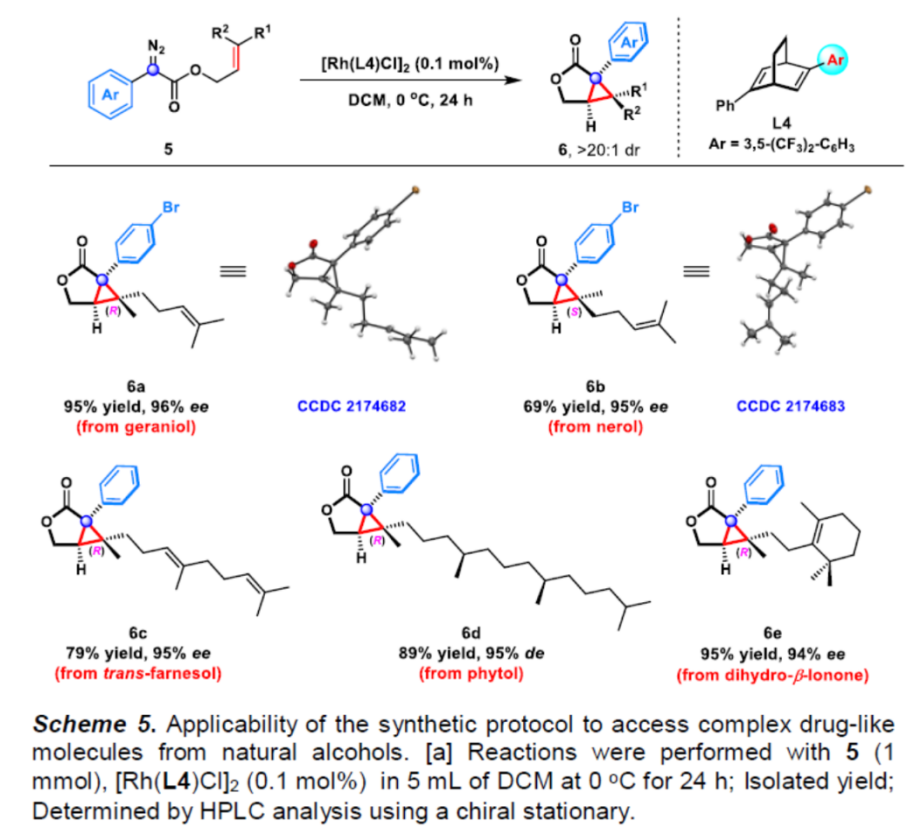
之后,该小组通过如下的一系列研究进一步表明,这一全新的不对称分子内环丙烷化反应方法具有潜在的合成应用价值(Scheme 5与Scheme 6)。
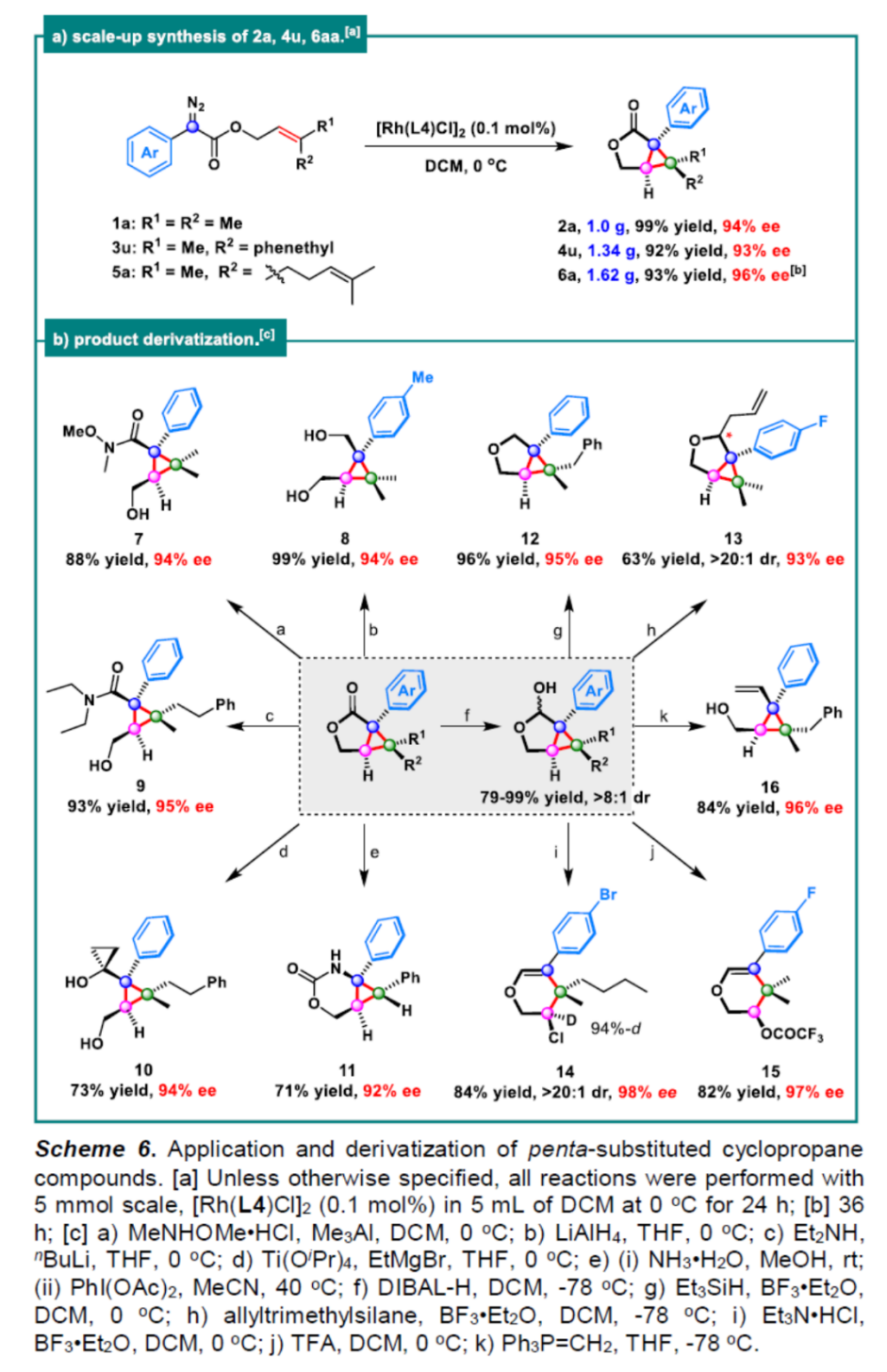
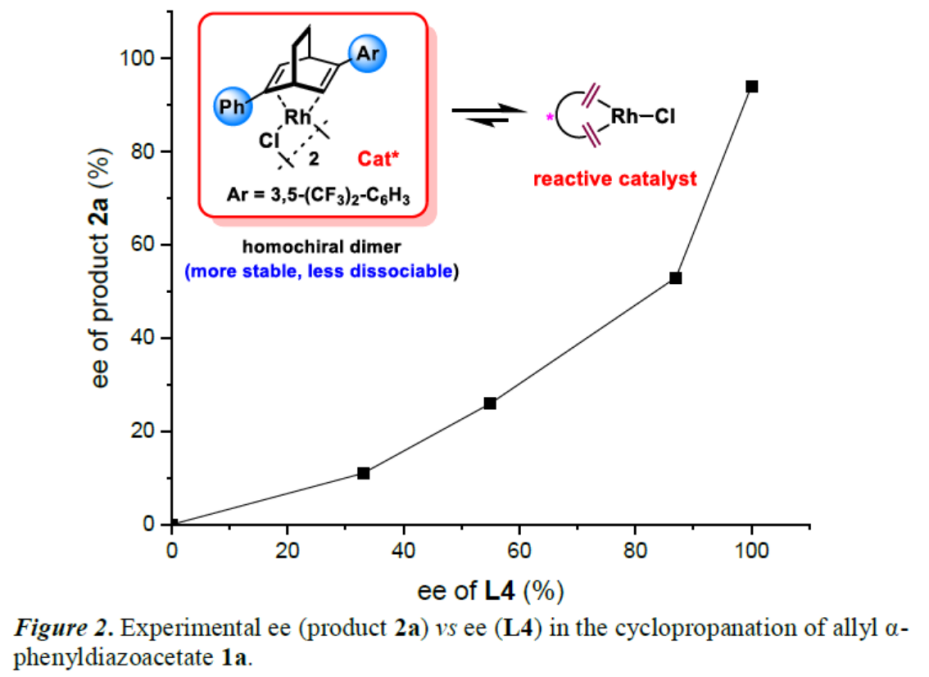
由于反应中使用了双(铑(I)/双烯)配合物,该小组还研究了二聚体在反应条件下解离成活性单体时的动力学。当以L4为配体,α-苯基重氮乙酸酯1a为底物,通过对产物2a的ee值与L4的ee对比,观察到了非线性效应,从而表明异手性(heterochiral)二聚体不如同手性(homochiral)二聚体稳定,更容易发生解离(Figure 2)。
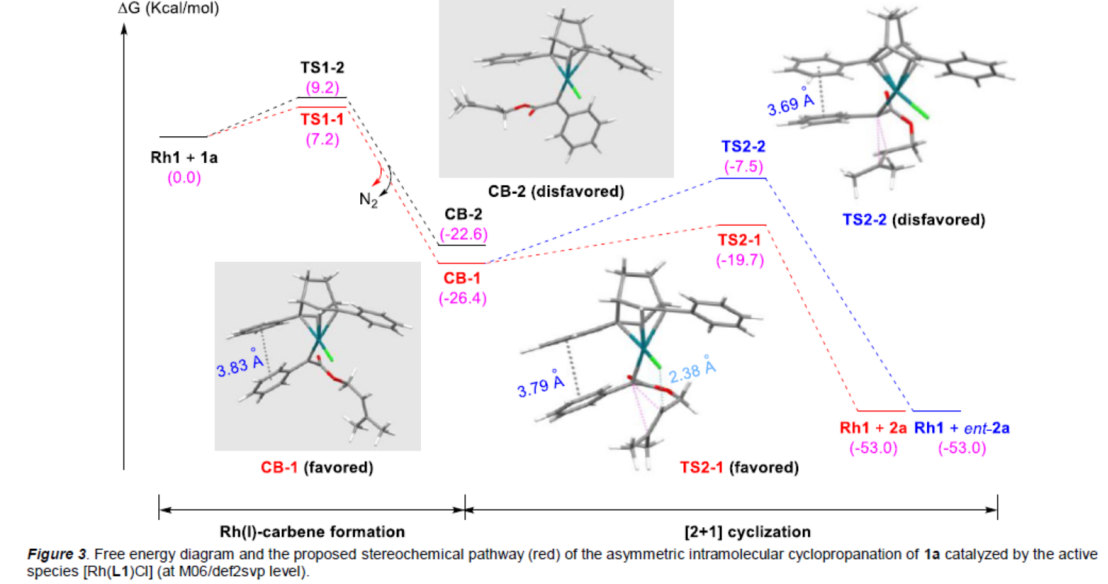
为了更深入的理解反应的立体控制的起源,作者进行了DFT计算(Figure 3)。研究表明,在Rh(I)-卡宾的形成过程中,卡宾中间体CB-1由于二烯配体的苯基与重氮底物的π–π堆叠相互作用从而降低了吉布斯自由能,从而使CB-1更加稳定。在形成环丙烷的分子内卡宾转移步骤中的研究表明,在内部双键处加入其它基团将与氯产生强烈的空间排斥,这与实验结果一致。此外,反应中烯丙基末端的两个取代基是远离催化中心的,由此可以解释反应具有较宽底物范围的原因。
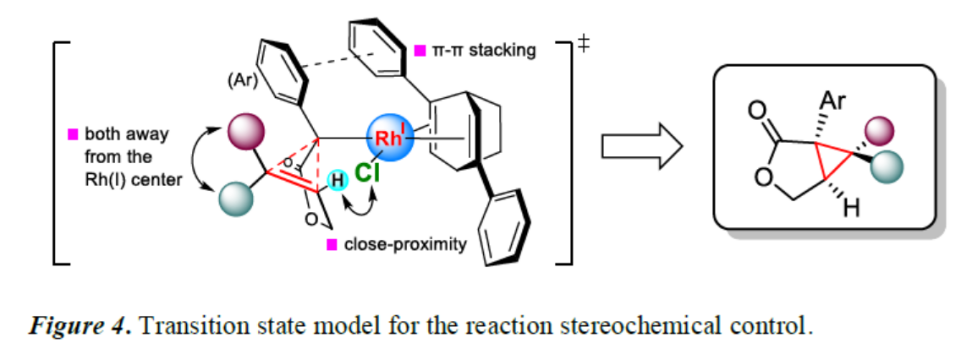
最后,作者提出如下合理的反应立体化学控制的过渡态模型(Figure 4)。
总结:南方科技大学的徐明华课题组在报道一种全新的铑(I)/手性双烯催化三取代烯丙基重氮乙酸酯的不对称分子内环丙烷化反应方法学,进而成功实现了一系列具有3个连续立体中心的五取代环丙烷分子的构建。
参考文献:
- [1] Y. Cohen, A. Augustin, L. Levy, P. G. Jones, D. B. Werz, I. Marek, Angew. Chem. Int. Ed. 2021, 60, 11804. doi: 10.1002/anie.202102509
- [2] C. Zhang, D. Wang, W. C. C. Lee, A. M. McKillop, X. Zhang, J. Am. Chem. Soc. 2021, 143, 11130. doi: 10.1021/jacs.1c04719
- [3] X. Ren, A. L. Chandgude, R. Fasan, ACS Catal. 2020, 10, 2308. doi: 10.1021/acscatal.9b05383
- [4] J. Shen, S. Zhu, Y. Cai, H. Xu, X. Xie, Q. Zhou, Angew. Chem. Int. Ed. 2014, 53, 13188. doi: 10.1002/anie.201406853
- [5] K. O. Marichev, J. T. Ramey, H. Arman, M. P. Doyle, Org. Lett. 2017, 19, 1306. doi: 10.1021/acs.orglett.7b00119
- [6] H. Xu, Y. Li, Y. Cai, G. Wang, S. Zhu, Q. Zhou, J. Am. Chem. Soc. 2017, 139, 7697. doi: 10.1021/jacs.7b03086
- [7] D. Zhu, H. Xia, J. Liu, L. W. Chung, M. Xu, J. Am. Chem. Soc. 2021, 143. 2608. doi: 10.1021/jacs.0c13191
- [8] D. Zhu, J. Liu, M. Xu, J. Am. Chem. Soc. 2021, 143, 8583. doi: 10.1021/jacs.1c03498
- [9] T. Wang, X. Chen, D. Zhu, L. Chung, M. Xu, Angew. Chem. Int. Ed. 2022, 61, e202207008. doi: 10.1002/anie.202207008
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载




















No comments yet.