本文作者:孙苏赟
第三部分 间接法酰胺化
之前我们介绍了几种间酯化的方法,包括间接法和直接法,这次我们介绍几种酰胺化的方法。
在酰胺的合成中,合成酯的方法一般都可以使用,包括使用DCC等。但是胺的亲核性和醇相比要明显强很多,因此DMAP在不是是必须的。对于酰氯和酸酐来讲,反应中会需要过量的胺,一方面是作为反应试剂,另一方面作为束酸剂,否则酸性环境下会使得胺的亲核性大大降低。使用碱的水溶液时的反应称为Schotten-Baumann条件下的酰胺化反应。
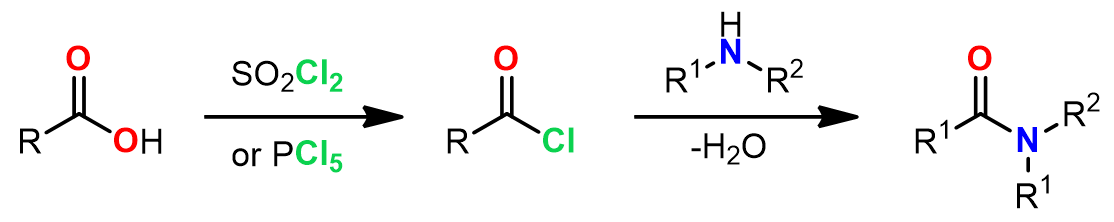
1. 经历酰卤中间体
和酯化过程比较类似,但由于氮更强的亲核性,因此在第二步中DMAP不是必须的。这里是两个例子:
a. Schotten-Baumann条件下的酰胺化反应:[1]
在水溶液在酰氯是不稳定的,但是有胺的情况下几乎可以避免酰氯的水解而更多的产生酰胺产物。
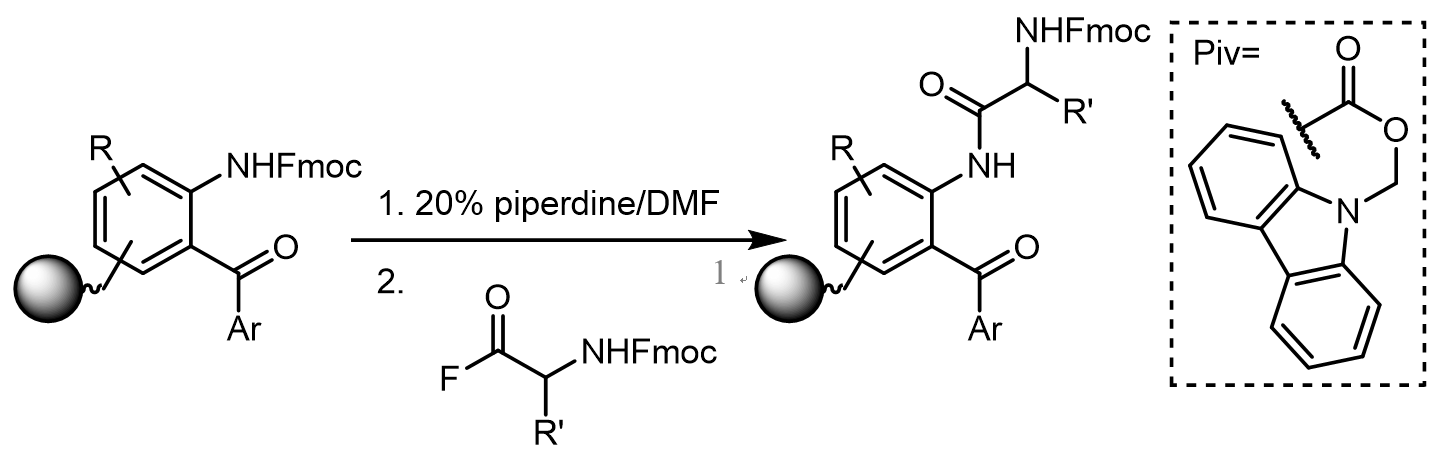
b. 酰氟的酰胺化反应 [2]
反应底物中的胺是通过Fmoc基团保护的,这样的底物非常不稳定,因此制备起来非常困难。而底物中的苯胺衍生物的反应活性较低,亲核性和醇差不多,而酰氟的高反应活性则可以克服这个问题。
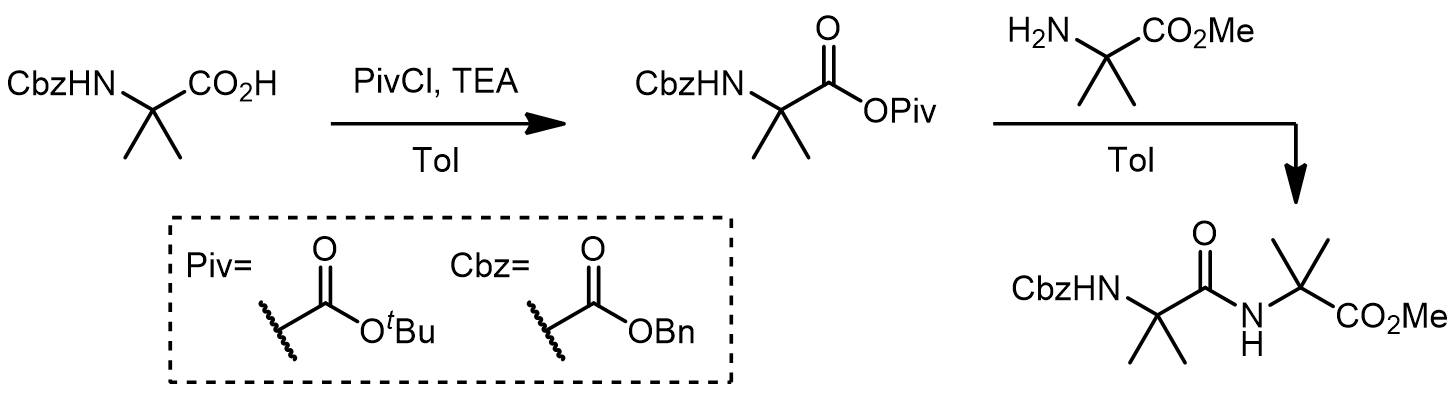
2. 经历混酸酐中间体[3]
利用和Piv基团的混酸酐是非常常用的间接法合成多肽的方法,因为Cbz保护的氨基吸电子效应和大位阻的叔丁基的原因,反应在氨基酸的氨基上发生。
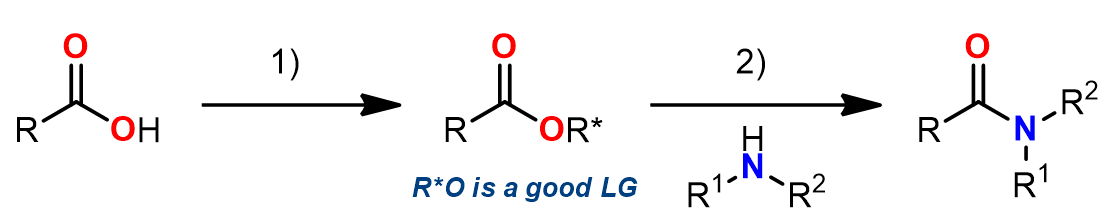
3. 经历酯活化
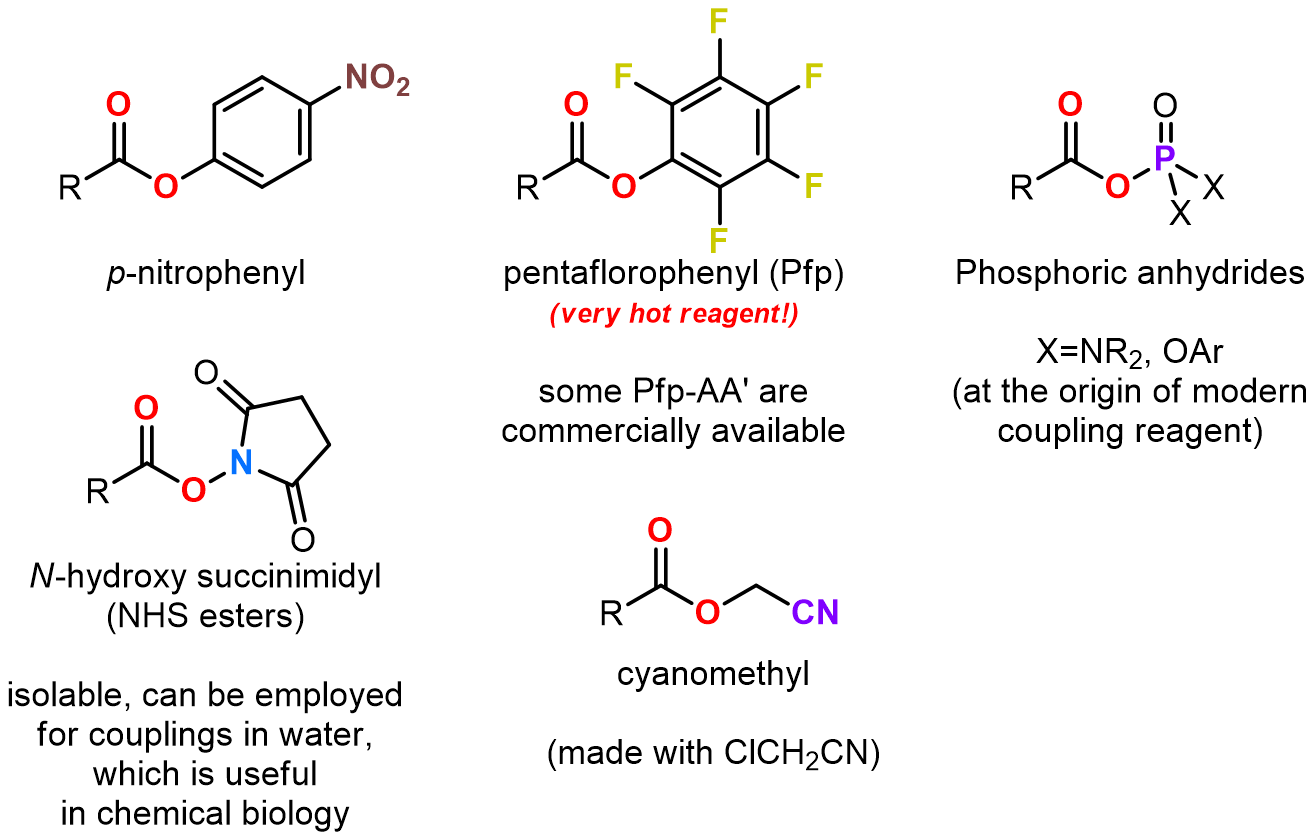
这是一个两步的酰胺化的方法,这个方法的中间体中需要一个好的离去基团,甚至中间体不稳定也可以,这是易于第二步胺的亲核步骤生成酰胺产物。常用的一些活化中间体有:
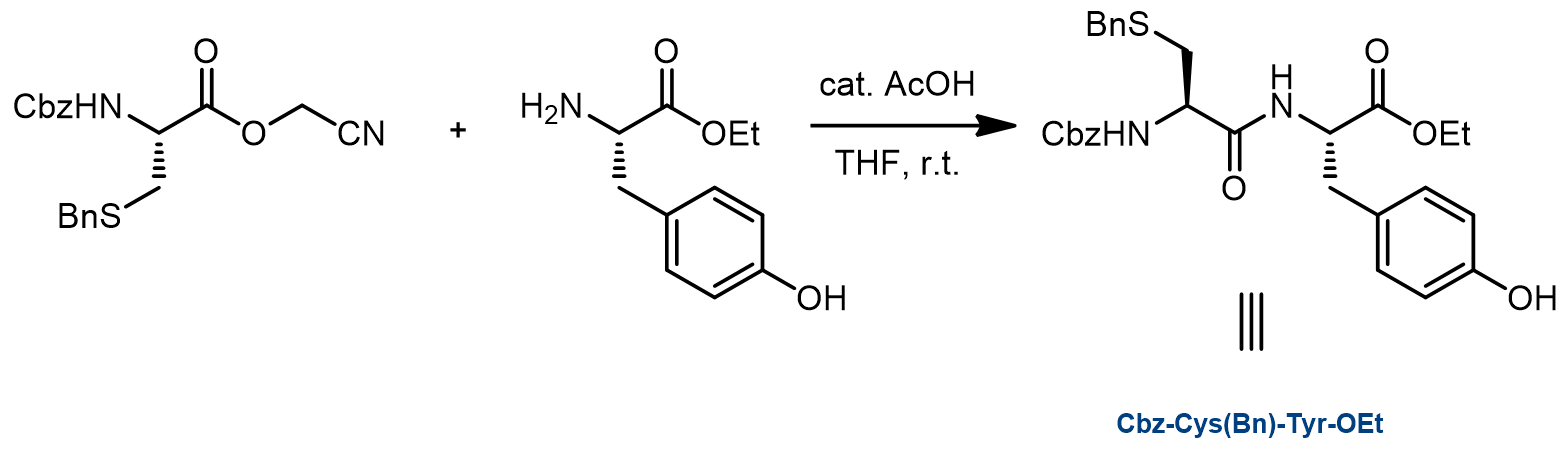
a. 二肽的合成:[4]
b. 磷试剂作为活化试剂:[5]
REFERENCES
- [1] Org. Synth., 1941, 1, 99. DOI: 10.15227/orgsyn.1.99
- [2] J. Am. Chem. Soc. 1990, 112, 26,9651-9652. DOI:10.1021/ja00182a041
- [3] Tetrahedron. 1960, 11, 39 doi: 10.1016/0040-4020(60)89006-0
- [4] J. Am. Chem. Soc.1959, 8, 121, 5688-5691 DOI: 10.1021/ja01530a040
- [5] Synthesis 1980; 1980(7): 547-551. DOI: 10.1055/s-1980-29116
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



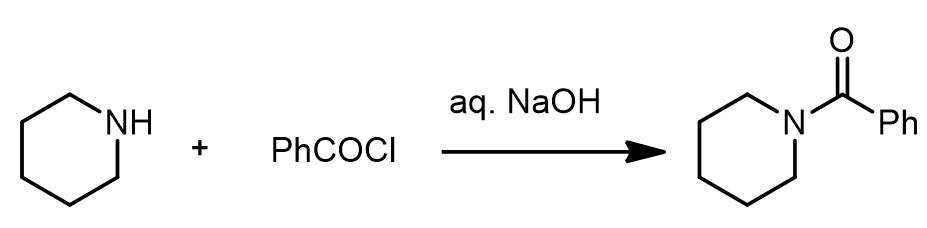















No comments yet.