本文作者:孙苏赟
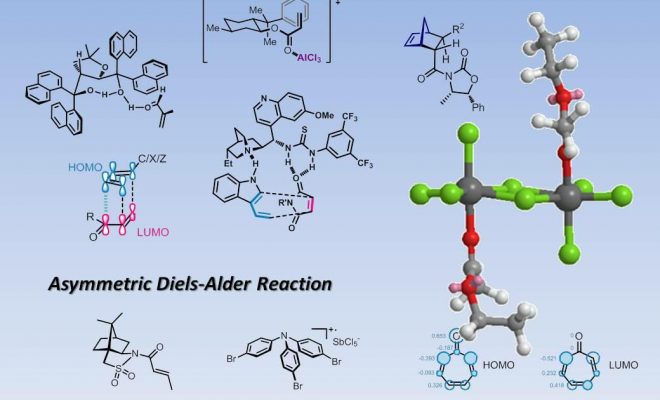
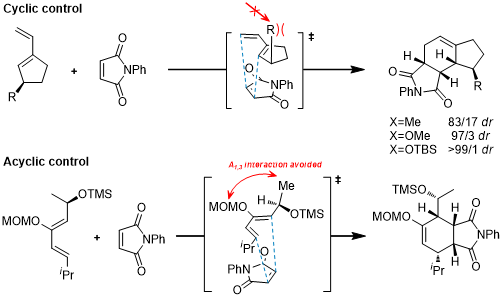
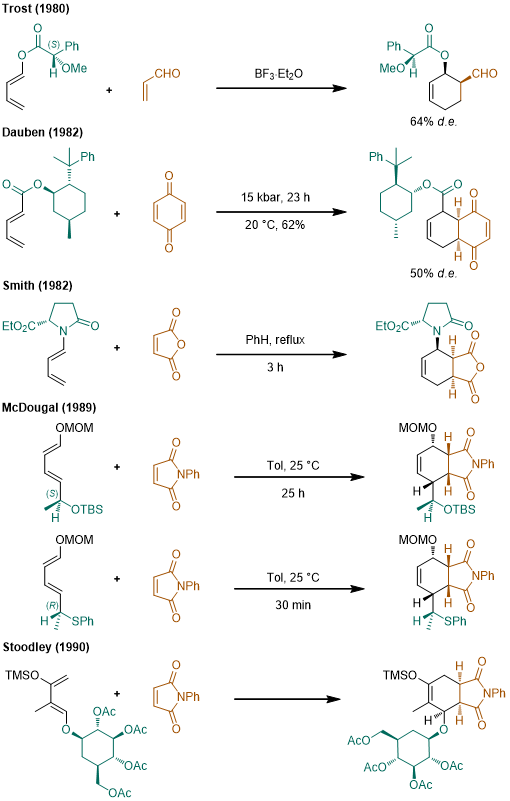
对于不对称的Diels-Alder环加成,实现的途径之一就是使用使用手性双烯体底物或使用手性亲双烯体底物,后者常使用的是使用手性辅基的方法。通过手性底物来控制DA反应的立体选择性的报道不是很多,这里是环状底物和非环状底物控制的几个例子[1-3]:
在使用手性底物参与不对称Diels-Alder反应方便,使用手性辅基是很常用且很有效的方法,常见的手性辅基有一下几种:
1. 薄荷醇酯衍生物[4]
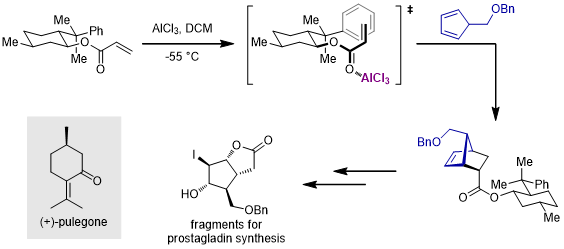
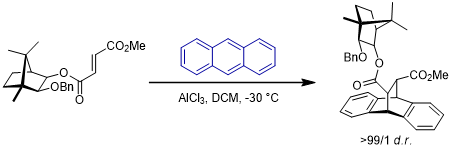
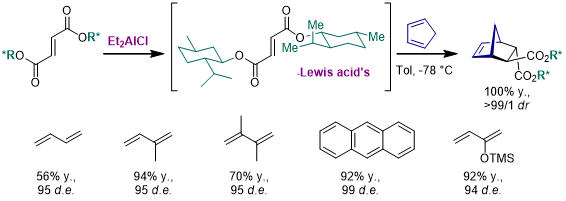
上述的薄荷醇衍生物手性片段手性辅基由Corey于1975年开发,这个片段是胡薄荷酮((+)-Pulegone)的下游产物。在Lewis酸的位阻作用下,底物中的苯基和双键之间会有π-π堆积作用,以此为双烯体靠近亲双烯体创造了面选择性。类似的,同样原位萜类天然产物的樟脑二醇衍生物也可作为手性辅基[5]:
在之后类似的原理又使用到了手性萘磺酸辅基催化的不对称DA反应中[6]:
2.反丁烯二酸酯衍生物[7, 8]
这个手性辅基最早由Davis等人于1963年共同开发,后来Yomamoto进行了更加系统的研究,测试了在不同的底物上的效果。简单来说,反丁烯二酸酯衍生物手性辅基凭借大位阻的烷基使得双烯从位阻更小的一侧靠近而实现反应的面选择性。
3.噁唑烷酮衍生物[9, 10]
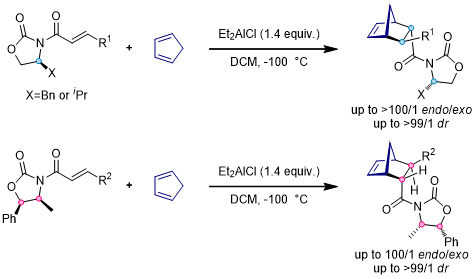
噁唑烷酮手性辅基在不对称合成中有着非常广阔的应用,例如羰基化合物的不对称烷基化,不对称Aldol反应等。在Diels-Alder反应中,噁唑烷酮片段和Lewis酸搭配使用可以达到非常好的面选择性的效果:
当双烯底物为活性较差的线性结构二烯时,由于π-π堆积作用,苄基恶唑烷酮手性辅基的效果要比另外两种好,反应可以得到更好的非对应异构选择性[11]:
当恶唑烷酮手性辅基用于分子内反应时,效果也不错[12]:
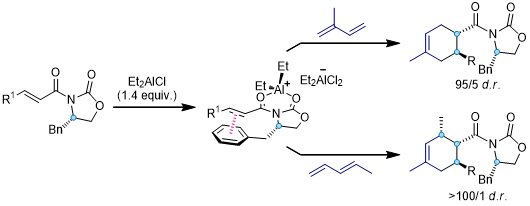
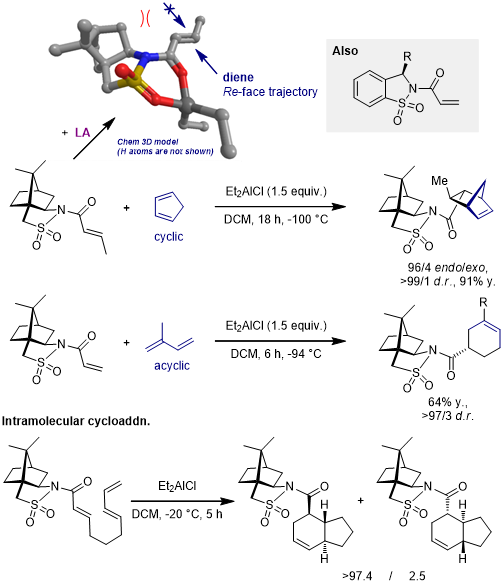
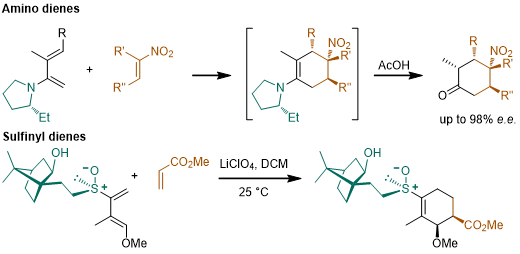
4.樟脑磺内酰胺[13-17]
5.手性双烯体
和使用手性亲双烯体进行不对称环加成比起来,手性双烯体的研究就要少得多了,但是从立体选择性的原理上来看,双烯体中使用的手性辅基和之前的几类辅基是类似的。我们从手性辅基的位置进行归类,大致可以分为端位取代的手性辅基和非端位取代的手性辅基,这里是几个例子:
a.端位取代的手性辅基[18-21]
b.非端位取代的手性辅基[22]
References
1.J. Am. Chem. Soc. 1988, 110, 14, 4625–4633. DOI: 10.1021/ja00222a022
2.Tetrahedron Lett.. 1985, 26, 3187. DOI:10.1016/S0040-4039(00)98148-6
3.J. Am. Chem. Soc. 1988, 110, 10, 3257–3262. DOI:10.1021/ja00218a041
4. J. Am. Chem. Soc. 1975, 97, 6908. . DOI:10.1021/ja00856a074
5.Angew. Chem., Int. Ed. Engl. 1981 20 205. DOI:10.1002/anie.198102051
6.Org. Lett. 1999, 1, 11, 1741–1744. DOI: 10.1021/ol991007s
7.Tetrahedron 1963, 19, 2333-2351. . DOI: 10.1016/0040-4020(63)85050-4
8.Tetrahedron Lett. 1986, 27, 4507-4510. DOI:10.1016/S0040-4039(00)84991-6
9.J. Am. Chem. Soc. 1984, 106, 15, 4261–4263. DOI: 10.1021/ja00327a031
10.J. Am. Chem. Soc. 1988, 110, 4, 1238–1256. DOI: 10.1021/ja00212a037
11.Angew. Chem., Int. Ed. Engl. 1987, 26, 1184-1186. DOI: 10.1002/anie.198711841
12.Tetrahedron Lett. 1984, 25, 4071-4074. DOI:10.1016/S0040-4039(01)90184-4
13.Helv. Chem. Acta. 1984, 67, 1397-1401. DOI:10.1002/hlca.19840670527
14.Helv. Chem. Acta. 1989, 72, 123-131. DOI:10.1002/hlca.19840670527
15.J. Am. Chem. Soc. 1973, 95, 6365-6370. DOI:10.1021/ja00800a033
16.Tetrahedron Lett. 1985, 26, 5437-5440. DOI:10.1016/S0040-4039(00)98228-5
17.Tetrahedron Lett. 1990 31 5015. DOI:10.1016/S0040-4039(00)97793-1
18.J. Am. Chem. Soc. 1980 7595. DOI: 10.1021/ja00545a049
19.Tetrahedron lett. 1982 23 4875. DOI: 10.1016/S0040-4039(00)85736-6
20.Tetrahedron lett. 1989 30 3295. DOI:10.1016/S0040-4039(00)99225-6
21.Tetrahedron lett. 1989 30 3897. DOI: 10.1016/S0040-4039(00)99278-5
22. Org. Chem. 1997, 62, 4376–4384. . DOI: 10.1021/jo962286p
























No comments yet.