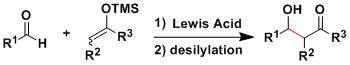- 概要
通常利用酸 ・碱催化的经典的羟醛反应是可逆反应,烯醇生成时的立体选择比较难控制,以至于得到复杂的混合产物。
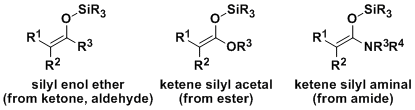
1970年代Mukaiyama研究发现、可以被分离纯化以及长期保存的烯醇硅醚,烯酮硅基缩酮等作为亲核试剂使用的话,使得交叉羟醛反应得以有效地进行。
该反应经常在实验室被应用,可以用于合成各种各样的复杂的化合物。
活性Lewis酸通常催化量即可使反应进行完全。而且、含F离子的Lewis碱作为单个烯醇的活化剂在反应中发挥其作用。
利用各种各样的不对称催化剂、可以应用于各种催化不对称反应中。
- 基本文献
・ Mukaiyama, T.; Narasaka, K.; Banno, K. Chem. Lett. 1973, 1011. doi:10.1246/cl.1973.1011
・ Mukaiyama, T.; Izawa, T.; Saigo, K. Chem. Lett. 1974, 323. doi:10.1246/cl.1974.323
・ Mukaiyama, T.; Banno, K.; Narasaka, K. J. Am. Chem. Soc. 1974, 96, 7503. DOI: 10.1021/ja00831a019
・ Mukaiyama, T. Org. React. 1982, 28, 203.
・ Mukaiyama, T.; Kobayashi, S. Org. React. 1994, 46, 1. doi: 10.1002/0471264180.or046.01
・ Denmark, S. E.; Stavenger, R. A.; Wong, K.-T. Tetrahedron 1998, 54, 10389. doi:10.1016/S0040-4020(98)00493-1
・ Groger, H.; Vogl, E. M.; Shibasaki, M. Chem. Eur. J. 1998, 4, 1137. [abstract]
・ Mukaiyama, T. Tetrahedron 1999, 55, 8609. doi:10.1016/S0040-4020(99)00437-8
・ Mukaiyama, T. Angew. Chem. Int. Ed. 2004, 43, 5590. doi:10.1002/anie.200300641
- 反应机理
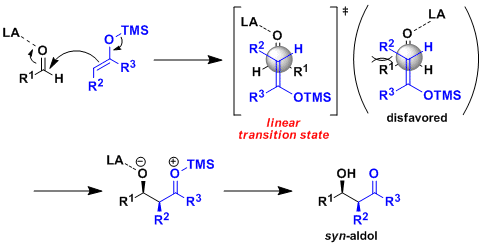
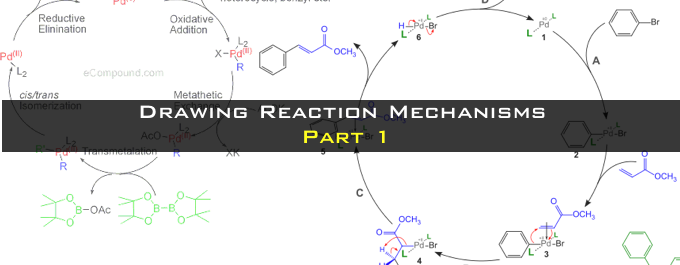
硅的路易斯酸性较弱,不容易和羰基发生配位。因此不会形成六元环反应中间态,而是形成线型中间态发生反应。硅的烯醇化物有形成syn体的倾向,与烯醇的几何异构无关。但是与锂或硼酸的烯醇化物相比,硅的烯醇化物的中间态的自由度很高,所以很难实现反应的高立体选择性。硅的烯醇化物的的选择性主要依靠化合物的立体因素和偶极子效果来实现。
- 反应实例
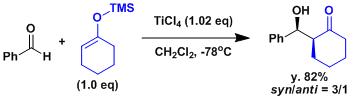
不对称催化羟醛反应的例子[1]
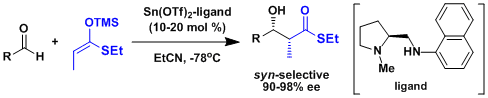
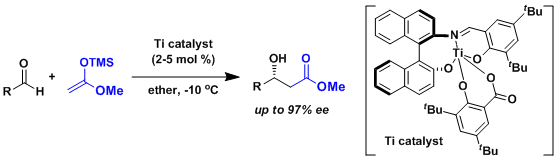
一般来说从缩醛得到烯醇的立体控制要素还太少、出选择性比较困难。Carreira等人开发了一种不对称催化剂成功解决了这个问题。[2]
由于三氟甲基硫酸镧即便在水系容易中失活也比较缓慢、所以甲醛水溶液就能在此条件下进行Mukaiyama羟醛反应。[3] 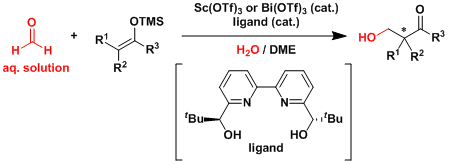 Denmark[4a, b]和柴崎[4c]等人研究报道了对于合成低选择性・低反应性的非活化的酮催化不对称Mukaiyama羟醛反应的一系列有效地方法。
Denmark[4a, b]和柴崎[4c]等人研究报道了对于合成低选择性・低反应性的非活化的酮催化不对称Mukaiyama羟醛反应的一系列有效地方法。 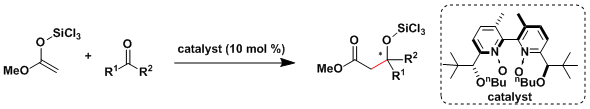
 由醛制备的烯醇硅醚进行羟醛反应是极其困难的。用带有高位阻三(三甲基硅基)硅烷的烯醇硅醚作为底物的的话,可以抑制反应后生成的醛的再次进行羟醛。出于这个原因,可以作为等同于醛的亲核试剂在Mukaiyama反应中使用。[5]
由醛制备的烯醇硅醚进行羟醛反应是极其困难的。用带有高位阻三(三甲基硅基)硅烷的烯醇硅醚作为底物的的话,可以抑制反应后生成的醛的再次进行羟醛。出于这个原因,可以作为等同于醛的亲核试剂在Mukaiyama反应中使用。[5]  Lewis碱活化・Mukaiyama型的羟醛反应[6]
Lewis碱活化・Mukaiyama型的羟醛反应[6] 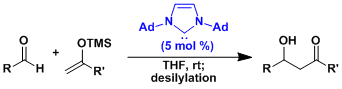
- 实验步骤
二(三氟甲烷磺酰)亚胺(HNTf2)作为催化剂催化的Mukaiyama羟醛反应[7] 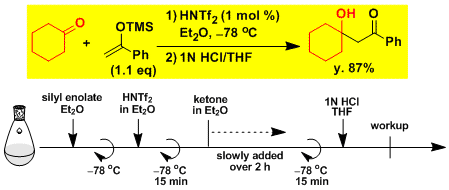
- 实验技巧
- 参考文献
[2] Carreira, E. M. et al. J. Am. Chem. Soc. 1994, 116, 8837. DOI: 10.1021/ja00098a065
[3] (a) Kobayashi, S. et al. J. Am. Chem. Soc. 2004, 126, 12236. DOI: 10.1021/ja047896i (b) Kobayashi, S. et al. Org. Lett. 2005, 7, 4729. DOI: 10.1021/ol051965w
[4] (a) Denmark, S. E.; Fan, Y. J. Am. Chem. Soc. 2002, 124, 4233.[abstract](b) Denmark, S. E.; Fan, Y., Eastgate, M. D. J. Org. Chem. 2005, 70, 5235. DOI: 10.1021/jo0506276(c) Oisaki, K.; Zhao, D.; Kanai, M.; Shibasaki, M. J. Am. Chem. Soc. 2006, 128, 7164.DOI: 10.1021/ja061815w
[5] (a) Boxer, B. M.; Yamamoto, H. J. Am. Chem. Soc. 2006, 129, 49. DOI: 10.1021/ja054725k (b) idem. J. Am. Chem. Soc. 2007, 129, 2762. DOI: 10.1021/ja0693542 (c) Boxer, M. B.; Akakura, M.; Yamamoto, H. J. Am. Chem. Soc. 2008,130, 1580. DOI: 10.1021/ja7102586 (d) Boxer, M. B.; Yamamoto, H. Org. Lett. 2008, 10, 453. DOI: 10.1021/ol702825p
[6] Song, J. J.; Tan, Z.; Reeves, J. T.; Yee, N. K.; Senanayake, C. H. Org. Lett. 2007, 9, 1013. DOI: 10.1021/ol0630494
[7] Saito, S.; Nakadai, M.; Yamamoto, H. Synlett 2001, 1245. DOI: 10.1055/s-2001-16055