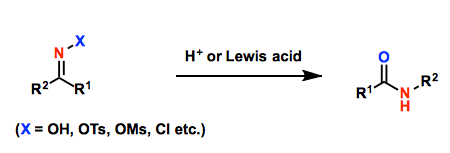
氮化合物→羧酸衍生物
- 概要
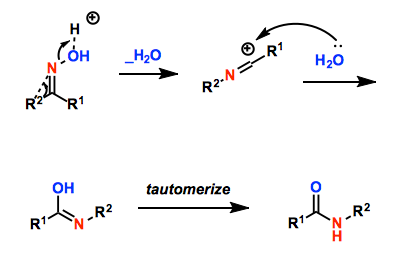
肟在酸催化剂的作用下烷基发生迁移、之后水解生成酰胺化合物。环肟重排后能得到扩环的酰胺。
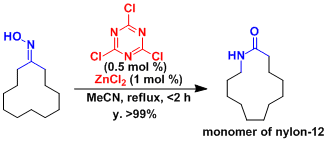
环己酮肟的贝克曼重排反应、能得到6 -尼龙的原料ε-己内酰胺。这一合成法也已利用在工业生产中。
- 基本文献
・ Beckmann, E. Ber. 1886, 19, 988.
・ Donaruma, L. G.; Heldt, W. Z.; Org. React. 1960, 11, 1.
・ Gawtey, R. E. Org. React. 1988, 35, 1.
・ Hauske, J. R. Comp. Org. Syn. 1991, 1, 98.
・ Maruoka, K.; Yamamoto, H. Comp. Org. Syn. 1991, 6, 763.
・ Craig, D. Comp. Org. Syn. 1991, 7, 689.
- 反应机理
从分子轨道理论来看,处于肟羟基反式位置的基团是能够优先迁移的基团。但在酸性条件下,肟的E/Z互相转化非常快。所以反应会发生于相对容易迁移的取代基。重排反应的基团迁移顺序是芳基、烯基 > 叔烷基 > 仲烷基 > 伯烷基的顺序,这一顺序和基团的电子密度有关。(参考文件: Angew. Chem. Int. Ed. 2005, 44, 2370.)
- 反应实例
山本和石原group发现三聚氯氰和氯化锌的混合催化剂对Beckmann重排反应非常有効。[1] 反应通过Meisenheimer Complex的反应机理也值得探讨。
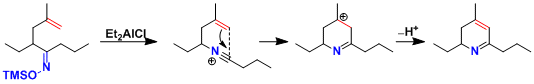
(本反应和分子内羰基-ene反应组合)能合成二氢吡啶环。[2]
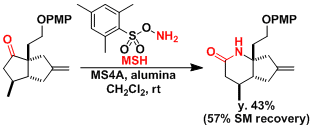
Pinnaic Acid的合成[3]:利用MSH [4]的Beckmann重排能立体选择性的合成α-季胺。
- 实验步骤
- 实验技巧
- 参考文献
[2] 大学院講義有機化学 II, p138.
[3] Xu, S.; Arimoto, H.; Uemura, D. Angew. Chem. Int. Ed. 2007, 46, 5764. DOI:10.1002/anie.200701581
[4] Tamura, Y.; Fujiwara, H.; Sumoto, K.; Ikeda, M.; Kita, Y. Synthesis 1973, 215.
[5] Schinzer, D.; Bo, Y. Angew. Chem. Int. Ed. 1991, 30, 687. DOI: 10.1002/anie.199106871
- 相关书籍
- 相关链接
・Beckmann Rearrangement (organic-chemisty.org)
・Beckmann Rearrangement
・Beckmann Rearrangement (Wikipedia)









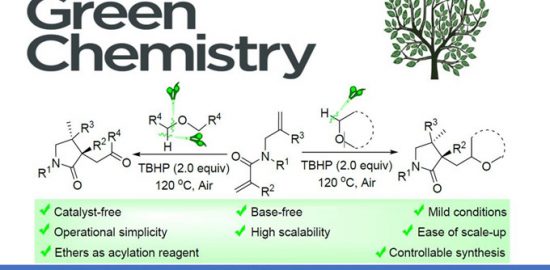





No comments yet.