本文投稿作者 Asymmboy
概要
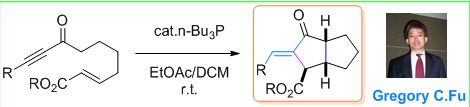
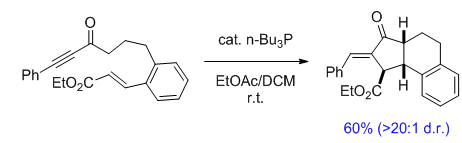
Fu环化反应(Fu Cyclization)是在三正丁基膦催化下进行的diquinane的立体选择性合成。该反应实现了三个连续立体中心的构筑,以及双键构型(E式)的高度选择性控制,反应条件极为温和,具有高度的立体选择性、立体专一性与优良的官能团兼容性。Diquinane骨架(具有二环[3.3.0]辛-2-酮结构单元)不仅广泛存在于各种具有生物活性的化合物中,而且还是有机合成中极为重要的砌块。因而Fu环化反应为Diquinane的合成方法学研究开辟了全新的路径。然而,由于有机膦化合物毒性较高,对环境的兼容性较差。因而,发展环境友好型的亲核催化剂仍有待进一步研究。
基本文献
J. E. Wilson, J. Sun, G. C. Fu, Angew. Chem. Int. Ed., 2010, 49,161. doi: 10.1002/anie.200905125
反应机理
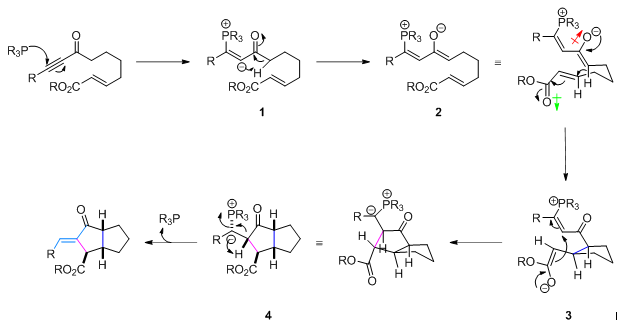
该反应的机理与Tomita拉链环化反应(Tomita Zipper Cyclization)类似,首先膦化合物与底物中的炔基发生亲核加成反应,形成1,2-偶极中间体1,接下来1通过交叉互变异构化(Cross-Tautomerization)过程产生中间体2,中间体2通过类信封式(Envelop-like)构象(这一点在Fu的文章中并未提及,纯属小编个人观点。本人认为这种构象排列将使极性基团之间的偶极相互作用最小,为合理的反应活性构象。如果大家有不同见解,欢迎踊跃发言)进行烯醇负离子的Michael加成,产生中间体3,随后,新形成的烯醇负离子再对双键发生亲核加成,形成中间体4,此时,已完成三个手性中心的构建。最后,小编认为生成双键时的高度E-选择性源自中间体4中由于季鏻盐与羰基氧之间的静电稳定化以及季鏻盐α位碳负离子与酯基中的羰基或R基团间的负离子-π相互作用所产生的反式共平面构象(立体电子效应控制, 可能通过E2或E1CB机理谱中的E2H,小编觉得要彻底搞清楚消除过程的立体专一性具体是哪种机理起作用,需要计算化学或是分子力学的帮助)的稳定化,即构象锁定(conformational blocking)。
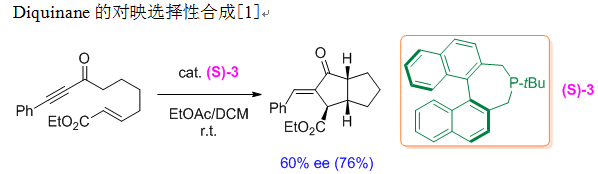
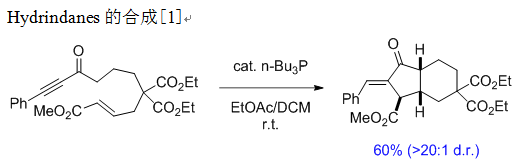
反应实例
实验步骤
将底物加入反应瓶中,并将反应瓶进行抽真空-充氩气操作三次。加入适量体积的CH2Cl2/EtOAc (9:1v/v) 溶剂,将底物配成0.01M 的溶液。通过注射器加入三正丁基膦 (0.20 equiv) ,将上述溶液在室温下搅拌20小时。20小时过后,将上述反应液暴露于空气中约1小时,再将反应液通过短硅胶柱过滤,采用100 mL乙醚进一步冲洗硅胶柱, 并将乙醚相浓缩获得粗产物. 粗产物通过快速柱色谱(flash chromatography)纯化获得相应目标产物。
实验技巧
参考文献
[1]J. E. Wilson, J. Sun, G. C. Fu, Angew. Chem. Int. Ed., 2010, 49, 161. doi: 10.1002/anie.200905125. [2] (S)-3作为手性配体的介绍参阅:Y. Chi, X. Zhang, Tetrahedron Lett. 2002, 43, 4849. doi: [3] 具有cis-Hydrindanes骨架的天然产物的介绍参阅:B. M. Trost, C. D. Haffner, D. J. Jebaratnam, M. J. Krische, A. P. Thomas, J. Am. Chem. Soc., 1999, 121, 6183. doi:
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
















No comments yet.