本文作者:杉杉
导读
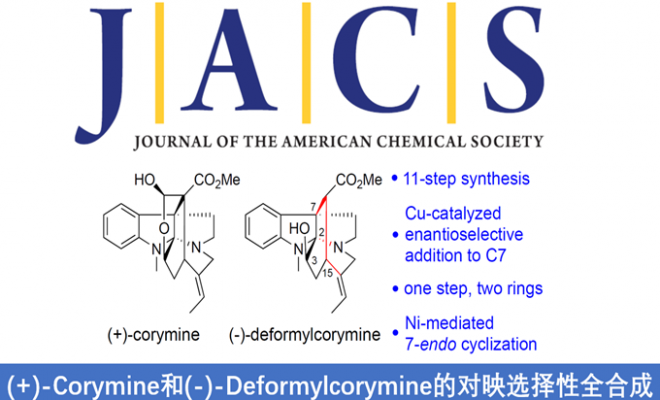
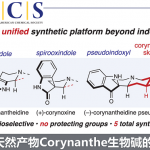
近日,上海有机所李超忠研究员课题组在JACS发表论文,首次报道了灯台类单萜吲哚生物碱(akuammiline alkaloids)中(-)-deformylcorymine和(+)-corymine的对映选择性全合成。以市售的N-nosyltryptamine(N-(2-(1H-吲哚-3-基)乙基)-4-硝基苯磺酰胺)作为起始原料,经11步即可获得目标产物,涉及三个关键步骤,(a)铜催化下实现丙二酸二甲酯与3-溴代吲哚的对映选择性加成,构建C7全碳四元立体中心;(b)通过分子内亲核C-和N-加成一步构建环己基和吡咯烷基环;(c)镍催化实现烯基溴化物7-内环化以获得氮杂环庚烷基环。此外,该策略进一步扩展到了灯台碱中(-)-10-demethoxyvincorine,(-)-2(S)-cathafoline和(-)-3-epi-dihydrocorymine 17-acetate的合成。
Enantioselective Total Synthesis of (+)-Corymine and (−)-Deformylcorymine
Benxiang Zhang, Xiaoqing Wang, Chaozhong Li*
J. Am. Chem. Soc. 2020, 142, 3269-3274. DOI:10.1021/jacs.0c00302
正文
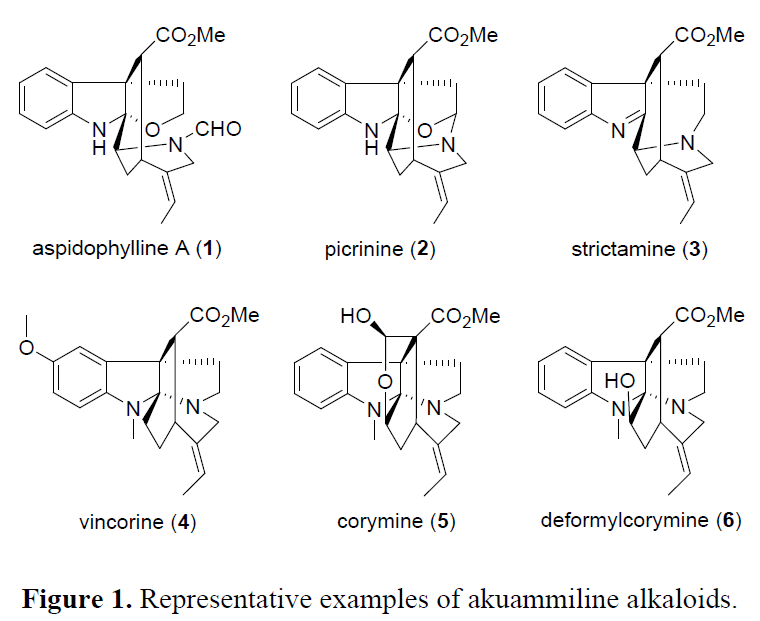
灯台碱(akuammiline alkaloids)是一类具有五环骨架的单萜吲哚类生物碱,同时具有多种药理活性(Figure 1)。然而,由于结构的复杂性从而限制了它们在有机合成中的研究。近些年来,一些灯台碱的全合成已被报道,如aspidophylline A (1)、prcrinine (2)、strictamine (3)、 vincorine (4)、scholarisine A、calophyline A、akuammiline等。此外,一些新型的合成方法也促进了该类然产物的全合研究。如Qin课题组报道了一种环丙烷化/开环/亚氨基环化(CRI反应)策略构建吲哚啉生物碱骨架,Garg课题组报道了间断的费歇尔吲哚化方法构建稠合吲哚骨架,Ma课题组报道了通过吲哚的分子内去芳化氧化偶联反应构建全碳四元立体中心结构等。
同时,corymine (5) 和 deformylcorymine (6)也作为灯台碱的另外两种重要结构。虽然两种化合物的骨架与vincorine相似,但在环己基环上具有额外的C3官能团(羟基或烷氧基),从而使其合成极具挑战性。本课题组近期报道了从N-nosyltryptamine经21步合成(±)-corymine,其中炔丙基克莱森重排作为C15-C20键立体定向构建的关键步骤。然而,该策略要求除去C14处的氧代部分并在C3处引入羟基,从而使合成路线冗长。Zu课题组通过N保护的吲哚-3-酮经19步合成(±)- deformylcorymine。迄今为止,关于这两个分子的不对称合成尚未报道。
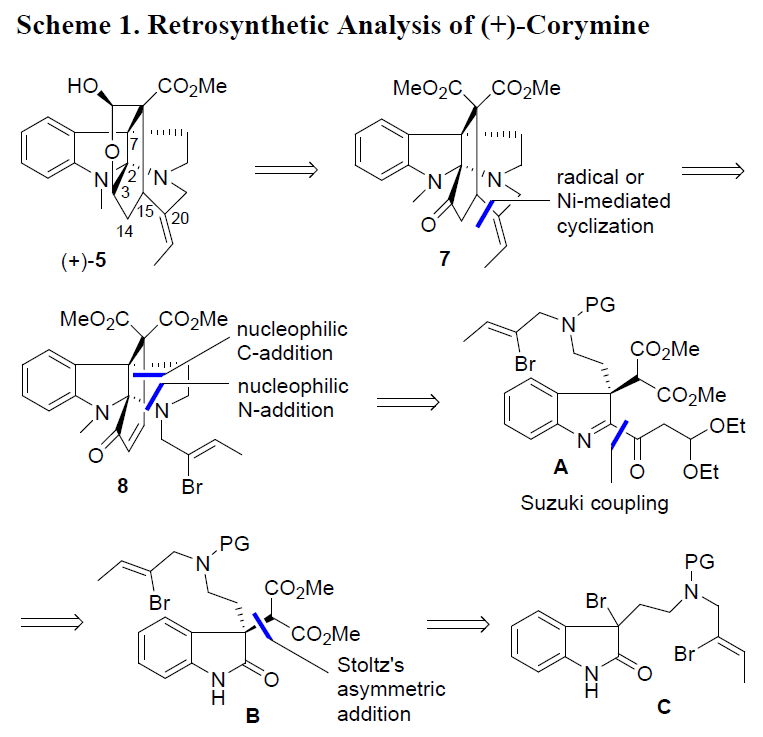
首先,作者对(+)-corymine的逆合成进行了相关的分析(Scheme 1)。(+)-5可以通过酮7经立体选择性还原获得(烯酮8经乙烯基自由基环化或镍催化环化(7-内形式)获得7),烯酮8可以通过亚氨基酮A经分子内亲核N-/C-加成获得,中间体A中的C2侧链可以通过中间体B经Suzuki偶联获得,最后,可采用Stoltz课题组报道的构建全碳四元立体中心B的方法(铜催化3-溴代吲哚C的对映选择性加成)。
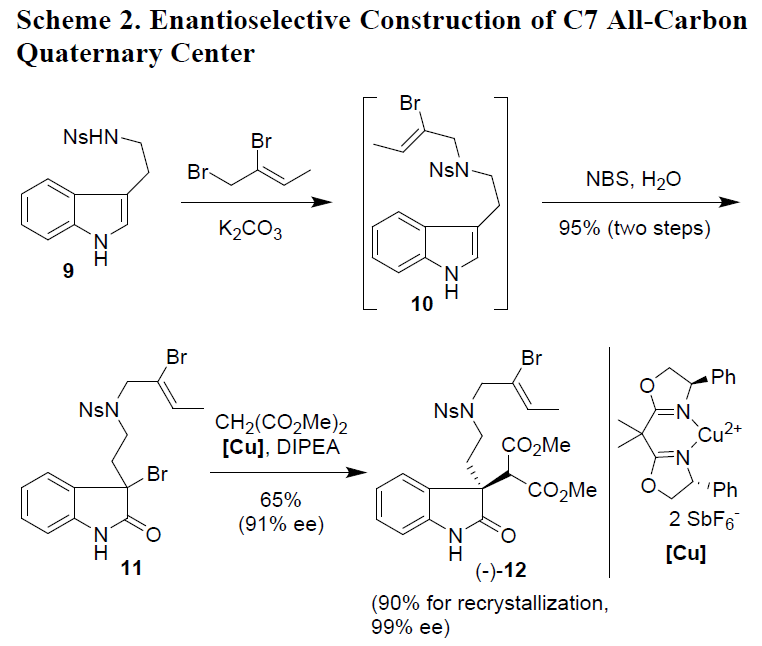
随后,作者以市售的N-nosyltryptamine(9)作为起始原料进行了相关全合成的研究(Scheme 2)。以碳酸钾为碱,使N-nosyltryptamine(9)与(Z)-1,2-二溴丁-2-烯(1.5eq)在室温下于DMF溶剂中进行烯丙基化反应,获得烯基溴化物10,再使用NBS,在t-BuOH-THF溶液中分两步处理,获得3-溴代吲哚11,产率为95%。然后,根据Stoltz课题组报道的方法,进行了铜催化下丙二酸二甲酯的对映选择性加成反应,反应结果表明,以铜-双(恶唑啉)络合物[Cu]为催化剂,N,N-二异丙基乙胺(DIPEA)为碱,底物11与丙二酸二甲酯可在-20℃的二氯甲烷中反应,获得所需产物(-)-12,产率为65%,ee为91%。有趣的是,在乙酸乙酯/石油醚(1:10)中重结晶,发现该晶体都是外消旋体,可通过过滤除去晶体之后,以90%的产率获得光学纯的(-)-12(99%ee)。
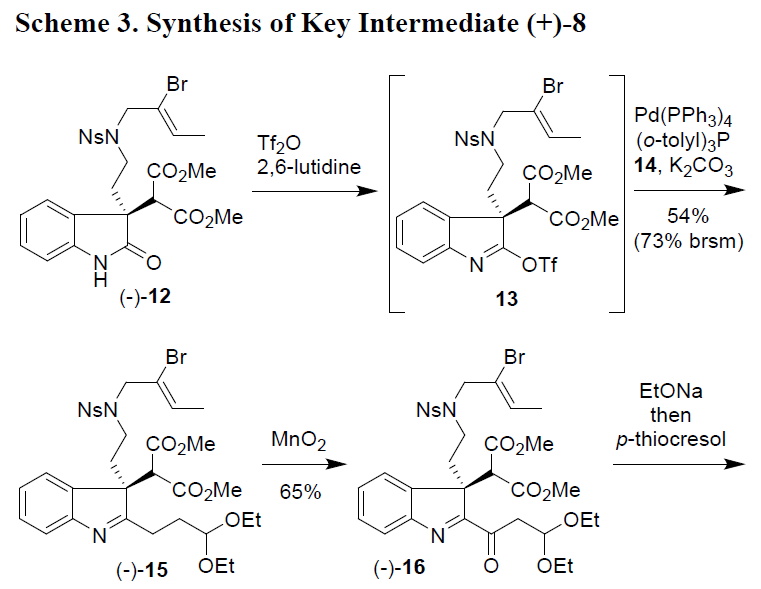
在获得光学纯的(-)-12之后,作者试图将其转化为类似于A的C2-烷基化(或羰基化)衍生物(Scheme 3)。羟吲哚与烷基锂或格氏试剂直接进行烷基化反应无法获得所需的产物,因此,作者将(-)-12转化为反应活性更高的三氟甲磺酸酯13。然而,具有弱亲核性的二烷基锌或有机铜酸盐与13的C2-烷基化均失败。此外,13与末端炔烃的羰基Sonogashira反应也不可行,仅观察到C2-炔基化副产物。13与酰基锡烷或酰基三甲基硅烷的交叉偶联反应导致底物分解(得到(-)-12)。幸运的是,Suzuki偶联反应获得预期的结果,因此,(-)-12与三氟甲磺酸酐首先在2,6-二甲基吡啶中反应生成中间体13,随后,在使用9-(3,3-二乙氧基丙基)-9-BBN(14)、K2CO3、催化量的Pd(PPh3)4和(o-tolyl)3P,在THF水溶液中反应,获得预期的C2-烷基化产物(-)-15(收率54%)。
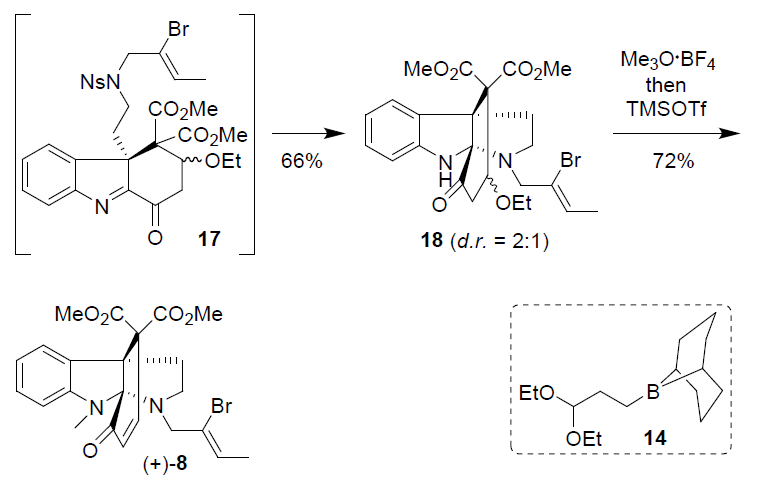
接下来,(-)-15通过MnO2氧化获得65%收率的亚氨基酮(-)-16,随后的挑战是关键中间体8环闭合类型。可以设想N-脱保护,随后同时将N-加成到C=N键上,然而,在碱性条件下(对-甲酚,K2CO3,CH3CN)对(-)-16进行N-脱保护形成了8元的偶氮烷基环,而不是所需的吡咯烷基环。显然,缩醛与胺的缩合占据优势,这一出乎意料的结果表明,必须先形成8中的6环,这可以通过丙二酸酯在酸性条件下以缩合的方式实现,但实现结果表明,在各种酸性(布朗斯酸或路易斯酸)条件下,均未观察到闭环产物。相反,(-)-16可能会分解,因为亚氨基酮部分在酸性条件下不稳定,最终发现,环化作用可以通过EtONa之类的碱可提供中间体17,可能是因为使用EtONa会导致EtOH消除(-)-16(形成α,β-不饱和酮)。因此,将化合物(-)-16在室温下使用EtONa在THF溶液反应1h,然后再将对硫代甲酚直接加入到所得混合物中。因此,可一步构建[6.5.0]-双环骨架,以两种非对映异构体的混合物形式获得66%收率的四环产物(-)-18。同时,可将(-)-18进行N-甲基化和EtOH消除,即室温下与Meerwein试剂(Et3O·BF3)在二氯甲烷中反应,然后加入三氟甲磺酸三甲基甲硅烷基酯,以72%的收率获得所需的化合物(+)-8。
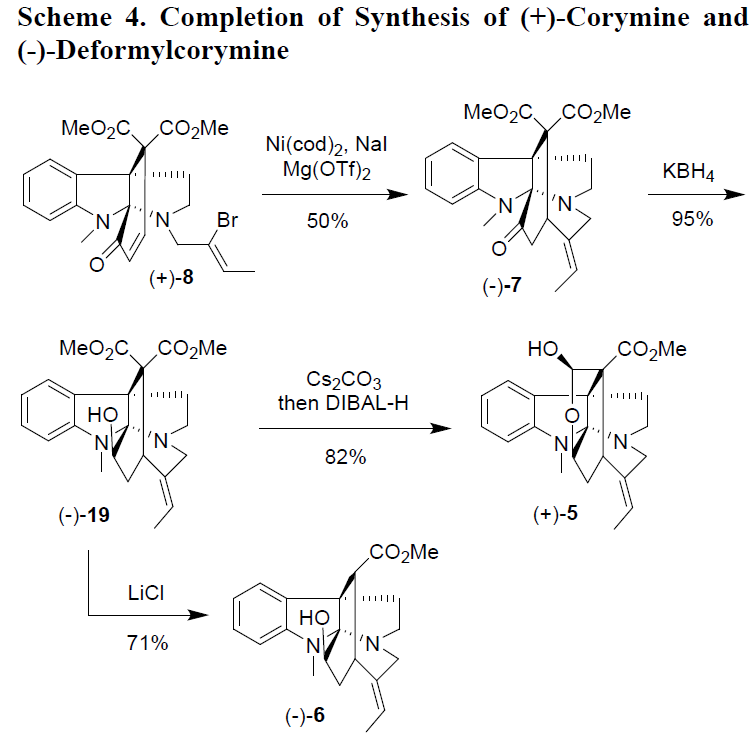
合成corymine的最后关键步骤是形成7元氮杂环庚烷基环,这极具挑战性(Scheme 4)。首先,作者对Bu3SnH-或(TMS)3SiH参与(+)-8的自由基环化进行了相关的研究,然而,仅观察到痕量的环化产物。Stephenson课题组,开发了一种光氧化还原催化的乙烯基自由基环化反应,但该反应条件导致(+)-8分解。而使用钯催化进行(+)-8的还原性Heck偶联反应时,环化伴随着烯烃的异构化。同时,钴催化的(+)-8烯基自由基环化反应也未能得到所需的产物。最后,基于Ma或Zhu提出的方法,使用Ni(cod)2促进 (+)-8的环化,以低收率获得环化产物(+)-7。效率低可能是由于烯基溴化物的较低的反应性,因为在Ni(cod)2催化环化反应中通常需要烯基碘化物作为底物。紧接着,作者对反应条件进行了优化,令人欣慰的是,(+)-8在Ni(cod)2(6eq),NaI(10eq)和Mg(OTf)2(2eq)的DMF溶剂中80℃反应,获得收率为50%的环化产物(-)-7。
用KBH4还原(-)-7可立体选择性地获得醇(-)-19。碳酸铯可促进化合物(-)-19的内酯化,在甲苯中100℃反应1 h,然后将反应液冷却至-78℃,并直接用DIBAL-H处理,以82%的收率获得(+)-5。合成的(+)-corymine的[α]D值与文献相当,其光谱也与文献中一致。因此,由N-nosyltryptamine经十一步即可获得光学纯的(+)-corymine,总收率为3.6%,相当于每步平均收率74%。
同时,(-)-19与LiCl经Krapcho’s反应,可选择性除去一个酯基,以71%的收率获得所需的产物(-)-6,作为单一立体异构体。(-)-6的[α]D与文献值一致,其光谱也与文献数据非常吻合。因此,还可以从N-nosyltryptamine经11个步反应以3.1%的总收率获得(-)-deformylcorymine。
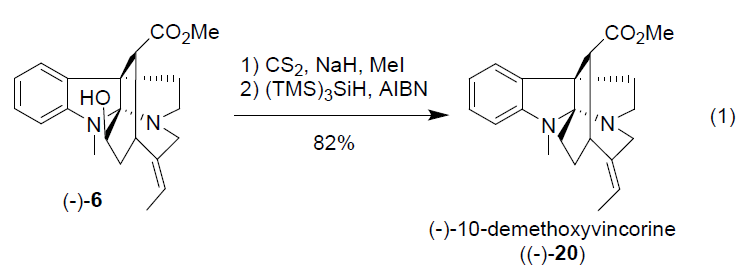
此外,合成的产物可进一步修饰,获得其它灯台碱的衍生物。如以NaH为碱,deformylcorymine与CS2、甲基碘的反应后,再与(TMS)3SiH和AIBN在苯中回流反应,以82%的收率获得(-)-20。(-)-20的[α]D值文献值一致,其光谱数据也与文献中一致。因此,可由N-nosyltryptamine经13个步骤合成了(-)-10-demethoxyvincorine。
此外,关键中间体(-)-7可用于合成3-epi-dihydrocorymine 17-acetate和2(S)-cathafoline(Scheme 5)。使用DIBAL-H(氢化二异丁基铝)还原(-)-7,以77%的收率得到(-)-21。随后在吡啶存在下,用乙酸酐对(-)-21进行O-乙酰化后,再与三氟乙酸(TFA)反应,从而导致C3-羟基构型反转,获得产物(-)-22,产率62%。化合物(-)-22的[α]D与文献中一致,其光谱数据也与文献相匹配。因此,第一个从N-nosyltryptamine经11步全合成(-)-3-epi-dihydrocorymine 17-acetate。
若底物(-)-7使用LiCl在DMF中120℃反应,则获得化学选择性脱酯产物(-)-23,产率70%。如果再用SmI2进行还原(-)-23,可导致氮杂基C-N键断裂,由此获得的中间体在室温下使用三乙基硅烷和BF3∙Et2O进一步还原获得80%的产率的(-)-24。(-)-24的[α]D值与文献中相当,其光谱数据也与文献相同。因此,由N-nosyltryptamine经12步完成了(-)-2(S)-cathafoline的合成。
总结
上海有机所李超忠研究员课题组报道了灯台碱(akuammiline alkaloids)中(-)-deformylcorymine和(+)-corymine的对映选择性全合成。通过理的设计, 可以市售的N-nosyltryptamine作为起始原料,经11步即可获得目标产物。具有以下三个特征:a)通过铜催化丙二酸酯与3-溴代吲哚的对映选择性加成从而成功构建C7全碳四元立体中心;b)通过亲核C-和N-加成一步构建环己基和吡咯烷基环;c)Ni(cod)2催化实现烯基溴化物的7-内环化从而获氮杂环庚烷基环。同时,该方案进一步扩展到了灯台碱中(-)-10-demethoxyvincorine(13步),(-)-2(S)-cathafoline(11步)和(-)-3-epi-dihydrocorymine 17-acetate(12步)的合成。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.