本文作者:杉杉
导读
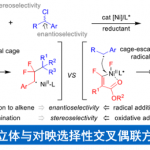
惰性C(sp3)-H键的不对称官能团化反应是直接构建复杂分子的有效途径。近日,中科大汪普生课题组在Organic Letters 上发表论文,报道了光催化α-取代丙烯酸酯与C(sp3)-H键的不对称加成反应,其中以TBADT作为氢原子转移(HAT)光催化剂,手性磷酸作为手性“质子梭”(proton-transfer shuttle)。同时,该反应涉及自由基/离子接力过程,如TBADT介导的HAT裂解惰性C(sp3)-H键,1,4-自由基加成,逆向攫氢反应(aback hydrogen abstraction)和对映选择性质子化等。
Asymmetric Photocatalytic C(sp3)-H Bond Addition to α‑Substituted Acrylates
Zhen-Yao Dai, Zhong-Sheng Nong, Shun Song, and Pu-Sheng Wang*
Org. Lett. ASAP DOI:10.1021/acs.orglett.1c00801
正文
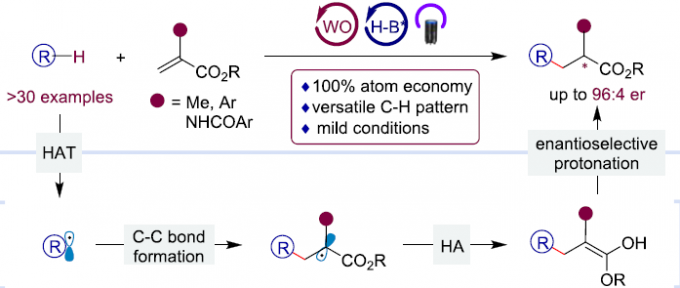
与常规有机合成反应相比,惰性C(sp3)-H键的直接不对称官能化代表了一种高效的策略,可直接从简单分子合成复杂的化合物。其中,氢原子转移(HAT)作为C(sp3)-H键活化的高效策略之一,可在温和条件下实现惰性C(sp3)-H键活化,从而产生高反应性的烷基自由基,但对于其立体选择性控制仍未被研究。对于光介导HAT的文献中[1],C(sp3)-H键与Michael受体的加成反应是研究最多的转化之一。近年来,HAT光催化剂和小分子手性催化剂的组合[2-3],已被作为将C(sp3)-H键加成至亲电子烯烃的有效催化体系,可直接实现惰性C(sp3)-H键的不对称烷基化,具有100%原子经济性。尽管使用手性胺和路易斯酸作为助催化剂在产生β-立体中心方面也取得一定的成果,但对前手性烯烃进行立体选择行自由基加成仍缺乏有效的策略[3-4]。为了解决此问题,该课题组也报道了[5-6]使用TBADT作为HAT光催化剂,手性磷酸作为手性质子梭(CPTS),从而实现C(sp3)-H键与环外烯酮的加成反应。同时,该反应涉及自由基/离子接力过程(Scheme 1A)。此外,α,β-不饱和酯与C(sp3)-H键加成也可能产生瞬态酯烯醇化物,但这种较不稳定的中间体通过对映选择性质子化可能比环状酮烯醇更难。同时,对于具有相对较低解离能的烃类底物,非立体选择性HAT途径可提供外消旋产物。因此,对于无环α-取代丙烯酸酯可为更优的烷基化剂,可与惰性C(sp3)-H键进行不对称官能化。同时,该反应涉及TBADT介导HAT过程以裂解惰性C(sp3)-H键生成碳中心自由基,然后将其进行Giese自由基加成至α-取代丙烯酸酯,得到α-酰基自由基。从还原性光催化剂到α-酰基自由基的逆向攫氢反应(HA)从而获得烯醇化合物,并且通过CPTS的对映选择性质子化得到对映体富集的α-立体异构体酯(Scheme 1B)。
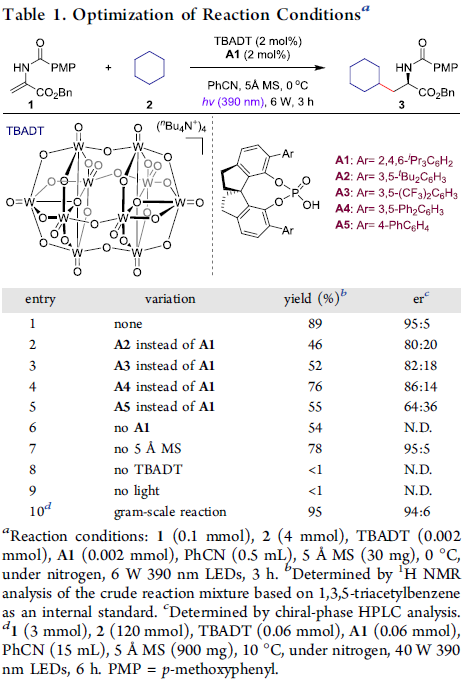
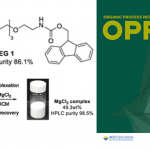
首先,作者以N-酰基脱氢丙氨酸苄酯1和环己烷2作为模型底物,进行了相关加成反应条件的筛选(Table 1)。反应的最佳条件为:以TBADT为HAT光催化剂,(S)-A1为手性质子转移穿梭剂,可在苯甲腈溶剂中于390 nm 照射下,即可获得89%收率的目标产物3,er为95:5。
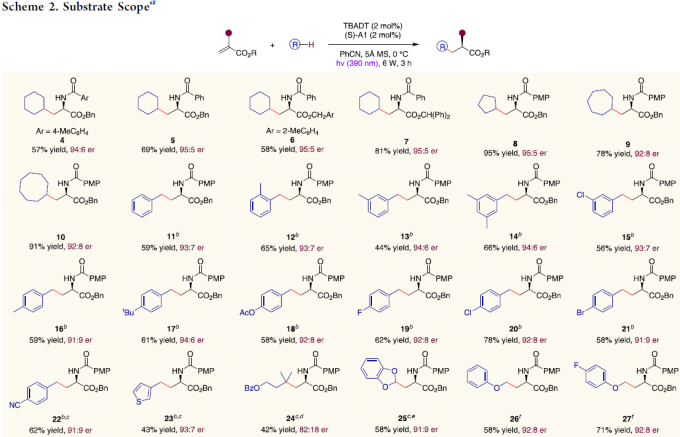
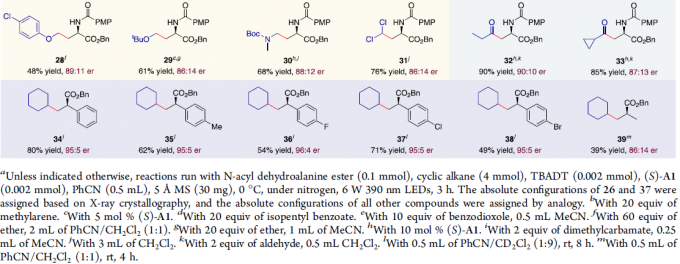
在获得上述最佳反应条件后,作者开始对底物范围进行了扩展(Scheme 2)。一系列环烷烃,可顺利反应,获得产物4–10。同时,甲基芳烃底物中的芳基取代不受电子效应和定位效应的影响,均与体系兼容,获得相应的产物11–22。3-甲基噻吩也作为有效的底物,获得产物23。苯甲酸异戊酯也可进行烷基化反应,以中等收率获得产物24,但对映选择性略有降低。1,3-苯并二恶唑、苯基醚和甲基叔丁基醚也为合适的底物,反应仅在与氧相邻的碳原子上发生,从而获得所需的产物25–29。其次,脂肪族酰胺和二氯甲烷,也可获得相应的产物30–31。脂族醛底物也以高收率获得产物32–33。值得注意的是,反应条件稍微改变,α-芳基丙烯酸酯也能够作为有效底物,获得产物34–38。此外,甲基丙烯酸酯底物也可顺利反应,获得产物39。
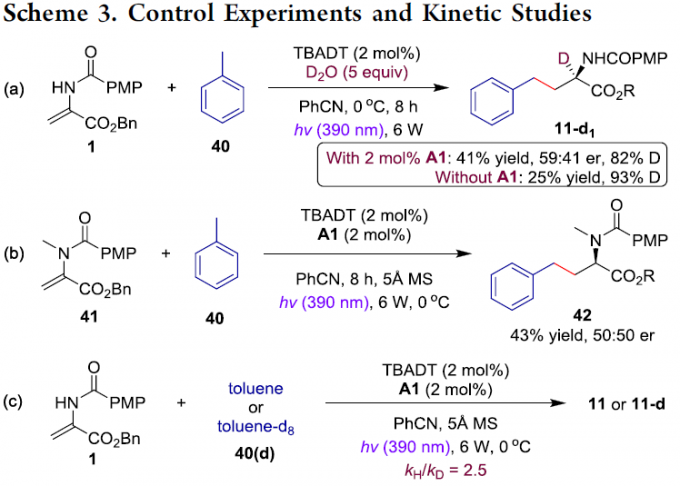
为了进一步了解反应的机理,作者进行了相关的对照实验(Scheme 3)。首先,在N-酰基脱氢丙氨酸苄基酯1和甲苯40的反应中加入过量的D2O,当存在(S)-A1可获得82%的氘代产物11–d1,当无(S)-A1时可获得93%的氘代产物11–d1。这些结果表明,反应产物碳氢键的形成可能经历碳负离子中间体质子化的过程,同时对映体选择性显着降低表明水可作为质子穿梭剂参与非对映选择性的质子转移过程,但速度较慢。其次,N-酰基脱氢丙氨酸41也可与甲苯40反应,获得产物42,但对映选择性完全消失,从而表明酰胺中的N-H键可能与手性螺磷酸(S)-A1之间存在氢键相互作用,以控制对映选择性。此外,通过1和40(d)的动力学研究表明(KIE,kH/kD = 2.5),TBADT介导的C(sp3)-H键裂解作为决速步骤。
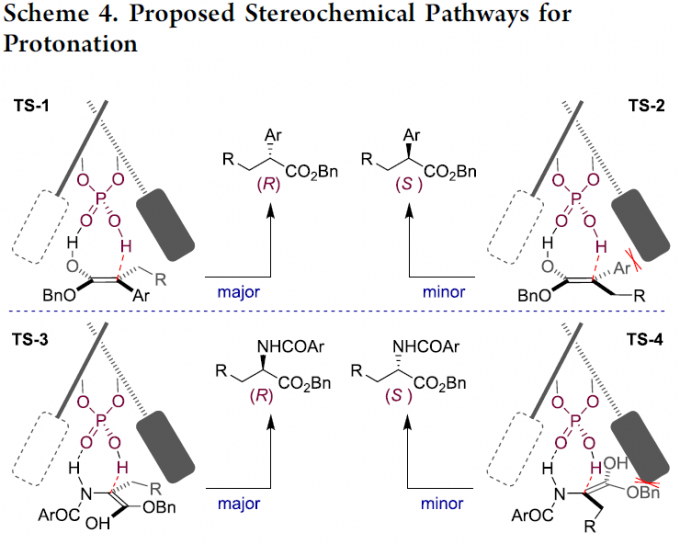
基于上述的研究,作者提出了两个可能质子化的立体化学途径(Scheme 4)。对于α-芳基酯烯酸酯,CPTS辅助的[1,3]质子移位是从具有R构型的过渡态TS-1生成最终产物,烯醇的芳基和手性螺磷酸(S)-A1的2,4,6-三异丙基苯基之间存在空间排斥不利于过渡态TS-2。对于α-氨基酯烯醇酸酯,N-H键的存在还能够充当氢键供体,以促进七元环过渡态TS-3和TS-4。对空间要求较高的苄基酯部分进行定向,以使其与(S)-A1的大取代基的相互作用减至最小。因此,有利于R构型的形成(TS-3与TS-4)。
总结
中科大汪普生课题组报道了光催化α-取代丙烯酸酯与C(sp3)-H键的不对称加成反应,其中以TBADT作为HAT催化剂,手性螺磷酸作为手性质子转移穿梭剂。同时,该反应涉及自由基/离子接力过程,如TBADT介导的HAT裂解惰性C(sp3)-H键,1,4-自由基加成,逆向攫氢反应和对映选择性质子化等。此外,该反应具有温和的反应条件、广泛的底物范围、良好的官能团耐受性等特点。
























No comments yet.