新的一年,Chemstation小编继续为学习有机化学的各位同行带来Fukuyama-Yokoshima研究组反应机理问题的详细解答的第八期。本期为新年特别加长版,小编为大家带来五道问题。
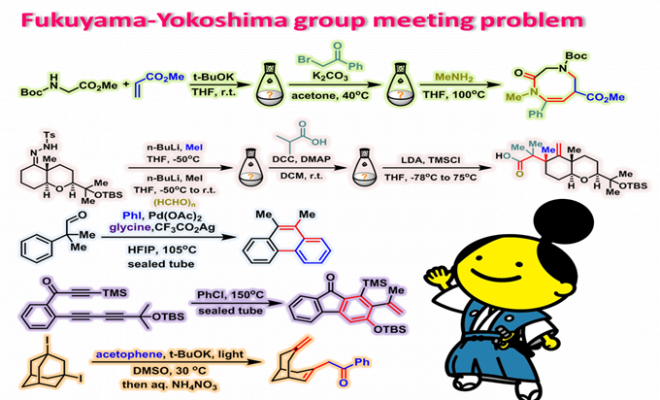
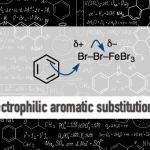
问题 1
基本文献
- [1] M. Penning, J. Christoffers, Eur. J. Org. Chem. 2012, 1809. doi: 10.1002/ejoc.201101645.
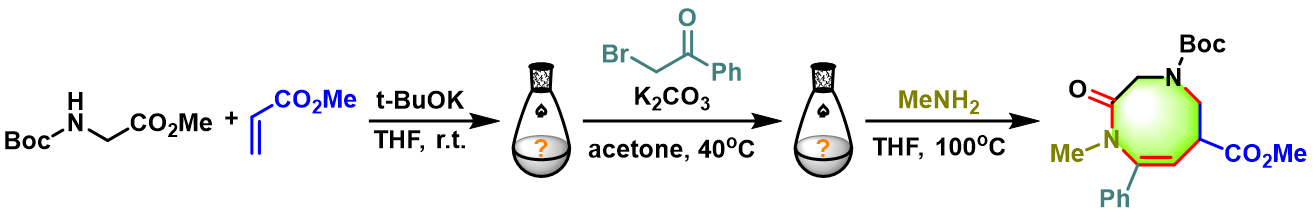
反应机理
参考文献
- [1] M. Rössle, J. Christoffers, Synlett 2006, 106. doi: 10.1055/s-2005-922759.
- [2] R. Pflantz, P. Tielmann, M. Rössle, C. Hoenke, J. Christoffers, Eur. J. Org. Chem. 2007, 3227. doi: 10.1002/ejoc.200700263.
- [3] J. Christoffers, Catal. Today 2011, 159, 96. doi: 10.1016/j.cattod.2010.06.027.
- [4] M. Rössle, T. Werner, A. Baro, W. Frey, J. Christoffers, Angew. Chem. Int. Ed. 2004, 43, 6547. doi: 10.1002/anie.200461406.
- [5] R. Pflantz, J. Sluiter, M. Krička, W. Saak, C. Hoenke, J. Christoffers, Eur. J. Org. Chem. 2009, 5431. doi: 10.1002/ejoc.200900825.
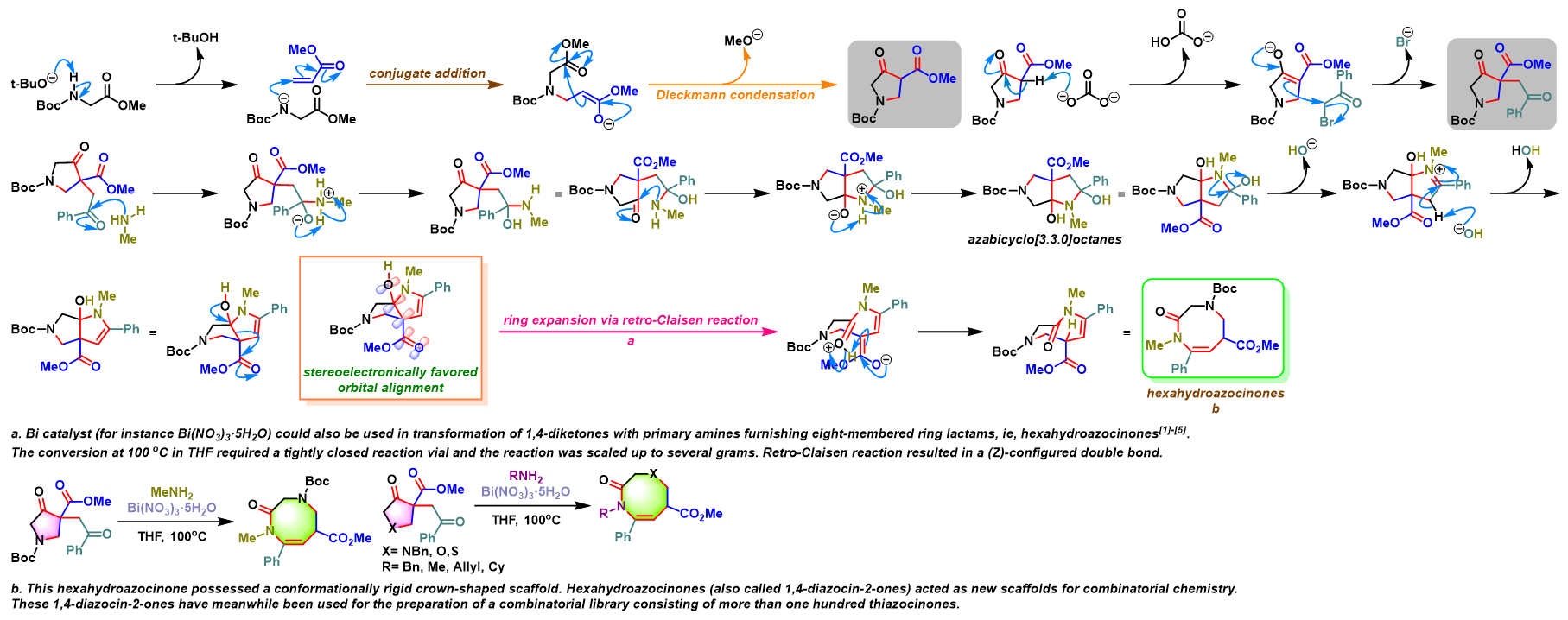
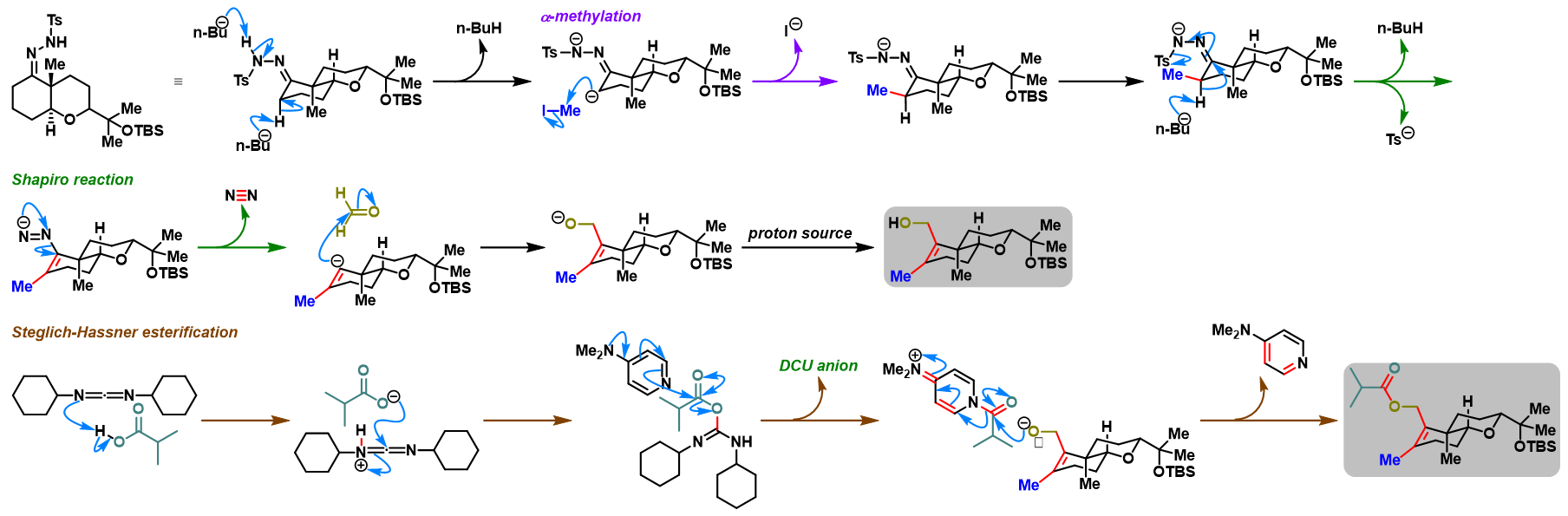
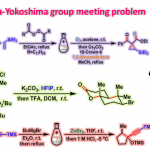
问题 2
基本文献
- [1] R. J. Sharpe, J. S. Johnson, J. Am. Chem. Soc. 2015, 137, 4968. doi: 10.1021/jacs.5b02631.
反应机理
参考文献
[1] R. E. Ireland, R. H. Mueller, A. K. Willard, J. Am. Chem. Soc. 1976, 98, 2868. doi: 10.1021/ja00426a033.问题 3
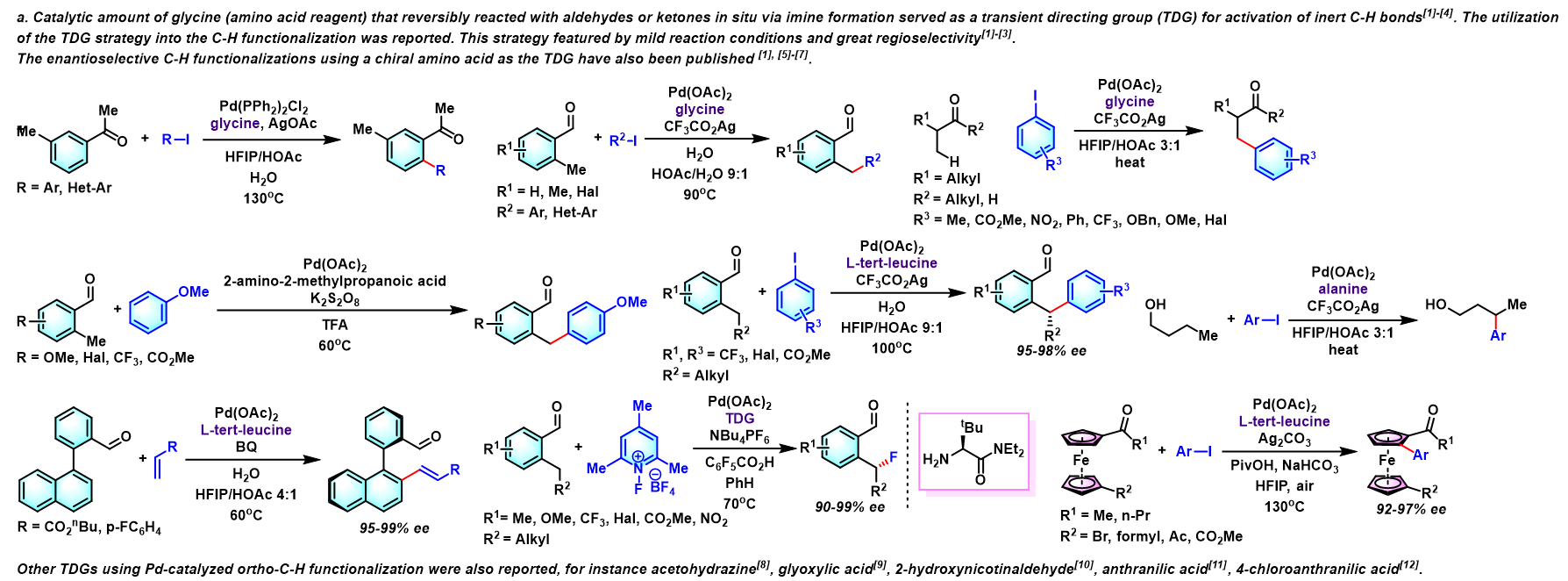
基本文献
- [1] B. Gou, H. Yang, H. Sun, J. Chen, J. Wu, L. Zhou, Org. Lett. 2019, 21, 80. doi: 10.1021/acs.orglett.8b03511.
- [2] J. Xu, Y. Liu, Y. Wang, Y. Li, X. Xu, Z. Jin, Org. Lett. 2017, 19, 1562. doi: 10.1021/acs.orglett.7b00363.
- [3] X. Liu, H. Park, J. Hu, Y. Hu, Q. Zhang, B. Wang, B. Sun, K. S. Yeung, F. Zhang, J. Yu, J. Am. Chem. Soc. 2017, 139, 888. doi: 10.1021/jacs.6b11188.
反应机理
参考文献
- [1] F. Zhang, K. Hong, T. Li, H. Park, J. Yu, Science 2016, 351, 252. doi: 10.1126/science.aad7893.
- [2] K. Yang, Q. Li, Y. Liu, G. Li, H. Ge, J. Am. Chem. Soc. 2016, 138, 12775. doi: 10.1021/jacs.6b08478.
- [3] D. Wang, S. Guo, G. Pan, X. Zhu, Y. Gao, Y. Wang, Org. Lett. 2018, 20, 1794. doi: 10.1021/acs.orglett.8b00292.
- [4] G. Xia, J. Weng, L. Liu, P. Verma, Z. Li, J, Yu, Nature Chem. 2019, 11, 571. doi: 10.1038/s41557-019-0245-6.
- [5] Q. Yao, S. Zhang, B. Zhan, B. Shi, Angew. Chem., Int. Ed. 2017, 56, 6617. doi: 10.1002/anie.201701849.
- [6] H. Park, P. Verma, K. Hong, J. Yu, Nat. Chem. 2018, 10, 755. doi: 10.1038/s41557-018-0048-1.
- [7] J. Xu, Y. Liu, J. Zhang, X. Xu, Z. Jin, Chem. Commun. 2018, 54, 689. doi: 10.1039/C7CC09273C.
- [8] F. Ma, M. Lei, L. Hu, Org. Lett. 2016, 18, 2708. doi: 10.1021/acs.orglett.6b01170.
- [9] Y. Liu, H. Ge, Nat. Chem. 2016, 9, 26. doi: 10.1038/nchem.2606.
- [10] Y. Wu, Y. Chen, T. Liu, M. D. Eastgate, J. Yu, J. Am. Chem. Soc. 2016, 138, 14554. doi: 10.1021/jacs.6b09653.
- [11] X. Chen, S. Ozturk, E. Sorensen, Org. Lett. 2017, 19, 6280. doi: 10.1021/acs.orglett.7b02906.
- [12] X. Chen, S. Ozturk, E. Sorensen, Org. Lett. 2017, 19, 1140. doi: 10.1021/acs.orglett.7b00161.
- [13] T. W. Lyons, M. S. Sanford, Chem. Rev. 2010, 110, 1147. doi: 10.1021/cr900184e.
- [14] Y. Xu, M. C. Young, C. Wang, D. M. Magness, G. Dong, Angew. Chem., Int. Ed. 2016, 55, 9084. doi: 10.1002/anie.201604268.
- [15] Y. Xu, G. Yan, Z. Ren, G. Dong, Nat. Chem. 2015, 7, 829. doi: 10.1038/nchem.2326.
- [16] Z. Ren, G. Dong, Organometallics 2016, 35, 1057. doi: 10.1021/acs.organomet.6b00185.
- [17] S. J.Thompson, D. Q. Thach, G. Dong, J. Am. Chem. Soc. 2015, 137, 11586. doi: 10.1021/jacs.5b07384.
- [18] Z. Ren, J. E. Schulz, G. Dong, Org. Lett. 2015, 17, 2696. doi: 10.1021/acs.orglett.5b01098.
- [19] J. A. Johnson, D. Sames, J. Am. Chem. Soc. 2000, 122, 6321. doi: 10.1021/ja0003223.
- [20] B. D. Dangel, K. Godula, S.W. Youn, B. Sezen, D. Sames, J. Am. Chem. Soc. 2002, 124, 11856. doi: 10.1021/ja027311p.
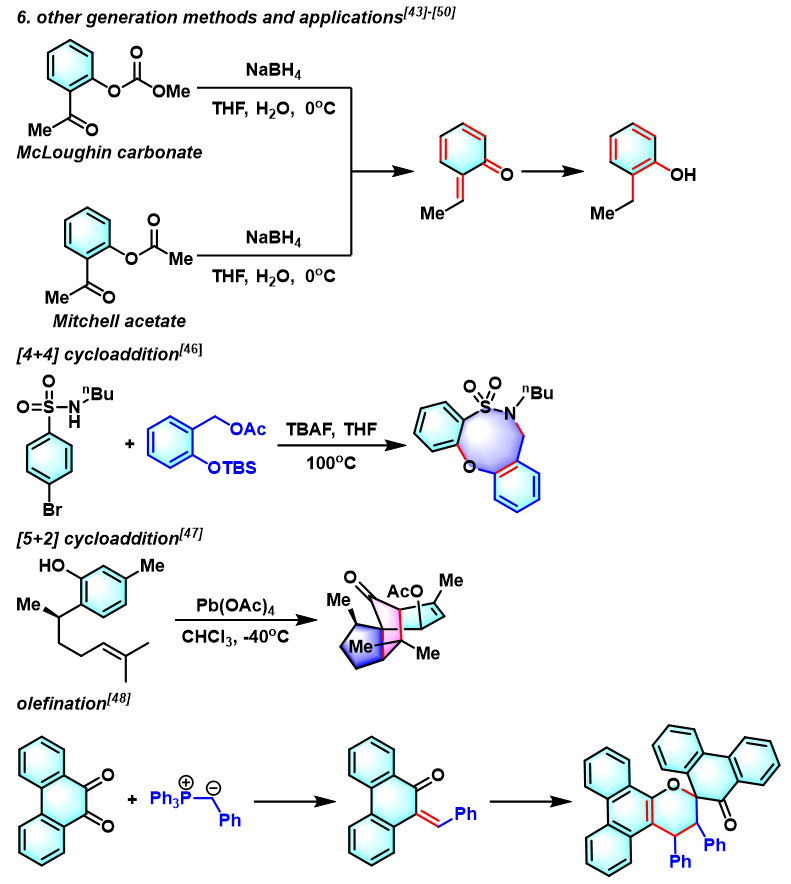
- [21] R. Zhu, L. Liu, J. Yu, J. Am. Chem. Soc. 2017, 139, 12394. doi: 10.1021/jacs.7b06851.
- [22] D. Lapointe, K. Fagnou, Chem. Lett. 2010, 39, 1118. doi: 10.1246/cl.2010.1118.
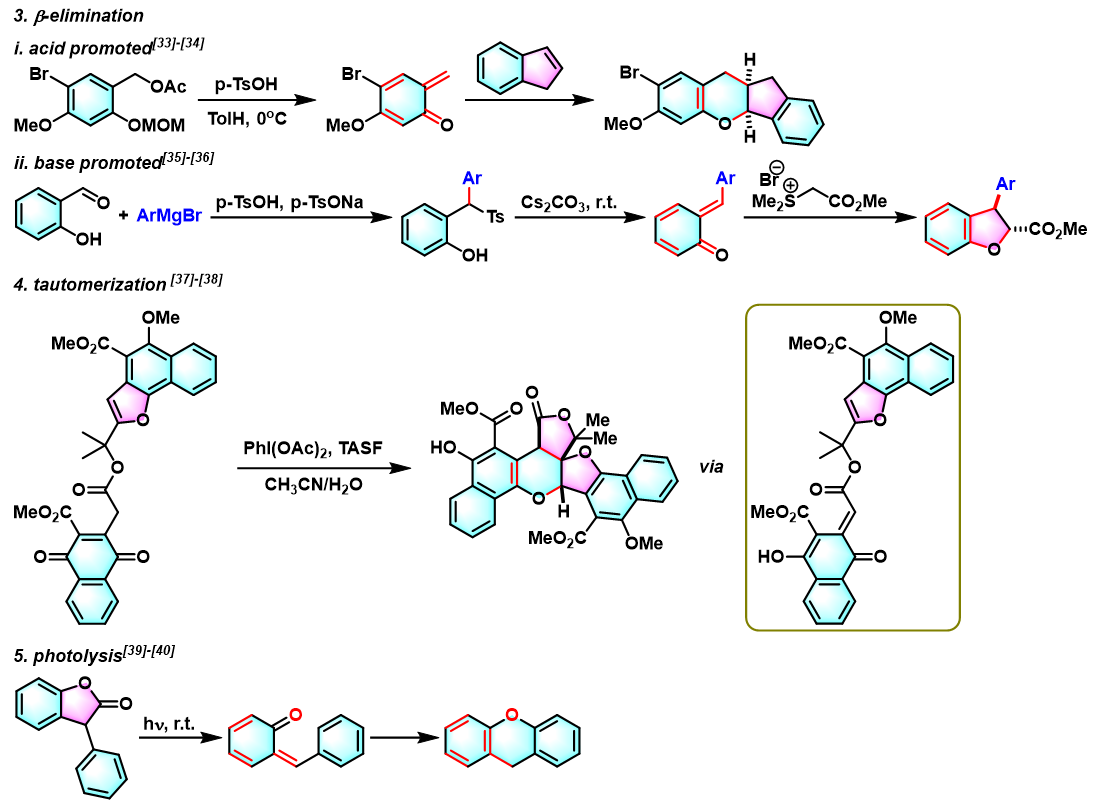
- [23] J. M.Weibel, A. Blanc, P. Pale, Chem. Rev. 2008, 108, 3149. doi: 10.1021/cr078365q.
- [24] T. Honda, M. Ushiwata, H. Mizutani, Tetrahedron Lett. 2006, 47, 6251. doi: 10.1016/j.tetlet.2006.06.142.
- [25] P. Schultheiss-Reimann, H. Kunz, Angew. Chem., Int. Ed. 1983, 22, 62. doi: 10.1002/anie.198300622.
- [26] S. Jürs, B. Werschkun, J. Thiem, Eur. J. Org. Chem. 2006, 4451. doi: 10.1002/ejoc.200600455.
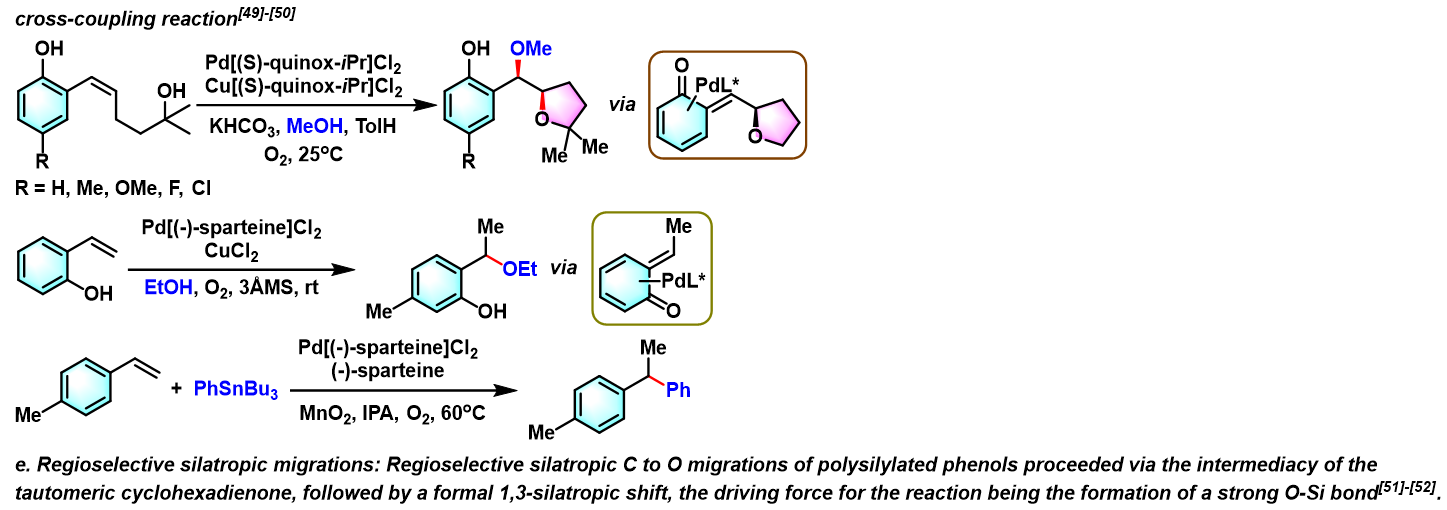
- [27] T. Fujita, I. Takahashi, M. Hayashi, J. Wang, K. Fuchibe, J. Ichikawa, Eur. J. Org. Chem. 2017, 2017, 262. doi: 10.1002/ejoc.201601406.
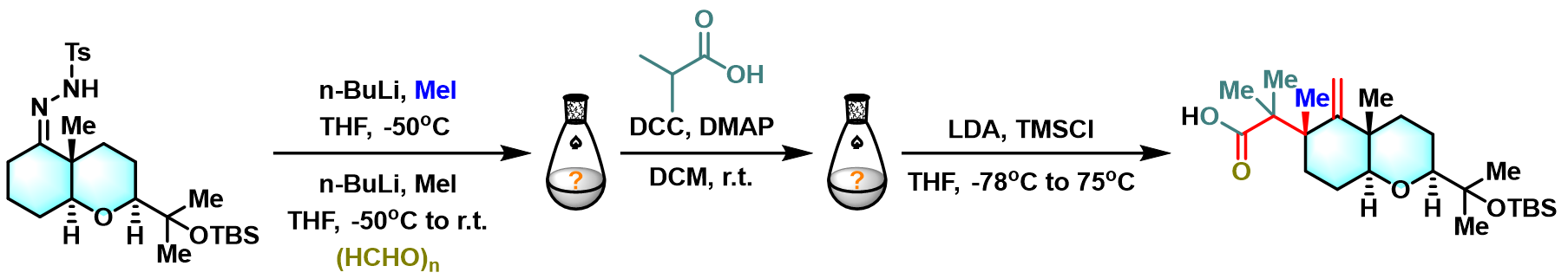
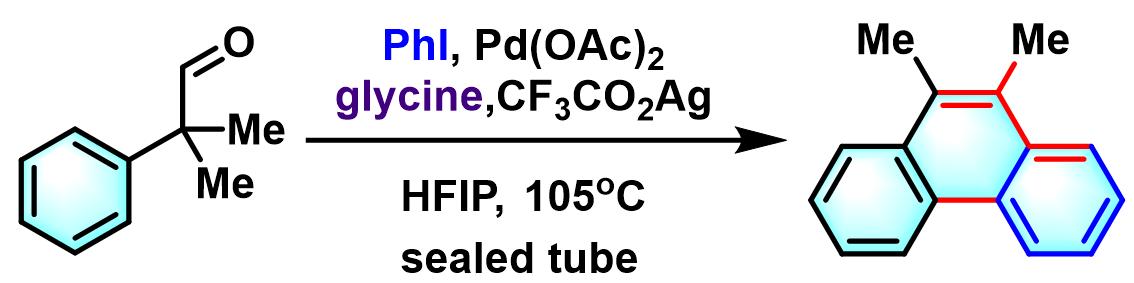
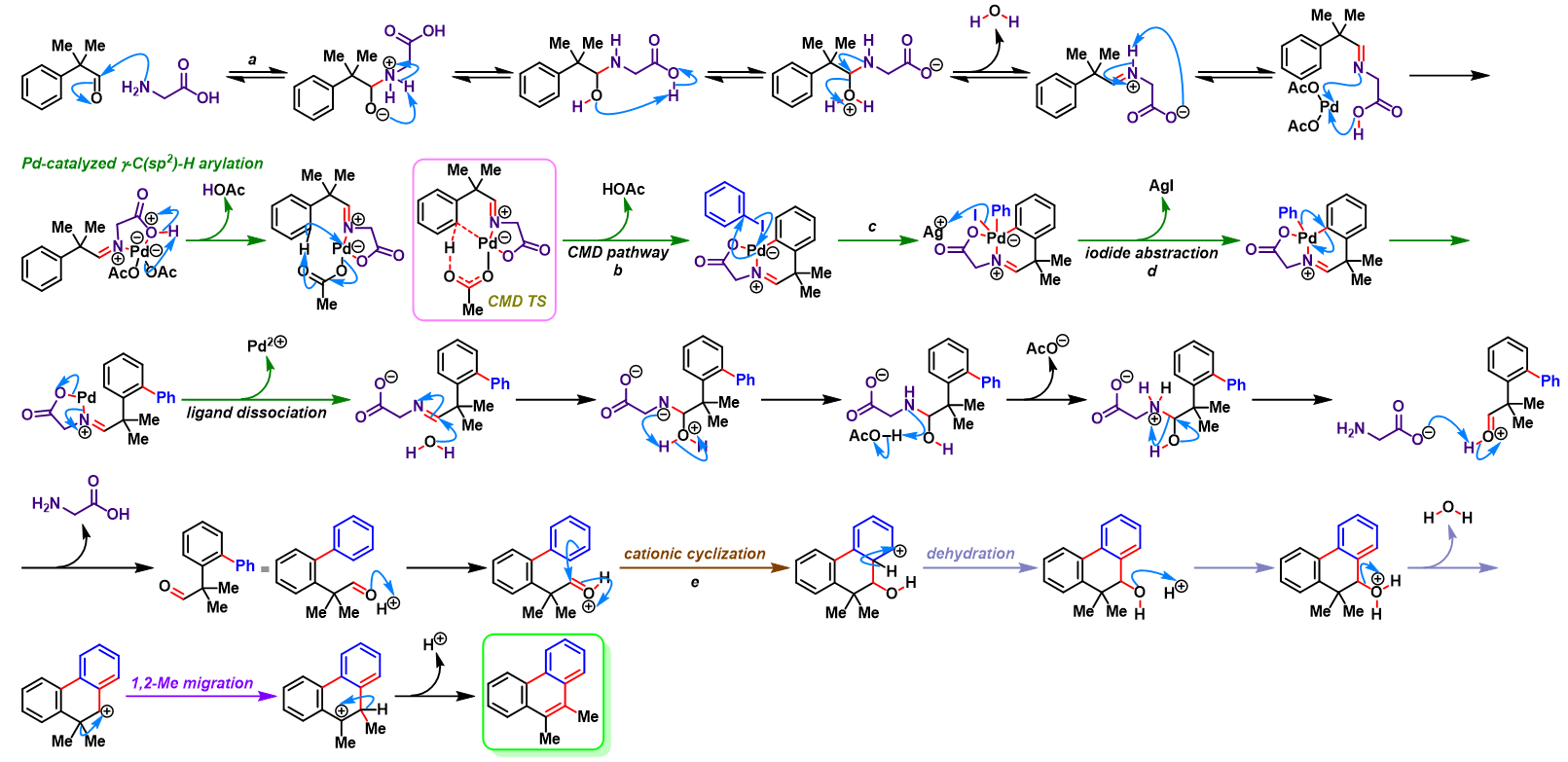
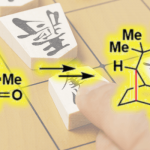
问题 4
基本文献
- [1] H. Shen, X. Xiao, T. R. Hoye, Org. Lett. 2019, 21, 1672. doi: 10.1021/acs.orglett.9b00215.
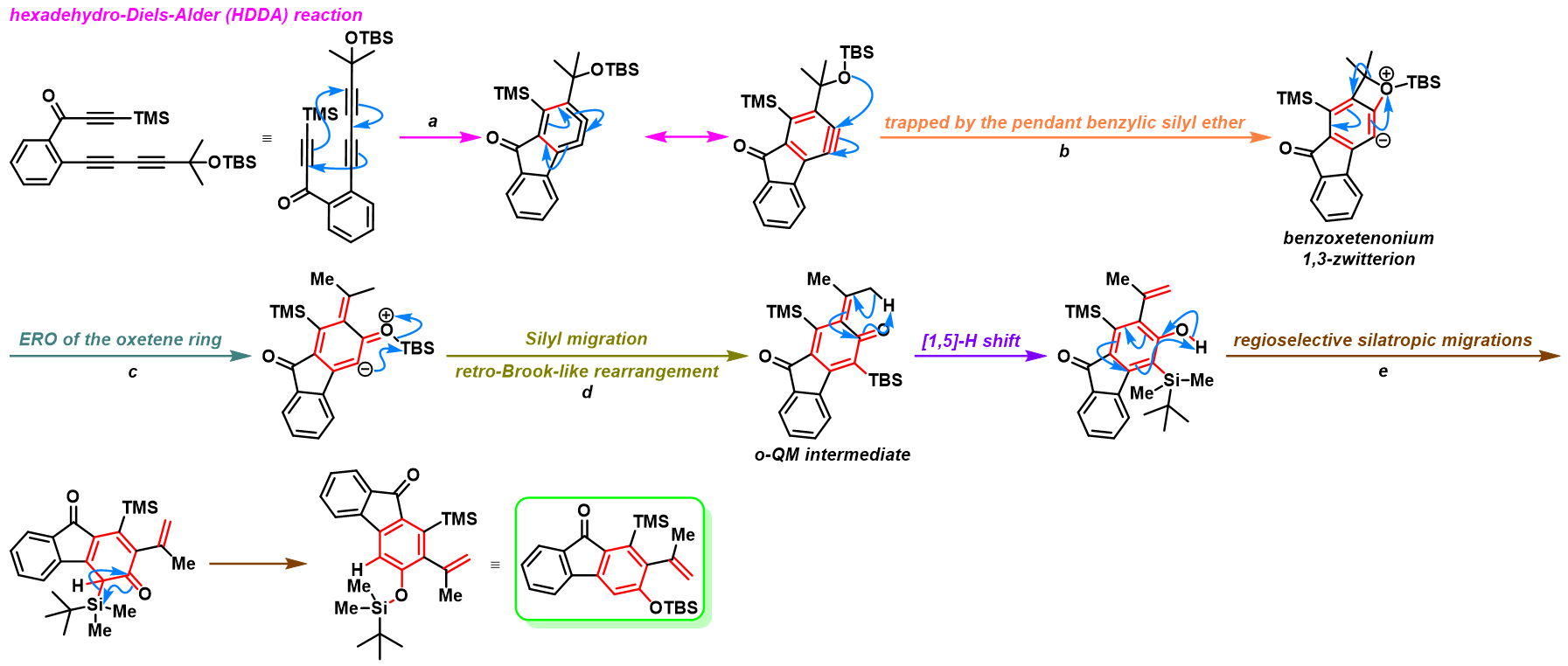
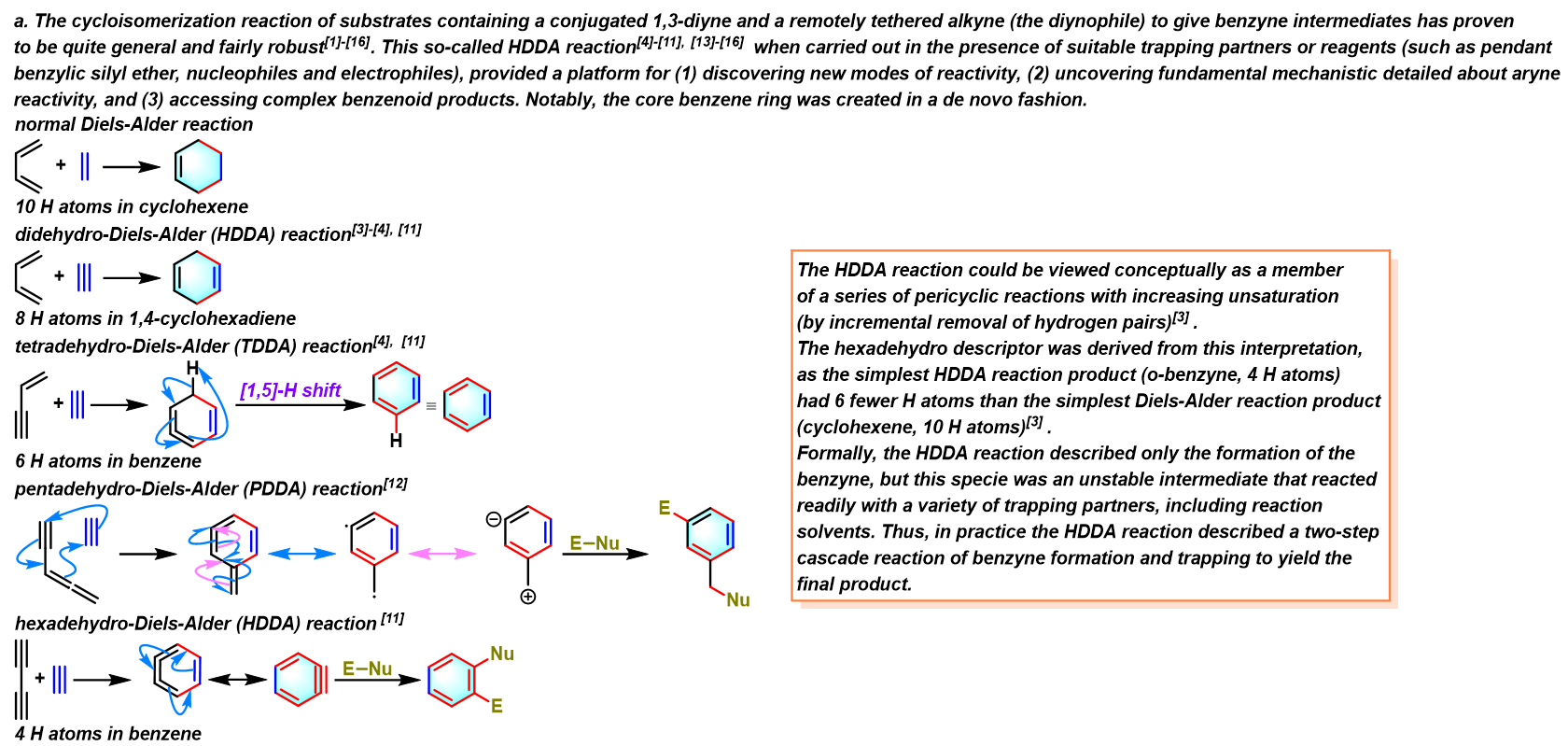
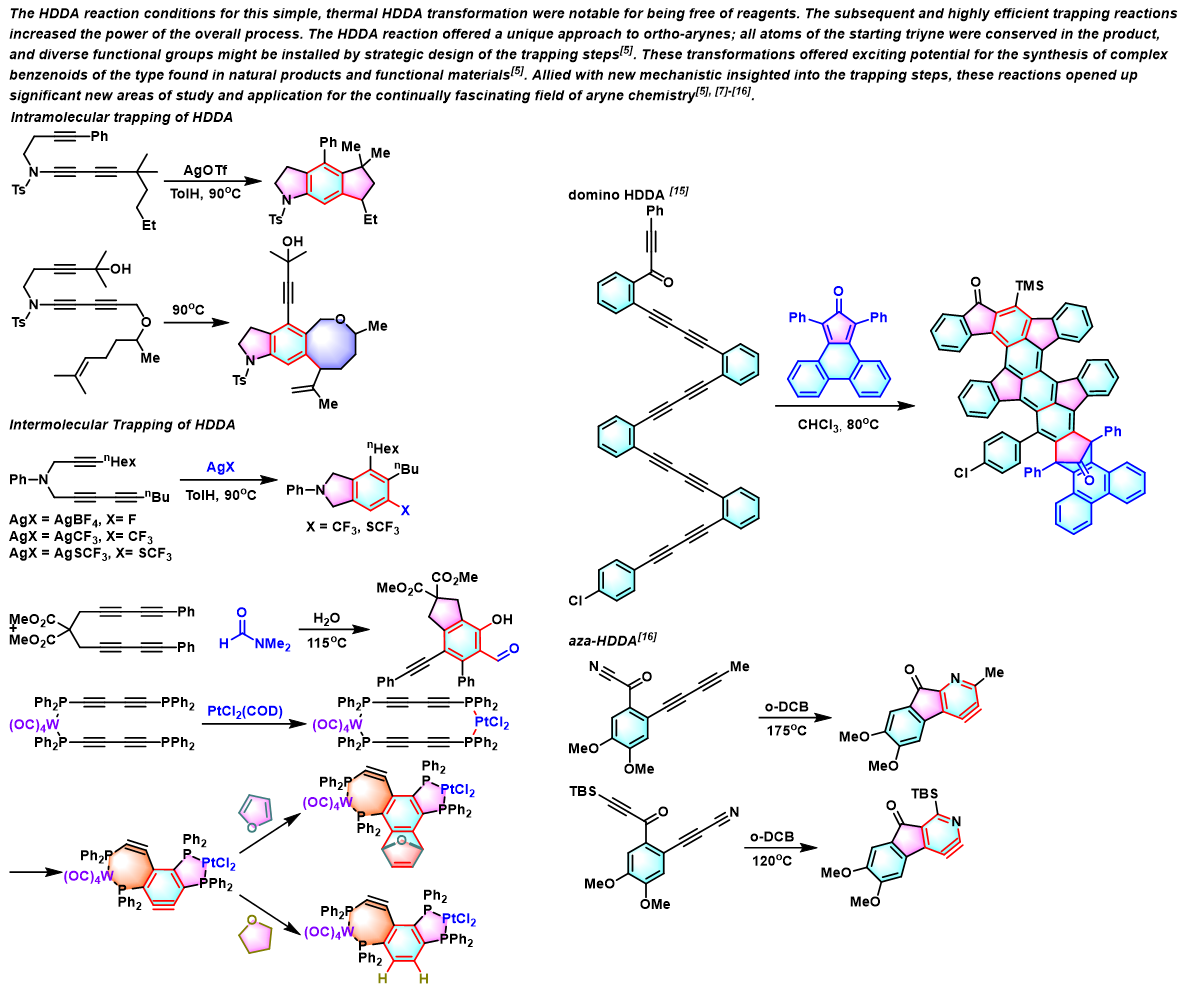
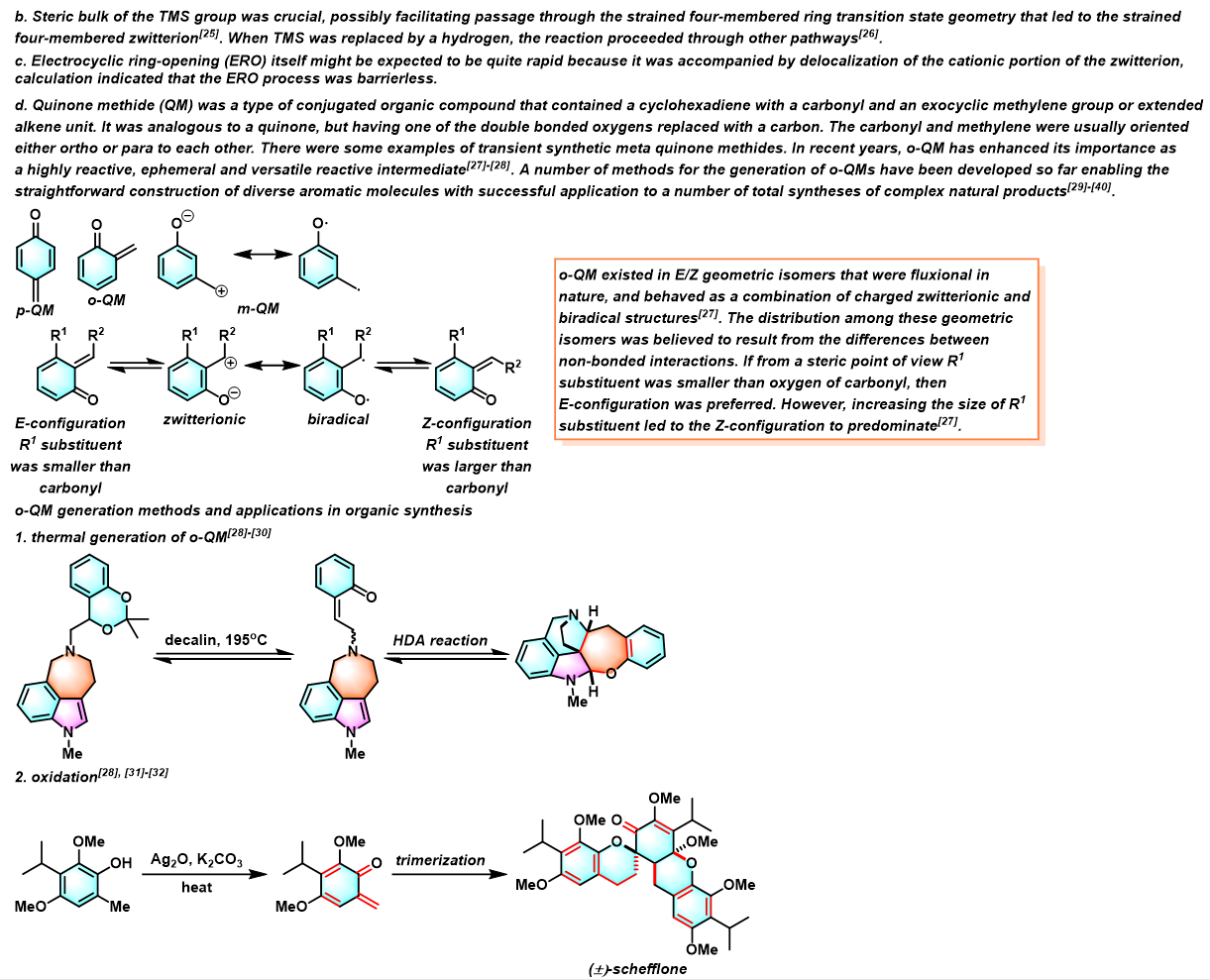
反应机理
参考文献
- [1] K. Miyawaki, R. Suzuki, T. Kawano, I. Ueda, Tetrahedron Lett. 1997, 38, 3943. doi: 10.1016/S0040-4039(97)00785-5.
- [2] A. Z. Bradley, R. P. Johnson, J. Am. Chem. Soc. 1997, 119, 9917. doi: 10.1021/ja972141f.
- [3] T. R. Hoye, B. Baire, D. Niu, P. H. Willoughby, B. P. Woods, Nature 2012, 490, 208. doi: 10.1038/nature11518.
- [4] P. Wessig, G. Müller, Chem. Rev. 2008, 108, 2051. doi: 10.1021/cr0783986.
- [5] C. Holden, M. F. Greaney, Angew. Chem. Int. Ed. Engl. 2014, 53, 5746. doi: 10.1002/anie.201402405.
- [6] A. Ajaz, A. Z. Bradley, R. C. Burrell, W. H. H. Li, K. J. Daoust, L. B. Bovee, K. J. Di Rico, R. P. Johnson, J. Org. Chem. 2011, 76, 9320. doi: 10.1021/jo201567d.
- [7] S. Y. Yun, K.Wang, N. K. Lee, P. Mamidipalli, D. Lee, J. Am. Chem. Soc. 2013, 135, 4668. doi: 10.1021/ja400477r.
- [8] R. Karmakar, P. Mamidipalli, S. Y. Yun, D. Lee, Org. Lett. 2013,15, 1938. doi: 10.1021/ol4005905.
- [9] K. Wang, S. Y. Yun, P. Mamidipalli, D. Lee, Chem. Sci. 2013, 4, 3205. doi:
10.1039/C3SC50992C. - [10] J. A. Tsui, B. T. Sterenberg, Organometallics 2009, 28, 4906. doi: 10.1021/om900578d.
- [11] O. J. Diamond, T. B. Marder, Org. Chem. Front. 2017, 4, 891. doi:
10.1039/C7QO00071E. - [12] T. Wang, R. R. Naredla, S. K. Thompson, T. R Hoye, Nature, 2016, 532, 484. doi: 10.1038/nature17429.
- [13] B. P. Woods, B. Baire, T. R. Hoye, Org. Lett. 2014, 16, 4578. doi: 10.1021/ol502131r.
- [14] Y. Hu, Y. Hu, Q. Hu, J. Ma, S. Lv, B. Liu, S. Wang, Chem. Eur. J. 2017, 23, 4065. doi: 10.1002/chem.201605785.
- [15] X. Xiao, T. R. Hoye, Nat. Chem. 2018, 10, 838. doi: 10.1038/s41557-018-0075-y.
[16] S. K. Thompson, T. R. Hoye, J. Am. Chem. Soc. 2019, 141, 19575. doi: 10.1021/jacs.9b11243. - [17] P. H. Y. Cheong, R. S. Paton, S. M. Bronner, G. Y. J. Im, N. K. Garg, K. N. Houk, J. Am. Chem. Soc. 2010, 132, 1267. doi: 10.1021/ja9098643.
- [18] R. Karmakar, S. Y. Yun, K. P. Wang, D. Lee, Org. Lett. 2014, 16, 6. doi: 10.1021/ol403237z.
- [19] J. M. Medina, J. L.Mackey, N. K. Garg, K. N. Houk, J. Am. Chem. Soc. 2014, 136, 15798. doi: 10.1021/ja5099935.
- [20] H. A. Bent, Chem. Rev. 1961, 61, 275. doi: 10.1021/cr60211a005.
- [21] I. V. Alabugin, S. Bresch, G. dos Passos Gomes, J. Phy. Org. Chem. 2015, 28, 147. doi: 10.1002/poc.3382.
- [22] I. V. Alabugin, S. Bresch, M. Manoharan, J. Phys. Chem. A 2014, 118, 3663. doi: 10.1021/jp502472u.
- [23] R. C. Haddon, Tetrahedron 1988, 44, 7611. doi: 10.1016/S0040-4020(01)86253-0.
- [24] I. V. Alabugin, M. Manoharan, J. Comp. Chem. 2007, 28, 373. doi: 10.1002/jcc.20524.
- [25] S. Gupta, Y. Lin, Y. Xia, D. J. Wink, D. Lee, Chem. Sci. 2019, 10, 2212. doi: 10.1039/C8SC04277B.
- [26] X. Xiao, B. P. Woods, W. Xiu, T. R. Hoye, Angew. Chem. Int. Ed. 2018, 57, 9901. doi: 10.1002/anie.201803872.
- [27] M. S. Singh, A. Nagaraju, N. Anand, S.Chowdhury, RSC Adv. 2014, 4, 55924. doi: 10.1039/C4RA11444B.
- [28] W. Bai, J. G. David, Z. Feng, M. G. Weaver, K. Wu, T. R. R. Pettus, Acc. Chem. Res. 2014, 47, 12, 3655. doi: 10.1021/ar500330x.
- [29] S. L. Crawley, R. L. Funk, Org. Lett. 2003, 5, 3169. doi: 10.1021/ol034407v.
- [30] J. T. J. Spence, J. H. George, Org. Lett. 2013, 15, 3891. doi: 10.1021/ol4017832.
- [31] D. Liao, H. Li, X. Lei, Org. Lett. 2012, 14, 18. doi: 10.1021/ol202641y.
- [32] D. V. Osipov, V. A. Osyanin, Y. N. Klimochkin, Synlett 2012, 23, 917. doi: 10.1055/s-0031-1290611.
- [33] A. L. Lawrence, R. M. Adlington, J. E. Baldwin, V. Lee, J. A. Kershaw, A. L. Thompson, Org. Lett. 2010, 12, 1676. doi: 10.1021/ol100138k.
- [34] P. Batsomboon, W. Phakhodee, S. Ruchirawat, P. Ploypradith, J. Org. Chem. 2009, 74, 4009. doi: 10.1021/jo900504y.
- [35] A. K. Shaikh, A. J. A. Cobb, G. Varvounis, Org. Lett. 2012, 14, 584. doi: 10.1021/ol203196n.
- [36] M. Chen, L. Cao, Z. Ye, G. Jiang, Y. Zhou, Chem. Commun. 2013, 49, 1660. doi: 10.1039/C3CC37800D.
- [37] J. P. Lumb, K. C. Choong, D. Trauner, J. Am. Chem. Soc. 2008, 130, 9230. doi: 10.1021/ja803498r.
- [38] J. P. Lumb, D. Trauner, Org. Lett. 2005, 7, 5865. doi: 10.1021/ol052472u.
- [39] S. Arumugam, V. V. Popik, J. Org. Chem. 2010, 75, 7338. doi: 10.1021/jo101613t.
- [40] A. Padwa, D. Dehm, T. Oine, G. A. Lee, J. Am. Chem. Soc. 1975, 97, 1837. doi: 10.1021/ja00840a040.
- [41] R. W. Van De Water, T. R. R. Pettus, Tetrahedron 2002, 58, 5367. doi: 10.1016/S0040-4020(02)00496-9.
- [42] N. J. Willis, C. D. Bray, Chem. Eur. J. 2012, 18, 9160. doi: 10.1002/chem.201200619.
- [43] B. J. Mcloughlin, Chem. Commun. 1969, 540. doi: 10.1039/C29690000540.
- [44] D. Mitchell, C. W. Doecke, L. A. Hay, T. M. Koenig, D. D. Wirth, Tetrahedron Lett. 1995,36, 5335. doi: 10.1016/0040-4039(95)01085-V.
- [45] R. W. Van De Water, D. J. Magdziak, J. N. Chau, T. R. R. Pettus, J. Am. Chem. Soc. 2000, 122, 6502. doi: 10.1021/ja994209s.
- [46] T. B. Samarakoon, M. Y. Hur, R. D. Kurtz, P. R. Hanson, Org. Lett. 2010, 12, 2182. doi: 10.1021/ol100495w.
- [47] J. C. Green, T. R. R. Pettus, J. Am. Chem. Soc. 2011, 133, 1603. doi: 10.1021/ja109925g.
- [48] W. W. Sullivan, D. Ullman, H. Shechter, Tetrahedron Lett. 1969, 10, 457. doi: 10.1016/S0040-4039(01)87718-2.
- [49] K. H. Jensen, J. D. Webb, M. S. Sigman, J. Am. Chem. Soc. 2010, 132, 17471. doi: 10.1021/ja108106h.
- [50] K. M. Gligorich, Y. Iwai, S. A. Cummings, M. S. Sigman, Tetrahedron, 2009, 65, 5074. doi: 10.1016/j.tet.2009.03.096.
- [51] S. A. Eastham, S. P. Ingham, M. R. Hallett, J. Herbert, P. Quayle, J. Raftery, Tetrahedron Lett. 2006, 47, 2299. doi: 10.1016/j.tetlet.2006.02.024.
- [52] W. Schön, J. Messinger, W. Solodenko, A. Kirschning, Synthesis 2012, 44, 3822. doi: 10.1055/s-0032-1316816.
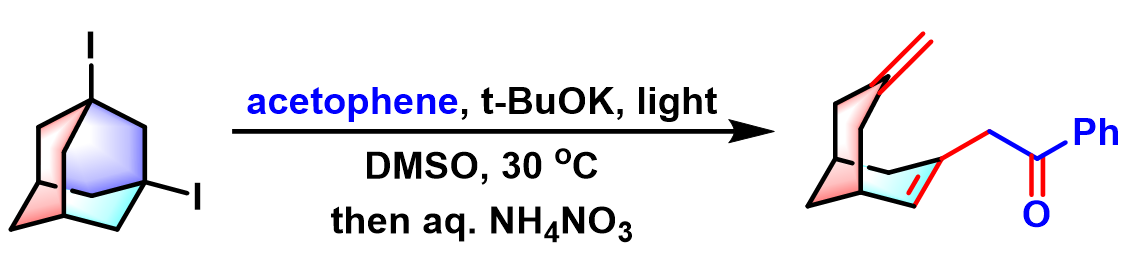
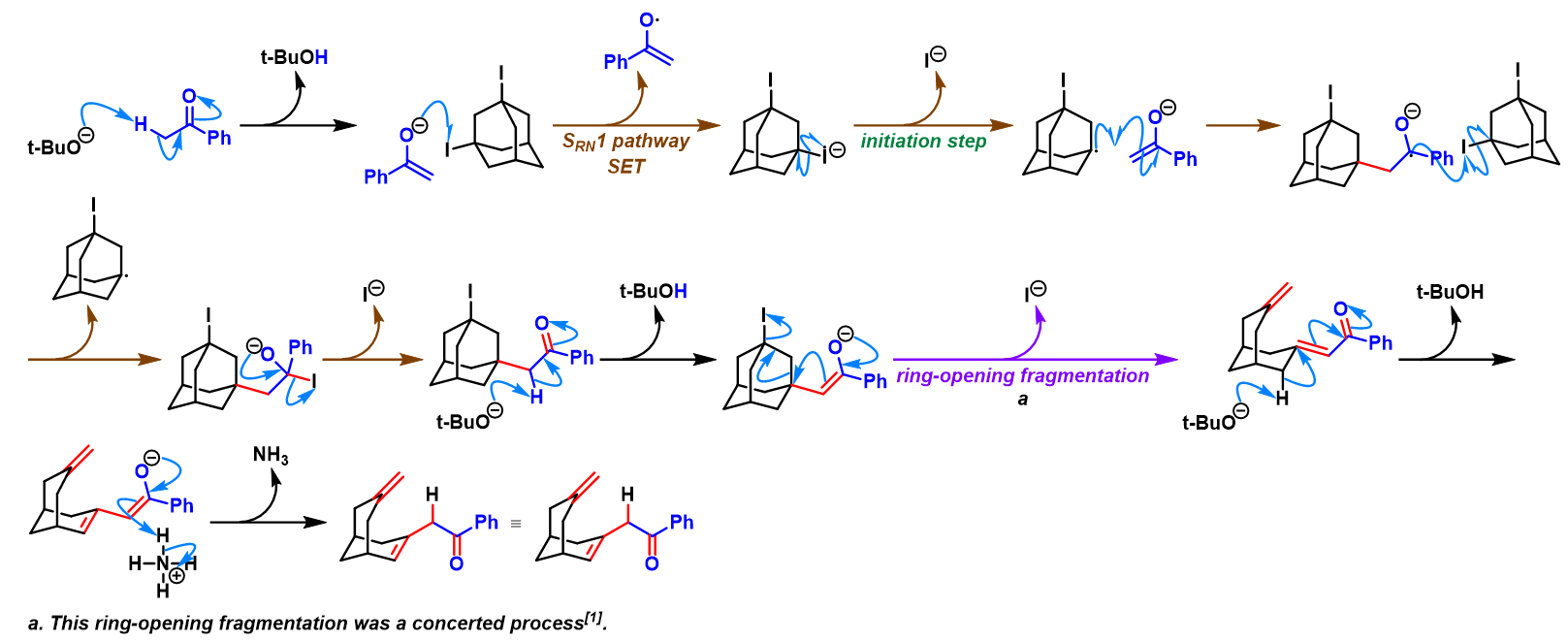
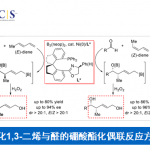
问题 5
基本文献
[1] A. E. Lukach, A. N. Santiago, R. A. Rossi, J. Org. Chem. 1997, 62, 4260. doi: 10.1021/jo9620728.反应机理
参考文献
- [1] W. Fischer, C. A. Grog, Helv. Chim. Acta 1978, 1588. doi: 10.1002/hlca.19780610510.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!























No comments yet.