本文作者:石油醚
概要
杨震:北京大学深圳研究生院常务副院长、化学生物学与生物技术学院教授以及课题组长。课题组主页:http://web.pkusz.edu.cn/yang/
教育经历
- 1978-1982年 沈阳药科大学获得学士学位(药物化学)
- 1983-1986年 沈阳药科大学获得硕士学位(药物化学)
- 1989-1992年 香港中文大学获得博士学位(导师:黄乃正院士)
工作经历
- 1992-1995年 斯克利普斯研究所博士后(Professor K. C. Nicolaou)
- 1995-1998年 斯克利普斯研究所化学系助理教授
- 1998-2001年 化学与细胞生物学研究所,研究员
- 2001-2005年 纽约VivoQuest有限公司,共同创始人兼化学主任
- 2005- 纽约XTC生物制药有限公司,化学主任
- 2001- 北京大学,化学系,长江学者,教授
- 2003- PKUSZ化学基因组学重点实验室主任
- 2006– PKUSZ化学生物与生物技术学院院长
获奖经历
- 2000 国家杰出青年科学基金(海外项目)
- 2004 国家杰出青年科学基金
- 2005 礼来科学成就奖(中国)
- 2008 The Asian Core Program Lectureship Award, the Asian Cutting-Edge Organic Chemistry programs
- 2009 北京大学宝钢优秀教师奖
- 2010 无锡制药公司生命科学杰出奖(金牌)
- 2013 “周维善”合成创新奖 (中国化学会)
- 2013 南粤百名杰出学者奖(广东省)
- 2013 深圳市自然科学一等奖
- 2014 广东省自然科学一等奖
- 2014 云南省自然科学特等奖
- 2016 国家自然科学奖二等奖
研究方向
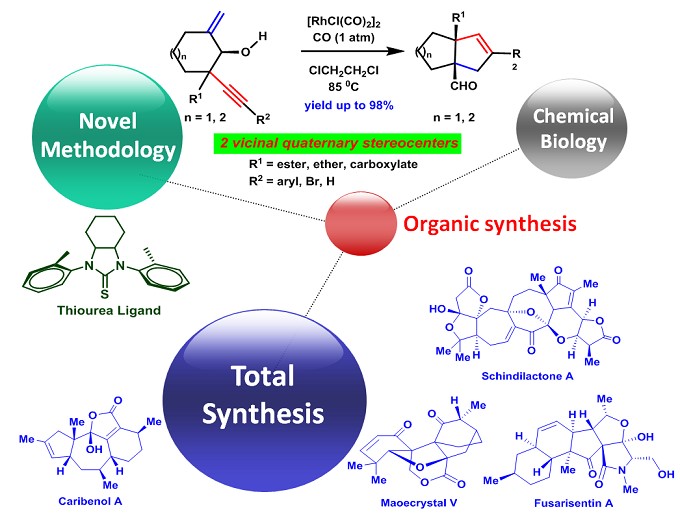
天然产物是与人类共同进化的产物,是保持生物圈内动植物共同存在的物质基础。天然产物具有的结构多样性,重要的生物学活性以及它们间的构效关系代表了天然产物在药物研发中的特殊地位。因此,天然产物必定在生命科学和新药研发中扮演着重要的角色。杨振震教授课题组围绕着具有重要活性的复杂天然产物开展全合成研究,致力于发展高效、新颖的合成方法学并应用于具有生物活性的复杂天然产物和小分子化合物的全合成,从而为后续的生物医学研究与新药研发提供研究基础(图 1)。
图 1 杨震教授课题组研究方向
1. 新的合成方法学的研究
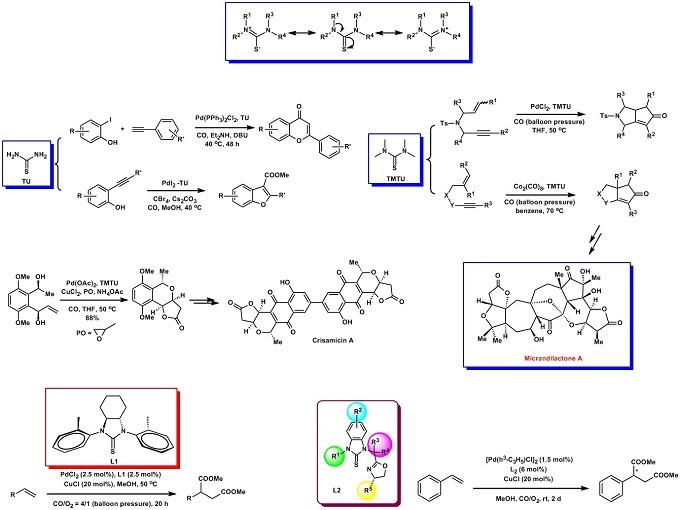
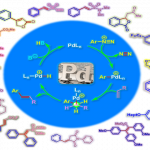
膦配体可以高效促进钯催化偶联反应的发生。虽然膦配体在钯催化的交叉偶联反应中起着重要作用,但是,膦配体通常需要在惰性气氛或干燥条件下处理,有时会在高温下遭受明显的P-C键降解,从而导致钯聚集并影响催化活性等方面的问题严重阻碍了钯催化交叉偶联反应的发展。近年来,无膦配体,例如氮杂环卡宾(NHC)和含硫配体已被用于某些金属催化的合成转化中,这为新配体促进钯催化的交叉偶联反应开辟了新的机会。
硫脲是一种在空气中很稳定的化合物。通过改变氮上的取代基可以以中性态或单阴离子或二阴离子形式与金属中心配位。因此,可以通过修饰它们的氮取代基来改变它们的物理和化学性质去催化化学家所设计的反应1-8。杨震教授课题组最近合成了两种类型的硫脲L1和L2,它们可有效地应用于钯催化羰基化反应和交叉偶联反应(图 2)。
图 2 新合成方法学的研究
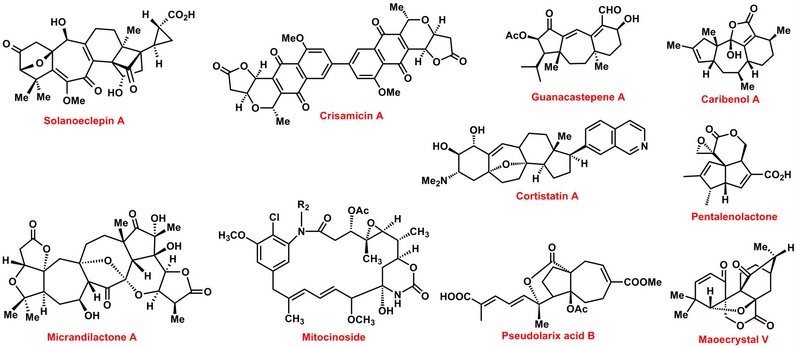
2. 全合成9-19
全合成的目的是通过一系列反应达到目标分子。因此,成功的全合成将在很大程度上取决于
(1)正确选择的目标分子;
(2)精心设计的综合策略;
(3)有效运用的综合战术。
杨震教授小组目前涉及两种有趣且具有挑战性的天然产物的全合成,以此作为合成目标,为学生提供了充分的机会来发现和创造自己的化学之美。 以下天然产物被举例说明了目前在实验室中进行的合成靶标的实例(图 3)。
图 3 全合成
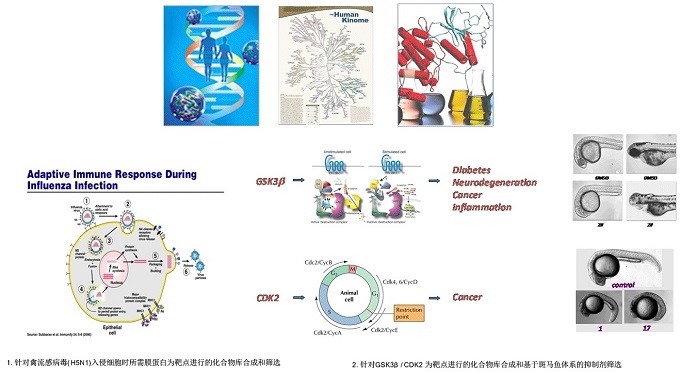
3. 化学生物学20, 21
化学遗传学是一种研究方法,它利用小分子直接实时改变蛋白质的工作方式,而不是通过操纵它们的基因来间接改变蛋白质的工作方式。它被用于识别哪些蛋白质调节不同的生物过程,了解蛋白质如何发挥其生物学功能的分子细节,以及识别可能具有医疗价值的小分子。杨震教授课题组对于禽流感病毒(H5N1)入侵细胞时所需膜蛋白为靶点筛选以及GSK3β/COK2等方面化学生物学的研究(图 4)。
图 4 化学生物学
其他
Chem-Station对杨震教授做了题为“构建全碳手性中心・复杂天然产物的全合成ー杨震 教授”的专访(图 5)。
图 5 杨震教授专访(图来自Chem-Station)
参考文献
- [1] Li, J.; Shi, L.-L.; Chen, J.; Gong, J.; Yang, Z., Thioureas as Ligands in Organometallic Reactions. Synthesis 2014, 46 (15), 2007-2023, doi:10.1055/s-0034-1378209.
- [2] Wang, Y.; Xu, L.; Yu, R.; Chen, J.; Yang, Z., CoBr2–TMTU–zinc catalysed-Pauson–Khand reaction. Chemical Communications 2012, 48 (66), 8183-8185, doi:10.1039/C2CC17971G.
- [3] Wu, N.; Deng, L.; Liu, L.; Liu, Q.; Li, C.; Yang, Z., Reverse Regioselectivity in the Palladium(II) Thiourea Catalyzed Intermolecular Pauson–Khand Reaction. Chem. Asian. J. 2013, 8 (1), 65-68, doi:10.1002/asia.201200783.
- [4] Gao, Y.-X.; Chang, L.; Shi, H.; Liang, B.; Wongkhan, K.; Chaiyaveij, D.; Batsanov, A. S.; Marder, T. B.; Li, C.-C.; Yang, Z.; Huang, Y., A Thiourea-Oxazoline Library with Axial Chirality: Ligand Synthesis and Studies of the Palladium-Catalyzed Enantioselective Bis(methoxycarbonylation) of Terminal Olefins. Adv. Synth. Catal. 2010, 352 (11‐12), 1955-1966, doi:10.1002/adsc.201000070.
- [5] Liu, J.; Wang, H.; Zhang, H.; Wu, X.; Zhang, H.; Deng, Y.; Yang, Z.; Lei, A., Identification of a Highly Efficient Alkylated Pincer Thioimido–Palladium(II) Complex as the Active Catalyst in Negishi Coupling. Chem. Eur. J. 2009, 15 (17), 4437-4445, doi:10.1002/chem.200802238.
- [6] Xiao, Q.; Wang, W.-H.; Liu, G.; Meng, F.-K.; Chen, J.-H.; Yang, Z.; Shi, Z.-J., Direct Imidation to Construct 1H-Benzo[d]imidazole through PdII-Catalyzed CH Activation Promoted by Thiourea. Chem. Eur. J. 2009, 15 (30), 7292-7296, doi:10.1002/chem.200900154.
- [7] Mingji, D.; Liang, B.; Wang, C.; You, Z.; Xiang, J.; Dong, G.; Chen, J.; Yang, Z., A Novel Thiourea Ligand Applied in the Pd-Catalyzed Heck, Suzuki and Suzuki Carbonylative Reactions. Adv. Synth. Catal. 2004, 346 (13‐15), 1669-1673, doi:10.1002/adsc.200404165.
- [8] Dai, M.; Wang, C.; Dong, G.; Xiang, J.; Luo, T.; Liang, B.; Chen, J.; Yang, Z., Development of Thiourea-Based Ligands for the Palladium-Catalyzed Bis(methoxycarbonylation) of Terminal Olefins. Eur. J. Org. Chem. 2003, 2003 (22), 4346-4348, doi:10.1002/ejoc.200300543.
- [9] Liang, X.-T.; Chen, J.-H.; Yang, Z., Asymmetric Total Synthesis of (−)-Spirochensilide A. J. Am. Chem. Soc. 2020, 142 (18), 8116-8121, doi:10.1021/jacs.0c02522.
- [10] Qu, Y.; Wang, Z.; Zhang, Z.; Zhang, W.; Huang, J.; Yang, Z., Asymmetric Total Synthesis of (+)-Waihoensene. J. Am. Chem. Soc. 2020, 142 (14), 6511-6515, doi:10.1021/jacs.0c02143.
- [11] Yan, Z.; Zhao, C.; Gong, J.; Yang, Z., Asymmetric Total Synthesis of (−)-Guignardones A and B. Org. Lett. 2020, 22 (4), 1644-1647, doi:10.1021/acs.orglett.0c00241.
- [12] Jiang, Y.-L.; Yu, H.-X.; Li, Y.; Qu, P.; Han, Y.-X.; Chen, J.-H.; Yang, Z., Asymmetric Total Synthesis of Pre-schisanartanin C. J. Am. Chem. Soc. 2020, 142 (1), 573-580, doi:10.1021/jacs.9b11872.
- [13] Yang, Z., The Journey of Schinortriterpenoid Total Syntheses. Acc. Chem. Res. 2019, 52 (2), 480-491, doi:10.1021/acs.accounts.8b00569.
- [14] Huang, Z.; Huang, J.; Qu, Y.; Zhang, W.; Gong, J.; Yang, Z., Total Syntheses of Crinipellins Enabled by Cobalt-Mediated and Palladium-Catalyzed Intramolecular Pauson–Khand Reactions. Angew. Chem. Int. Ed. 2018, 57 (28), 8744-8748, doi:10.1002/anie.201805143.
- [15] Zhang, P.-P.; Yan, Z.-M.; Li, Y.-H.; Gong, J.-X.; Yang, Z., Enantioselective Total Synthesis of (−)-Pavidolide B. J. Am. Chem. Soc. 2017, 139 (40), 13989-13992, doi:10.1021/jacs.7b07388.
- [16] Han, Y.-X.; Jiang, Y.-L.; Li, Y.; Yu, H.-X.; Tong, B.-Q.; Niu, Z.; Zhou, S.-J.; Liu, S.; Lan, Y.; Chen, J.-H.; Yang, Z., Biomimetically inspired asymmetric total synthesis of (+)-19-dehydroxyl arisandilactone A. Nat. Commun. 2017, 8 (1), 14233, doi:10.1038/ncomms14233.
- [17] Liu, D.-D.; Sun, T.-W.; Wang, K.-Y.; Lu, Y.; Zhang, S.-L.; Li, Y.-H.; Jiang, Y.-L.; Chen, J.-H.; Yang, Z., Asymmetric Total Synthesis of Lancifodilactone G Acetate. J. Am. Chem. Soc. 2017, 139 (16), 5732-5735, doi:10.1021/jacs.7b02561.
- [18] Li, F.; Tu, Q.; Chen, S.; Zhu, L.; Lan, Y.; Gong, J.; Yang, Z., Bioinspired Asymmetric Synthesis of Hispidanin A. Angew. Chem. Int. Ed. 2017, 56 (21), 5844-5848, doi:10.1002/anie.201700838.
- [19] Lv, C.; Yan, X.; Tu, Q.; Di, Y.; Yuan, C.; Fang, X.; Ben-David, Y.; Xia, L.; Gong, J.; Shen, Y.; Yang, Z.; Hao, X., Isolation and Asymmetric Total Synthesis of Perforanoid A. Angew. Chem. Int. Ed. 2016, 55 (26), 7539-7543, doi:10.1002/anie.201602783.
- [20] Zou, H.; Zhou, L.; Li, Y.; Cui, Y.; Zhong, H.; Pan, Z.; Yang, Z.; Quan, J., Benzo[e]isoindole-1,3-diones as Potential Inhibitors of Glycogen Synthase Kinase-3 (GSK-3). Synthesis, Kinase Inhibitory Activity, Zebrafish Phenotype, and Modeling of Binding Mode. J. Med. Chem. 2010, 53 (3), 994-1003, doi:10.1021/jm9013373.
- [21] Zhong, H.; Zou, H.; Semenov, M. V.; Moshinsky, D.; He, X.; Huang, H.; Li, S.; Quan, J.; Yang, Z.; Lin, S., Characterization and development of novel small-molecules inhibiting GSK3 and activating Wnt signaling. Mol. BioSyst. 2009, 5 (11), 1356-1360, doi:10.1039/B905752H.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




























No comments yet.