最近,中山大学药学院胡文浩教授课题组报道了通过控制亚胺Counter-Anion来控制手性的胺基甲基化方法。
氨基甲基化与其手性控制法
天然产物与医药小分子中频出的「氨基甲基基团」、因此开发一种高效的氨基甲基化方法是非常有价值的。迄今为止,已经报道了很多通过金属催化反应与自由基反应进行的氨基甲基化实例[1]。然而,催化不对称氨基甲基化的实例还是很有限。其中的代表性实例有,脯氨酸催化下的曼尼希型酮和亚胺离子的不对称氨基甲基化(图1A)[2a]。由酮和脯氨酸产生的手性烯胺(亲核试剂)通过对体系中生成的亚胺离子(亲电试剂)进行亲核攻击来产生手性产物。此外,已经报道了在其他手性胺催化剂存在下使用醛[2b]和1,3-二酮作为亲核试剂[2c]的类似的不对称氨基甲基化反应(图1B)。这些实例都是先形成手性的亲核试剂然后进行的手性诱导,因此底物就局限在了可以生成烯胺的羰基化合物上。
针对于这个问题,中山大学的胡教授课题组着眼于手性磷酸催化剂、开发出了重氮化合物与亚胺,醇或氨基甲酸酯的不对称三组分串联反应(图1B)[3]。亲电子侧的不对称控制与传统方法不同,并且可以使用其他新的亲核试剂,但亲电试剂目前探讨的还局限在可以形成氢键的稳定亚胺类化合物。此外,本方法是基于Asymmetric Counter–Anion–Directed Catalysis (ACDC)进行的手性控制,也是第一次通过这种策略实现了氨基甲基化[4]。
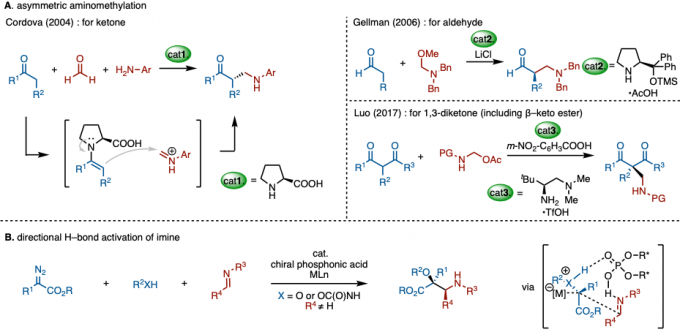
图1.(A) 常规的不对称氨基甲基化 (B) 手性磷酸与氢键介导下的亚胺参与的手性诱导
“Asymmetric Counter–Anion–Directed Aminomethylation: Synthesis of Chiral β–Amino Acids via Trapping of an Enol Intermediate”
Kang, Z.; Wang, Y.; Zhang, D.; Wu, R.; Xu, X.; Hu, W. J. Am. Chem. Soc. 2019, 141, 1473. DOI: 10.1021/jacs.8b12832
论文作者介绍

研究者:Wenhao Hu(请戳链接)
履历:
1983-1987 B.S. Sichuan University
1987-1990 M.S. Chengdu Institute of Organic Chemistry (CIOC)
1995-1998 Ph.D. Hong Kong Polytechnic University (Prof. Albert S. C. Chan)
1998-2001 Posdoc, University of Arizona (Prof. Michael P. Doyle)
2002-2006 Medicinal Chemist (Genesoft), Process Chemist (Bristol–Myers)
2006-2016 Professor, Department of Chemistry, East China Normal University
2016- Professor, School of Pharmaceutical Sciences, Sun Yat-Sen University
研究内容:通过活性中间体捕捉进行多组分反应
论文概要
胡文浩教授等人、通过ACDC策略,捕捉亚胺离子实现不对称氨基甲基化(图2A)。首先作者从手性Brønsteds酸开始进行筛选。然而,即使筛选了多种手性磷酸催化剂,依然没有发现很好的对映选择性。在这里,胡教授等人改用Lambert等人在2016年报道的含有环戊二烯基骨架的Brønsteds酸(5d, 5e)(5)、终于实现了满意的对映选择性。本反应底物适用范围广,对于α–重氮酯,对含有芳香环取代基(4b~4f)苯乙烯取代基(4g)等底物都适用。除醇和苄醇外,脂族醇(4h~4l)和带杂环的醇(4m)也同样适用。对于底物胺来说,芳香环上的取代基的变化(4n~4p)并没有影响反应的进行(图2B)。此外,4可以进一步衍生为α-羟基-β-氨基酸或α-羟基-β-内酰胺。作者通过实验结果与DFT的计算结果推测出该反应的反应机理如图2C所示。首先,1与Pd反应形成卡宾中间体Ⅰ。Ⅰ被醇亲核进攻,然后发生Pd离去与质子转移形成烯醇Ⅱ。另一方面、3在5d共存下很容易的发生甲醇离去产生离子对Ⅲ。该Ⅲ的亚胺离子与烯醇Ⅱ进行Mannich型反应最终生成产物4。通过DFT推断该反应的机理的详细内容请参照原论文。
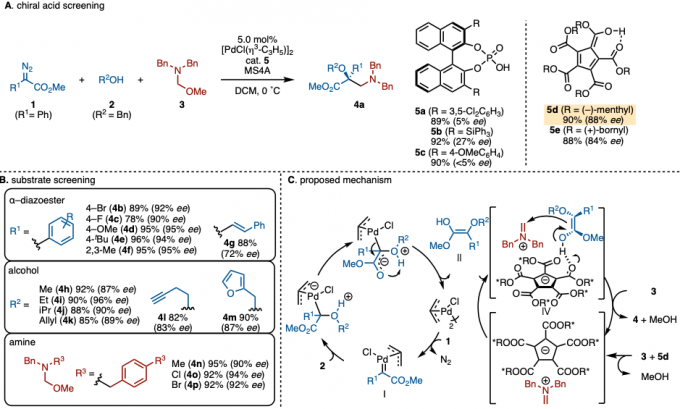
图2. (A) 手性磷酸试剂探讨 (B) 底物适用范围 (C) 假定的反应机理
综上、通过使用手性Brønsteds酸5d实现了高对映选择性的氨基甲基化。很期待今后本反应在药物小分子合成与天然产物全合成上的应用。
参考文献
- Selected examples see: (a) Seayad, A.; Ahmed, M.; Klein, H.; Jackstell, R.; Gross, T.; Beller, M. Science 2002, 297, 1676. DOI: 1126/science.1074801(b) Remeur, C.; Kelly, C. B.; Patel, N. R.; Molander, G. A. ACS Catal. 2017, 7, 6065. DOI: 10.1021/acscatal.7b01973 ほぼ同時期に不斉反応ではないが、類似反応が報告された(c) Zhang , Y.; Yu, B.; Gao, B.; Zhang, T.; Huang, H. Org. Lett. 2019, 21, 535. DOI:10.1021/acs.orglett.8b03847(d) Fujii, S.; Konishi, T.; Matsumoto, Y.; Yamaoka, Y.; Takasu, K.; Yamada, K. J. Org. Chem. 2014, 79, 8128. DOI: 10.1021/jo501332j
- (a) Ibrahem, I.; Casas, J.; Cordova, A. Angew. Chem., Int. Ed. 2004, 43, 6528. DOI: 10.1002/anie.200460678(b) Chi, Y.; Gellman, S. H. J. Am. Chem. Soc. 2006, 128, 6804. DOI: 10.1021/ja061731n(c) You, Y.; Zhang, L.; Cui, L.; Mi, X.; Luo, S. Angew. Chem., Int. Ed. 2017, 56, 13814. DOI: 10.1002/anie.201707005
- Selected examples see (a) Hu, W. H.; Xu, X. F.; Zhou, J.; Liu, W. J.; Huang, H. X.; Hu, J.; Yang, L. P.; Gong, L. Z. J. Am. Chem. Soc.2008, 130, 7782. DOI: 10.1021/ja801755z (b) Jiang, J.; Xu, H.-D.; Xi, J.-B.; Ren, B.-Y.; Lv, F.-P.; Guo, X.; Jiang, L.-Q.; Zhang, Z.-Y.: Hu, W. H. J. Am. Chem. Soc. 2011, 133, 8428. DOI: 10.1021/ja201589k
- (a) Phipps, R.; Hamilton, G.; Toste, F. D. Nat. Chem.2012, 4, 603. DOI: 10.1038/nchem.1405(b) Mahlau, M.; List, B. Angew. Chem., Int. Ed. 2013,52, 518 DOI: 10.1002/anie.201205343(c) Brak, K.; Jacobsen, E. N. Angew. Chem., Int. Ed. 2013, 52, 534. DOI: 10.1002/anie.201205449
- Gheewala, C. D.; Collins, B. E.; Lambert. Science 2016, 351, 961. DOI: 1126/science.aad0591
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!






















No comments yet.