本文翻译自日文版化学空间: 友岡 克彦 Katsuhiko Tomooka 原作者:cosine
翻译:Alberto Caeiro,校对:Hu Hao
友岡 克彦(Katsuhiko Tomooka),日本有机合成化学家,现为日本九州大学先导物质化学研究所教授。图片:实验室介绍。
经历
- 1988, Ph. D., Keio University (庆应义塾大学)
- 1988, Research assistant, Tokyo Institute of Technology (东京工业大学)
- 1991-1993, Postdoctoral fellow, Stanford University
- 1998, Assistant professor, Tokyo Institute of Technology
- 2007-present, Professor, Kyushu University (九州大学)
- 1999-2000, Visiting Assistant Professor, Kyoto University (京都大学)
获奖经历
- 1988, 井上研究奖励奖
- 1996, 有机合成化学协会 Eisai研究计划奖
- 1996, 有机合成化学奖励奖
- 2001, Synthesis-Synlett Journal Award
- 2009, Asian Core Program Lectureship Award (Korea)
- 2010, Asian Core Program Lectureship Award (Singapore)
- 2010, 有机合成化学协会 Astellas制药与生命科学奖
- 2010, 日本化学会 学会奖
- 2012, 长濑研究振兴奖
- 2014, Asian Core Program Lectureship Award (Hong Kong)
- 2015, Asian Core Program Lectureship Award (China)
- 2016, Asian Core Program Lectureship Award (Taiwan)
- 2019, 有机合成化学协会奖
工作介绍
1. Development of Novel Carbanion Rearrangement
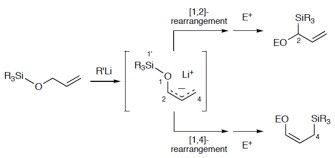
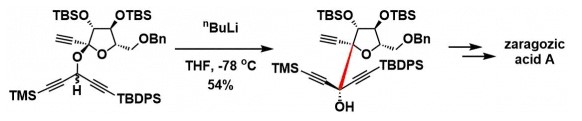
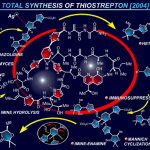
Tomooka教授致力于开发碳负离子的重排反应,并积极将其应用于天然产物的合成中。如利用立体选择性的[1,2]-wittig反应,实现了Zaragozic acid A的全合成[1a];以及选择性的Brook重排反应研究[1b]。
Brook rearrangement
[1,2]-Wittig rearrangement & total synthesis of Zaragozic acid A
2. Nonclassical chiral molecules
与碳原子中心手性不同,Tomooka教授对硅原子中心手性和平面手性有极大研究兴趣。
Planar chiral ether & chiral silicon center
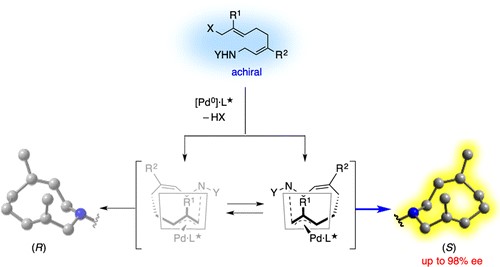
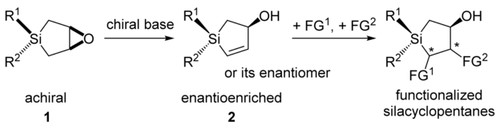
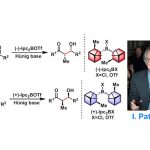
Tomooka教授通过Pd催化烯丙基取代反应,实现了含有平面手性的环状酰胺的合成[2]。早期Tomooka教授通过手性辅基策略实现了手性硅烷醇的合成[3a],近期通过消旋环氧化物的不对称β-消除反应实现手心中心的引入,合成了手性硅杂环戊烷[3b]。
Pd-Catalyzed Enantioselective Synthesis of Planar-Chiral Cyclic Amides
Asymmetric synthesis of chiral silanols
Enantioselective synthesis of silacyclopentanes via β-elimination of epoxides
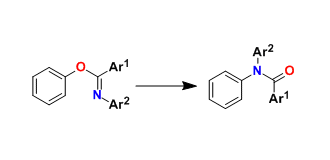
3. Nucleophilic substitution reactions on nitrogen
一般来说,氮原子是难以被亲核进攻的。Tomooka教授使用强亲核性的磷负离子和具有优秀离去基团磺酰胺的组合,实现了N原子上的亲核取代反应{4}。
Nucleophilic substitution reactions on nitrogen
4. Convenient synthesis of strained cycloalkyne
Tomooka教授利用Nicholas反应,实现了环状张力炔烃的合成,合成的产物可作为Click反应底物,用于生物正交实验中[5]。
Synthesis of strained cycloalkyne
参考文献
- [1] a. Tomooka, K. Angew. Chem. Int. Ed. 2000, 39, 4502. DOI: 10.1002/1521-3773(20001215) 39:24<4502::AID-ANIE4502>3.0.CO;2-K; b. Tomooka, K. Angew. Chem. Int. Ed. 2006, 45, 2235. DOI: 10.1002/anie.200503734.
- [2] a. Tomooka, K. J. Am. Chem. Soc. 2005, 127, 12182. DOI: 10.1021/ja053347g; b. Tomooka, K. J. Am. Chem. Soc. 2015, 137, 7294. DOI: 10.1021/jacs.5b04340; c. Tomooka, K. Heterocycles 2019, 99, 856. DOI: 10.3987/COM-18-S(F)92.
- [3] a. Tomooka, K. J. Am. Chem. Soc. 2000, 122, 408. DOI: 10.1021/ja993295t; b. Tomooka, K. Angew. Chem. Int. Ed. 2016, 55, 5814. DOI: 10.1002/anie.201511728; For a review, see: 井川和宜、友岡克彦 化学 2017, 72, 12. [PDF].
- [4] Tomooka, K. J. Am. Chem. Soc. 2012, 134, 19358. DOI: 10.1021/ja309642r.
- [5] Tomooka, K. Angew. Chem. Int. Ed. 2015, 54, 1190. DOI: 10.1002/anie.201409910.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




























No comments yet.