2022年2月2日,东京大学加藤英明(Hideaki E. Kato)副教授课题组在专业杂志Cell上在线发表了题为 「Structural basis for channel conduction in the pump-like channelrhodopsin ChRmine」的科技论文,该研究确定了ChRmine的三维结构,并且成功地开发出三种ChRmine变异体应用于先进的光遗传学实验。
https://doi.org/10.1016/j.cell.2022.01.007
01
—
研究亮点
1. ChRmine是一种通过光刺激转运阳离子的蛋白质,近年来备受关注,利用冷冻电镜确定了ChRmine的三维结构,阐明了ChRmine作为离子通道发挥作用的机制。
2. 利用获得的三维结构知识,创建了一种自然界中不存在的ChRmine,并将其用作分子工具,以实现更先进的光遗传学实验。
3. 该研究将加深对通道视紫红质离子转运机制多样性的认识,预计开发的修饰ChRmine将通过光遗传学为神经科学和医学的发展做出贡献。
02
—
研究概要
【背景】
许多生物,从人类到微生物,通过感光蛋白接收光,并从它们那里接收信息和能量。在感光蛋白中,“离子转运视紫红质”作为微生物的离子泵和离子通道,是一种精细的分子装置,可将光能转化为离子运输。这一特性引起了人们的注意,离子转运视紫红质已成为一种可以通过光控制特定神经细胞活动的实验工具,并已成为神经科学中必不可少的技术(光遗传学)。然而,作为光遗传学工具使用的通道视紫红质存在光电流弱、光敏性低、只能通过短波长光激活等问题。ChRmine是近年来在自然界中发现的一种通道视紫红质,作为一种光遗传学工具具有极其强大的性能,能被高离子电流、高光敏性和长波长光激活。此外,基于氨基酸序列的系统发育分析表明,虽然功能是通道型视紫红质,但氨基酸序列具有类似于Pump型视紫红质的有趣特征。然而,“ChRmine 和Pump型视紫红质有多相似?”,“如果是,为什么ChRmine可以充当离子通道?”,以及“我们能否将ChRmine改造为光遗传学工具?”等一系列未知点引起了大家的广泛兴趣。
【结果与讨论】
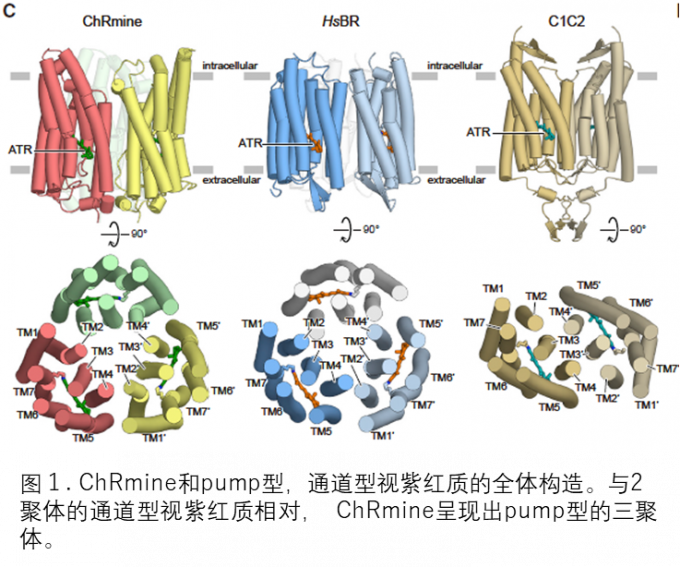
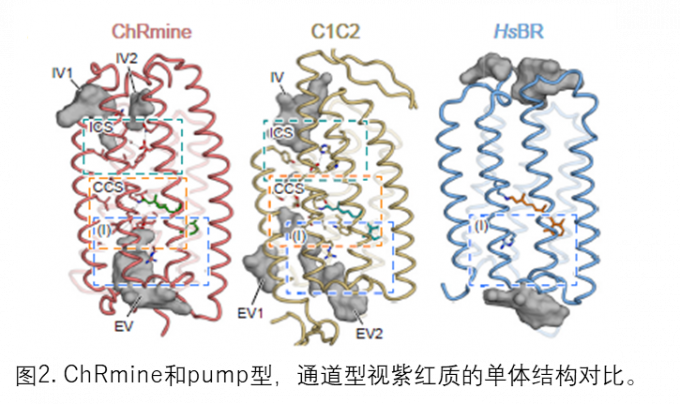
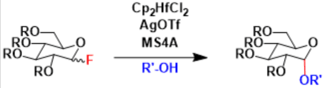
本文中,研究小组使用冷冻电子显微镜以 2.0 Å 的极高分辨率成功地确定了 ChRmine 的三维结构。结果发现:ChRmine 形成三聚体,与形成二聚体的常规通道视紫红质相比,它更类似于形成三聚体的Pump型(图 1)。 对单体结构的进一步比较表明,ChRmine 与Pump型视紫红质更相似,而不是传统的二聚体通道视紫红质(图 2)。那么,为了回答 “为什么ChRmine可以作为离子通道同时具有类似于Pump型的结构?”这个问题,研究人员仔细观察了单体的结构。 ChRmine 与Pump型视紫红质相比具有以下特征:(1)第二个跨膜螺旋在细胞内外向外塌陷,(2)第三个跨膜螺旋在膜中间展开。(3)第一个细胞外环长而蜿蜒。结果发现:ChRmine在细胞内外具有较大的离子渗透空隙(图2)。逐个传输离子的Pump型在单体中没有空隙,而迄今为止结构已经阐明的通道视紫红质在单体中具有作为离子传输路径的空隙,发挥渠道的作用。
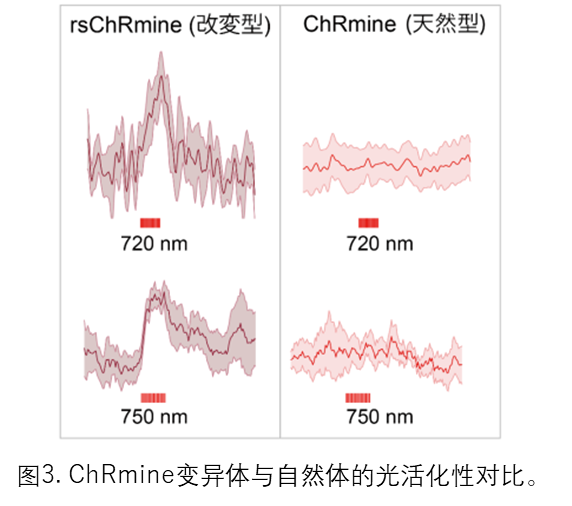
随后,利用从结构中获得的知识,为了创造一种改进ChRmine特性的光遗传学工具,ChRmine能被长波长光激活这一特征被利用。研究人员通过修饰吸收光的位点周围的氨基酸残基,成功生产出ChRmine的三种变异体:rsChRmine、hsChRmine、frChRmine(备注:这三种变异体的吸收波长不一样)。此外,通过使用这些ChRmine变异体,进行了“三色光遗传学实验”,首次实现使用三种颜色(蓝色、黄色和绿色)的光在活体小鼠大脑中同时操纵和测量多个神经细胞群。最后,研究人员证明 rsChRmine 是第一个即使在近红外光(> 740 nm)下也能被激活的通道视紫红质,证明了 rsChRmine 的出色性能(图 3)。
【展望】
未来发展 本研究首次阐明了“接近Pump型的新型通道视紫红质”ChRmine的三维结构。这些结果不仅有助于了解各种通道视紫红质的离子渗透机制,而且拓宽了通道视紫红质的结构分析方法范围,为阐明视紫红质的分子机理进化提供了新的线索。此外,在本研究中,利用获得的结构信息,研究人员创建了三种变体(rsChRmine、hsChRmine、frChRmine),进一步发挥了 ChRmine 的出色性能,特别是使用 rsChRmine 创造了新的光遗传实验。预计这些ChRmine 变体不仅将促进神经科学研究,还将用于眼疲劳疾病的基因治疗应用。
本研究由东京大学,京都大学和斯坦福大学等多家单位合作完成;第一作者为Koichiro E. Kishi博士,通讯作者为加藤英明(Hideaki E. Kato)副教授。本文受到「JST 創発的研究支援事業(課題番号:JPMJFR204S)」、「JST CREST (課題番号:JPMJCR21P3)」、「JST さきがけ(課題番号:JPMJPR1782、JPMJPR1888)」 「AMED-BINDS (課題番号:JP18am0101079)」「科学研究費助成事業(課題番号: JP20K21383、JP21H01875)」的经费支持。
03
—
作者介绍
加藤英明(Hideaki E. Kato)。东京大学理学研究科和生物学专业副教授(PI)。Kato教授致力于蛋白质结构生物学的基础研究,是蛋白质工学和蛋白质通道研究领域的青年学者。曾获2013年日本学术振兴会育志奖,2014年东京大学总长奖,2020年文部科学大臣科学者奖等重大奖项;在Nature,Science,Cell,PNAS等国际知名科学杂志发表研究型论文30余篇。其研究成果被引用3200余次,其中单篇最高引用数达670余次,h指数为22 (2022/02/20/, Google Scholar)。
————————————–华丽分割线———————————-
关注化学空间,追踪前沿方向!
文章投稿和合作请联系微信 ylyl5200
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载























No comments yet.