本文作者:杉杉
导读
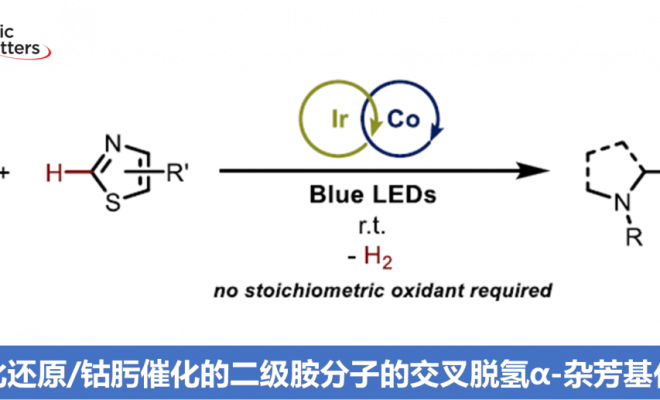
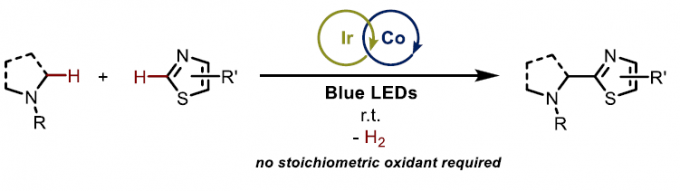
西班牙La Rioja大学 (Universidad de La Rioja)的I. Funes-Ardoiz与德国Aachen 大学 (Aachen University)的C. J. Teskey团队共同报道在蓝光辐射条件下,采用将光氧化还原铱催化剂与钴肟催化剂 (cobaloxime) 结合的双重催化策略,并通过一系列噻唑以及苯并噻唑底物物与胺分子之间的交叉脱氢偶联过程,进一步完成C(sp3)-C(sp2)键的构建。通过上述的反应策略,能够有效避免采用化学计量氧化剂,并获得中等至优良的产物收率。同时,通过DFT计算表明,Co(II)配合物在自由基加成中间体通过再芳构化 (rearomatization)步骤,形成目标产物的过程中尤为关键。
Dual Photoredox/Cobaloxime Catalysis for Cross-Dehydrogenative α-Heteroarylation of Amines
E.Bergamaschi, C.Weike, V. Mayerhofer, I. Funes-Ardoiz, C. J. Teskey,
Org. Lett. 2021, 23, 5378. doi: 10.1021/acs.orglett.1c01703.
正文
C-H键的直接官能团化方法学作为当代有机合成中研究的热点,并且,通过这一策略,能够有效避免选择有机卤代物以及各类金属有机试剂参与相关的合成转化过程。同时,这一策略具有高度的原子经济性,并符合可持续性合成 (sustainable synthesis)的需求。将两种C-H键选择性地进行交叉反应的策略,为构建C-C键最为有效的路线。尽管形式上只有H2的损失,然而,反应过程中却伴随各类废弃物的产生。例如,在脱氢偶联反应过程中,通常需要加入超化学计量 (superstoichiometric)的氧化剂,这可能降低实验操作的安全性,并形成相应的反应废弃物,甚至能够降低脱氢偶联反应方法学中的官能团兼容性。
近年来,通过光氧化还原与过渡金属催化相结合,产生的双重催化策略已取得较多的研究进展。例如,采用钴肟 (cobaloxime)与光氧化还原催化剂结合的催化策略,能够实现一系列羧酸分子的tandem脱羧与脱氢过程,并获得相应的烯基化合物[1]-[2]、芳基化合物与简单亲核试剂之间的直接官能化反应方法学[3]-[5]以及通过原位形成烯胺的脱氢过程,进行苯胺分子的合成[6]等。
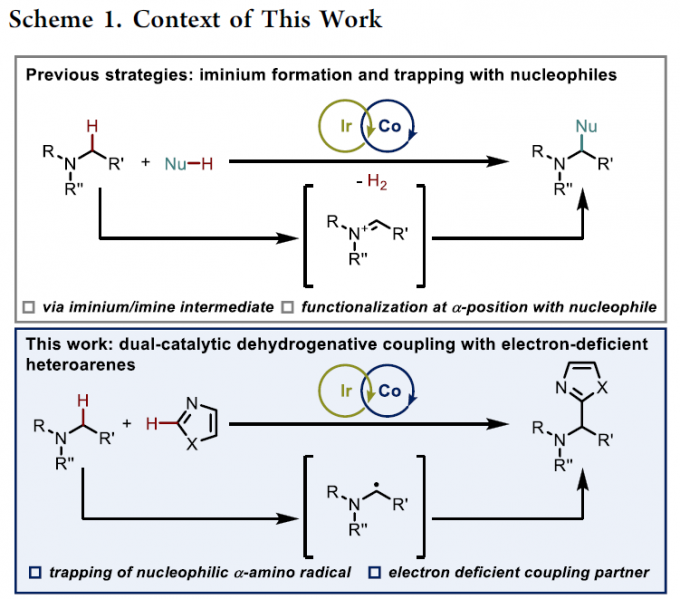
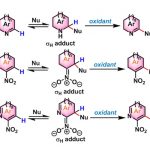
尽管上述的双重催化策略同样能够实现一系列含氮有机分子的α-官能团化反应。然而,多数反应过程中均涉及α-氨基自由基物种的氧化过程,并产生亚胺盐或亚胺中间体,进而使相应的氨基底物易于受到富电子亲核偶联参与物的进攻 (Scheme 1, top)[7]-[10]。基于上述研究报道,作者设想,能否通过采用缺电子的(杂环)芳基化合物捕获通过激发态光催化剂 (excited photocatalyst)氧化猝灭 (oxidative quenching)过程产生的α-氨基自由基,进而实现C(sp3)-C(sp2)键的构建 (Scheme 1, bottom)。
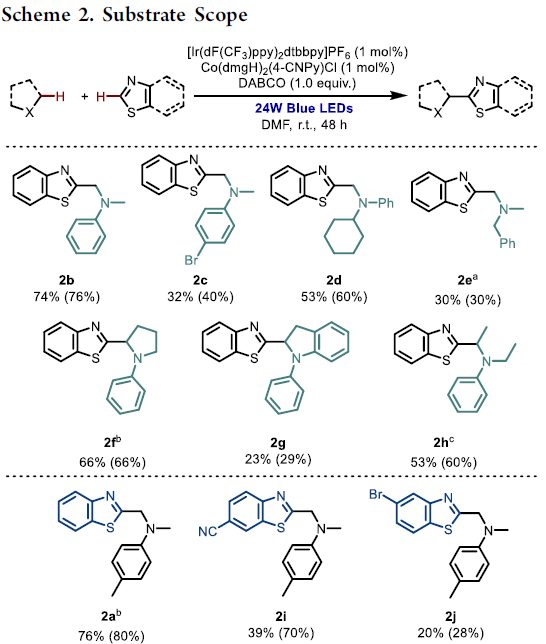
首先,作者采用苯并噻唑与N,N-二甲基对甲苯胺作为模型底物,进行相关偶联反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用1 mol% [Ir(dF(CF3)-ppy)2dtbbpy]PF6作为光催化剂,1 mol% Co(dmgH)2PyCl作为相应的钴催化剂,1eq. DABCO作为碱,在蓝光辐射下,DMF溶剂中,室温条件下进行反应,最终获得80%收率的产物2a (entry 5)。
在获得上述最佳反应条件后,作者开始对相关的底物应用范围进行考察 (Scheme 2)。研究发现,N,N-二甲基苯胺衍生物 (2b–2c)、N-环己基苯胺衍生物 (2d)、苄基胺衍生物 (2e)、N-苯基吡咯烷 (2f)以及N-苯基二氢吲哚 (2g)底物均能够与苯并噻唑有效地进行相应的脱氢偶联过程。同时,该小组发现,采用PhCOOK代替DABCO,能够进一步实现相应N,N-二乙基苯胺底物参与的偶联过程,并获得目标产物2h。
之后,作者进一步发现,芳环中具有不同取代基团的苯并噻唑底物,均能够顺利地参与上述的偶联反应过程,并获得相应产物2a以及2i–2l。然而,在上述的标准反应条件下,苯并噁唑底物则无法有效地参与相应的偶联过程 (2m)。有趣的是,上述的最佳反应条件,对于具有单一酯基与双重酯基官能团取代的噻唑底物,同样能够良好地兼容 (2n与2p)。然而,接下来,作者研究发现,噻唑底物中,5-取代基对于脱氢偶联过程的顺利进行尤为关键,而4-取代的噻唑底物,则无法有效地参与上述的偶联过程 (2o)。
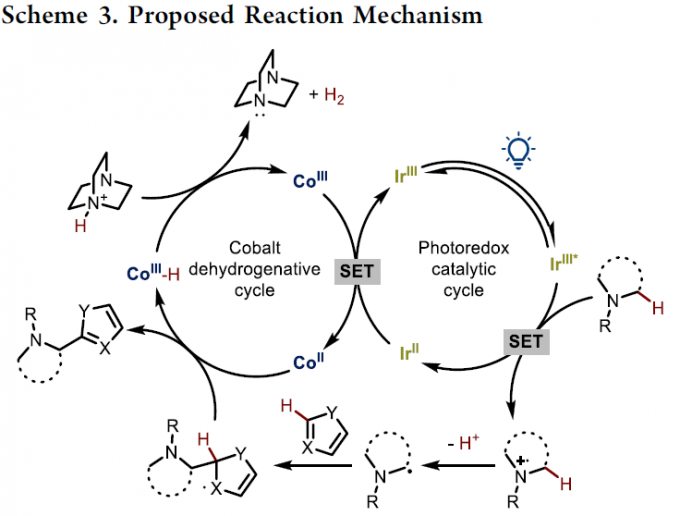
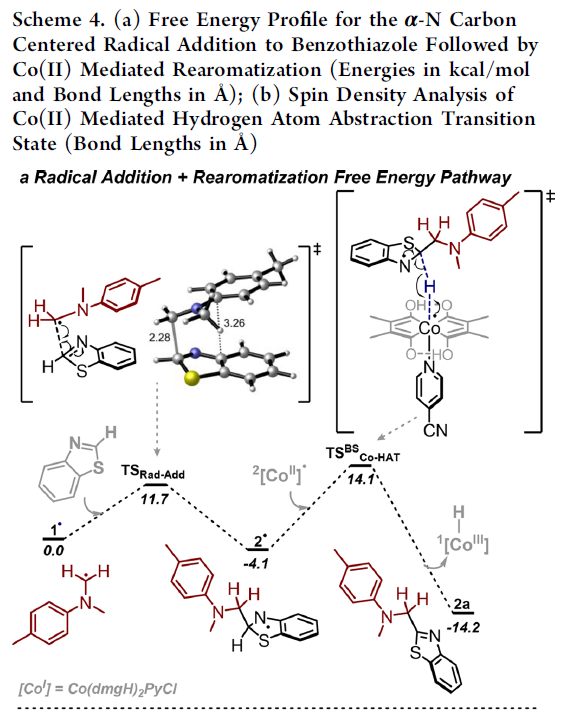
接下来,作者基于前期的相关文献报道[11],提出一种合理的反应机理 (Scheme 3)。首先,在光辐射条件下,铱光催化剂Ir(III)受到激发,形成相应激发态的Ir(III)*物种,并通过单电子转移 (SET)过程,氧化相应的苯胺底物与DABCO。同时,光催化剂还原为Ir(II)。之后,DABCO作为碱,将苯胺自由基正离子进一步去质子化,或通过DABCO自由基正离子直接攫取苯胺底物中的氢原子。值得注意的是,在产物2h的形成过程中,采用PhCOOK替换DABCO,由于羧酸盐的具有更高的氧化电势,因而能够使苯胺顺利地参与相应的氧化过程[12]。由此,作者假设α-氨基自由基能够进攻杂环芳基底物中最具亲电性的C2-位置,同时,通过Ir(II)与Co(III)之间的SET过程,产生的Co(II)配合物可能影响相应中间体的再芳构化的过程,即Co(II)配合物对于相应自由基加成中间体后续的再芳构化过程尤为关键。接下来,该小组通过DFT计算,进一步证实上述假设的合理性 (Scheme 4)。
总结
本文主要报道一种新型的将光氧化还原与钴肟催化结合的双重催化策略,在无化学氧化剂的条件下,成功实现一系列(苯并)噻唑底物与胺之间的脱氢交叉偶联反应过程,进而完成相应C(sp3)-C(sp2)键的构建。DFT计算研究表明,Co(II)配合物对于相应自由基加成中间体后续的再芳构化过程尤为关键。



















No comments yet.