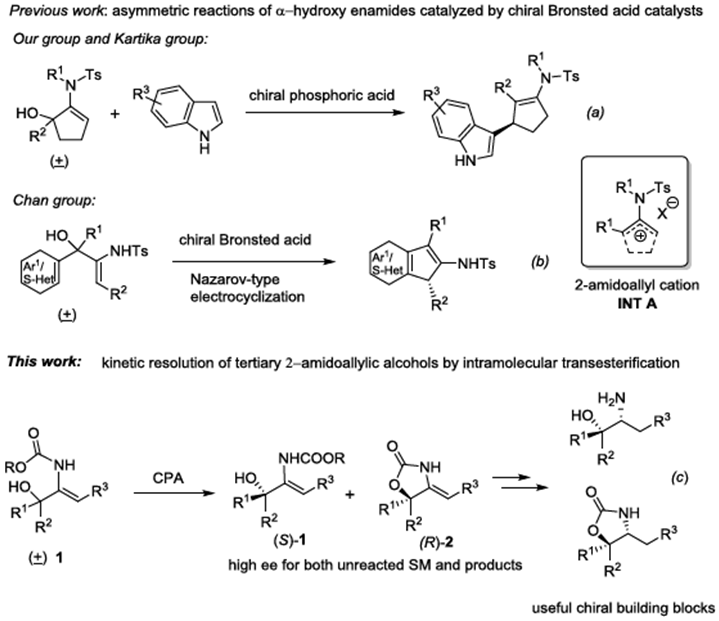
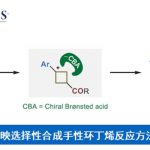
消旋仲醇的动力学拆分已被证明是合成手性仲醇最有效和最实用的方法之一。而与仲醇相比,关于叔醇动力学拆分的研究相对较少。最近,上海科技大学杨晓瑜课题组[1]和Kartika[2]分别报道了手性磷酸催化α-羟基环戊烯酰胺不对称合成β-吲哚环戊烯酰胺的反应。同时,Chen课题组[3]报道了手性磷酸催化α-羟基烯酰胺的不对称Nazarov-型亲电环加成反应合成手性1H-茚衍生物。这几个反应的中间体均为INT A离子对。作者继续对手性Brønsted酸催化α-羟基烯酰胺的研究中发现并没有这种中间体的形成,而是形成了恶唑烷酮衍生物2。基于上述背景研究和实验中新的发现,上海科技大学杨晓瑜课题组报道了手性磷酸催化2-烷氧基酰胺-烯丙基醇的高效动力学拆分过程,能以高对映选择性得到一系列酯交换产物和叔醇。同时,获得的手性产物可以很容易的转换成有用的手性恶唑烷酮和β-氨基醇等骨架(Figure 1)。相关研究成果发表于
Kinetic Resolution of Tertiary 2-Alkoxycarboxamido-allylic Alcohols by Chiral Phosphoric Acid Catalyzed Intramolecular Transesterification
Rajkumar, S.; He, S.; Yang, X.* Angew. Chem. Int. Ed. 2019, Just Accepted Manuscript
DOI: 10.1002/anie.201905034
Figure 1 背景研究
论文作者介绍:
研究者:杨晓瑜 助理教授、研究
教育背景
2007年,获得南京大学化学专业学士学位
2012年,获得中科院上海有机化学研究所有机化学专业博士学位(导师 俞飚 研究员)
2012年7月至2013年2月,中科院上海有机化学研究所任助理研究员(导师 俞飚 研究员)
2013年3月至2015年2月,美国加州大学伯克利分校从事博士后研究(导师 Dean Toste)
2015年3月至2016年5月,美国劳伦斯伯克利国家实验室从事博士后研究(导师 Dean Toste)
2016年6月,加入上海科技大学物质科学与技术学院,任助理教授、研究员
研究方向: 不对称催化、天然产物全合成、选择性蛋白质修饰
论文概要:
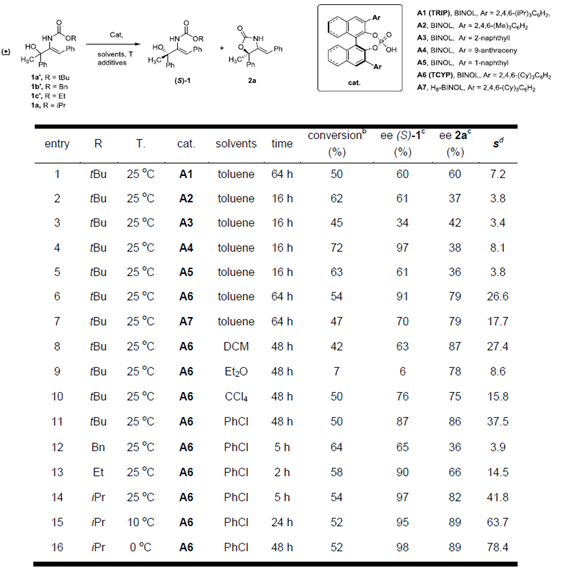
以2-叔丁基氧基酰胺-烯丙基醇1a’作为模板底物,作者对底物、催化剂、溶剂等反应条件进行反复筛选,确定最佳条件为(Table 1):2-异丙基氧基酰胺-烯丙基醇在10 mol%(S)-A6作为催化剂,60 mg 5Å分子筛作为添加物,PhCl作为溶剂,0℃条件下反应48小时,能以45%的收率、89%的对映选择性和78.4的影响因子得到目标产物(R)-2。同时,该反应可以47%的收率和98%的对映选择性回收(S)-1。
Table 1 条件筛选
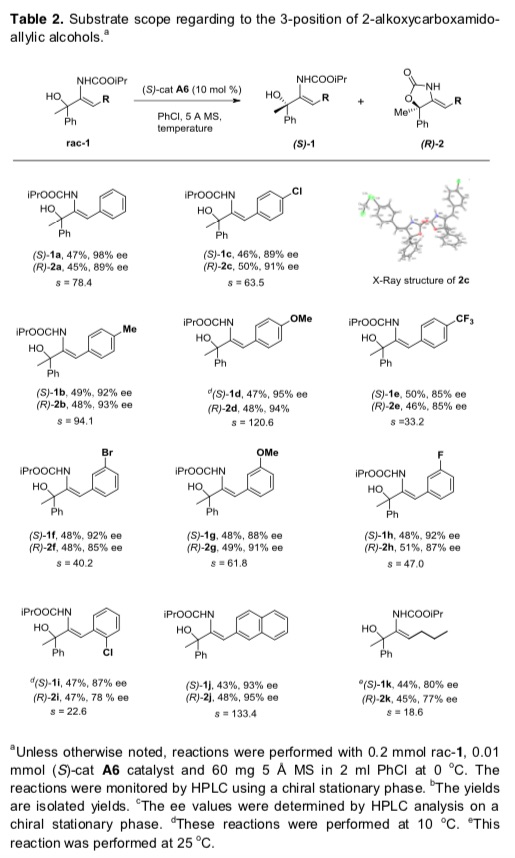
在最优反应条件下,作者考察了该动力学拆分的底物范围(Table 2)。3号位为各种苯基取代以及2-萘基取代烯丙基醇均能较好的适应反应条件,能以良好的收率和对映选择性得到相应产物和回收的不对称原料。
Table 2 各种C3位取代烯丙基醇的反应情况
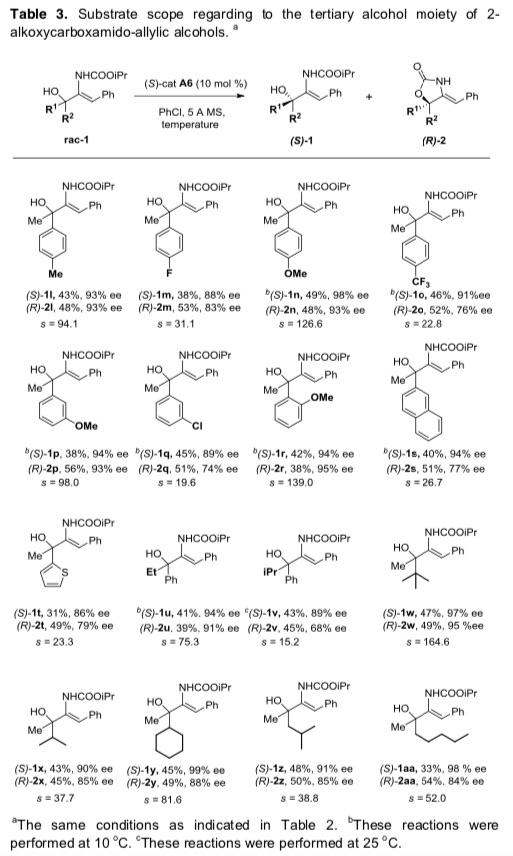
紧接着,作者考察了不同取代的三级醇的底物范围(Table 3)。若将苯基换成各种取代芳基以及杂环,反应能很好的进行,能以良好的收率和良好至优秀的对映选择性得到相应产物和回收的不对称原料。若将甲基换成乙基、异丙基以及各种芳基取代,该反应也能很好的进行,能以优秀的对映选择性得到相应产物,但其选择因子相应有所降低。同时。Me,iPr-二取代、Me,Cy-二取代以及Me, Me二取代的烯丙基醇具有良好的耐受性,能以优秀的对映选择性得到相应产物。
Table 3 各种取代三级醇的反应情况
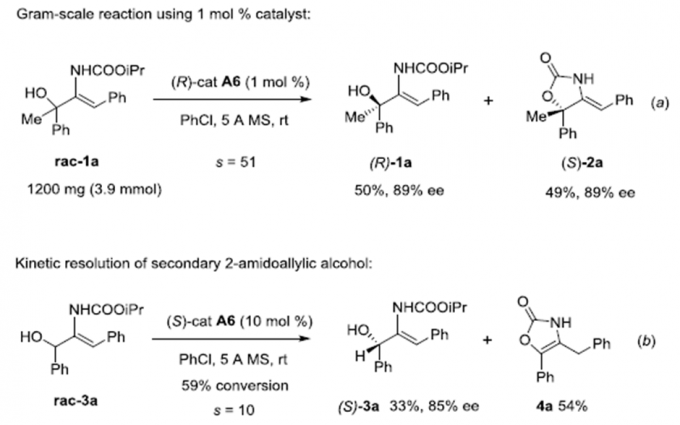
为了证明该动力学拆分的实用性,作者rac-1a进行了克级反应(Scheme 1)。将催化剂用量降至1 mol%,其它条件保持不变,发现产物的对映选择性和选择性因子均没有太大的变化。若将三级醇换成二级醇,在标准条件下反应,能以33%的收率、85%的对映选择性和10的选择性因子得到相应产物。但其酯交换产物会进一步异构化为2-恶唑酮产物。
Scheme 1 克级反应及二级醇的动力学拆分
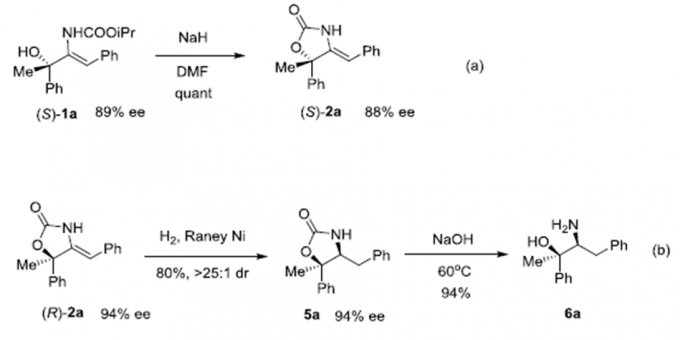
为了证明该反应的潜在价值,作者又进行了衍生反应(Scheme 2)。在NaH的DMF溶液中,(S)-1a易发生环化反应转化为(S)-恶唑烷酮2a。(S)-2a在Raney Ni作用下可还原成5a,5a发生水解反应可生成β-氨基醇6a。
Scheme 2 衍生反应
论文总结评价:
上海科技大学杨晓瑜课题组报道了手性磷酸催化α-羟基烯酰胺甲酸酯的高效动力学拆分过程,能以高对映选择性得到一系列酯交换产物和叔醇。同时,获得的手性产物可以很容易的转换成有用的手性恶唑烷酮和β-氨基醇等骨架。
参考文献:
- Rajkumar, S.; Wang, J.; Zheng, S.; Wang, D.; Ye, X.; Li, X.; Peng, Q.; Yang, Angew. Chem. Int. Ed. 2018, 57, 13489. DOI: 10.1002/anie.201807010
- Saputra, M. A.; Nepal, B.; Dange, N. S.; Du, P.; Fronczek, F. R.; Kumar, R.; Kartika, R. Angew. Chem. Int. Ed. 2018, 57, 15558. DOI: 10.1002/anie.201808764
- Jin, J.; Zhao, Y.; Gouranourimi, A.; Ariafard, A.; Hong Chan, P. W. J. Am. Chem. Soc. 2018, 140, 5834. DOI: 10.1021/jacs.8b02339
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.