本文投稿作者 齐藩
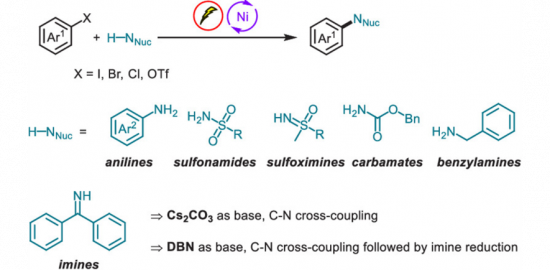
碳氮键形成反应是有机化学及制药工业中最为重要的转化之一。过渡金属催化碳氮键形成反应是构建碳氮键的重要方法之一,最经典的反应是Ullmann反应和Buchwald-Hartwig反应。然而这两类反应主要用于芳基亲电试剂与胺的偶联,烷基亲电试剂与胺的偶联反应的成功报道不多,而且亲核试剂胺仅限于咔唑和酰胺,因此发展更为普适的碳氮键形成方法是极为重要的。Baran等1利用氧化还原活性酯作为亲电试剂发展了一系列脱羧碳碳偶联反应,此后该活性酯也被Li2a, Glorius2b, Aggarwal2c, Fu2d等课题组相继应用于碳硼键的构建,碳氮键形成反应还没有相关报道。Hu等利用光催化与铜催化双催化体系实现了烷基活性酯与胺的脱羧偶联反应,该转化可用于一级、二级羧酸的转化,可用于氨基酸、天然产物以及药物分子的官能化。
Decarboxylative C(sp3)–N cross-coupling via synergetic photoredox and copper catalysis.
Mao, R.; Frey, A.; Balon, J.; Hu, X.,
Nature Catalysis 2018,1 (2), 120-126. doi:10.1038/s41929-017-0023-z
1.反应条件的探索
图1. 反应最初尝试
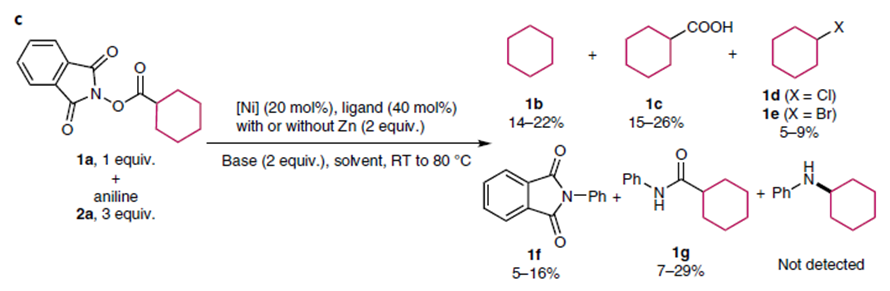
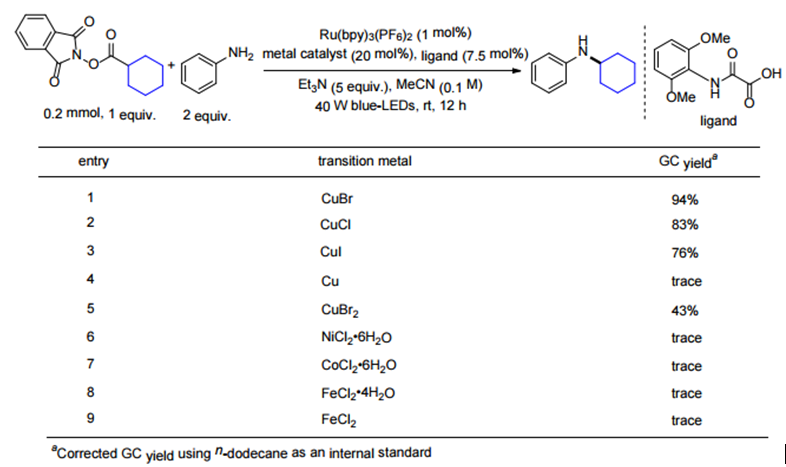
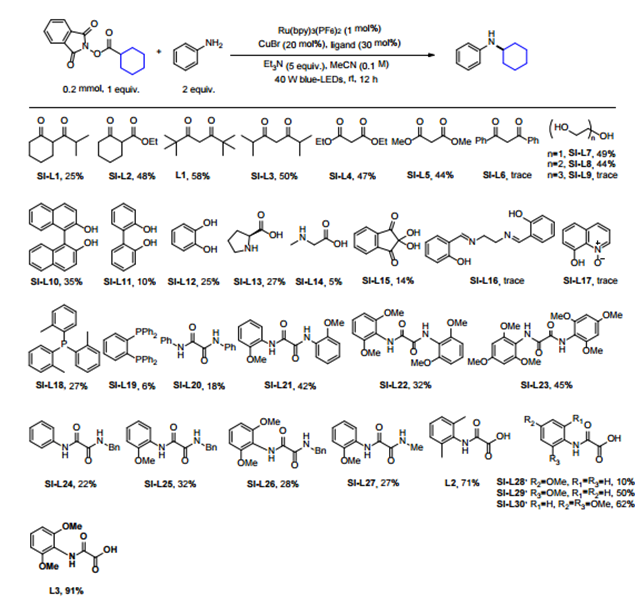
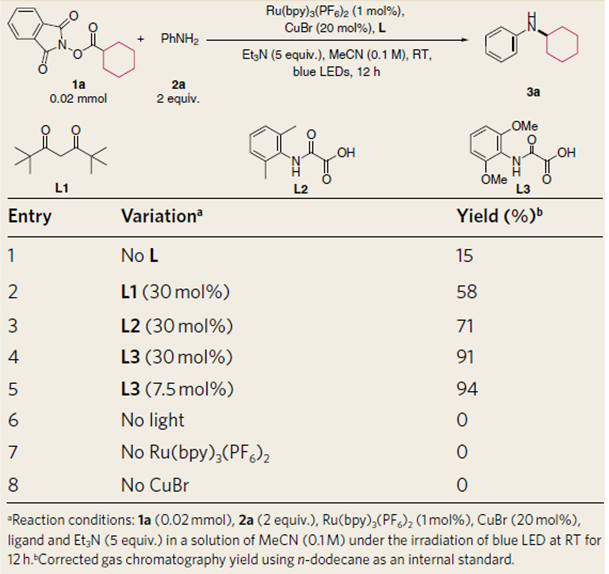
作者首先利用Baran在碳碳偶联反应中的类似条件,尝试了该反应,产物中没有脱羧形成胺化的产物,主要缩合成酰胺。Fu等3利用光催化与铜催化协同催化的策略实现了活性酯与端炔的脱羧偶联反应。作者以环己基活性酯与苯胺为底物筛选了光催化剂,Ru(bpy)3(BF6)2是最合适的催化剂,尝试了铁、钴、镍、铜催化剂,发现只有铜催化剂能得到一定量的胺化的产物,并且发现一价铜盐更有利于该转化的进行,溴化亚铜反应效果更好。此外,作者进行了大量的配体筛选工作,最开始以1,3-二酮类化合物为反应的配体,发现大位阻的2,2,6,6-四甲基-3,5-庚二酮(L1)在这一类配体中效果最好。然后作者转向利用草酰乙酸或草酰胺这类化合物作为配体,这类化合物曾在铜催化氯代芳烃的胺化反应中用作配体,发现L2可以大幅提升反应的产率,然后作者将L2中的邻位甲基替换成甲氧基,反应效果达到最优,即L3为最优配体,作者认为邻位的双取代加强了配体的位阻有利于碳氮键的还原消除,同时富电子的取代基有利于金属中间体的氧化。最后确定反应的最优条件为,1 mol% Ru(bpy)3(BF6)2/20 mol% CuBr为催化剂,blue LED为光源,5倍量三乙胺为碱,室温下乙腈溶剂中反应12 h。
图2. 催化剂筛选
图3. 配体筛选
图4. 反应条件优化
2.底物适用范围与应用
图5. 芳胺底物拓展
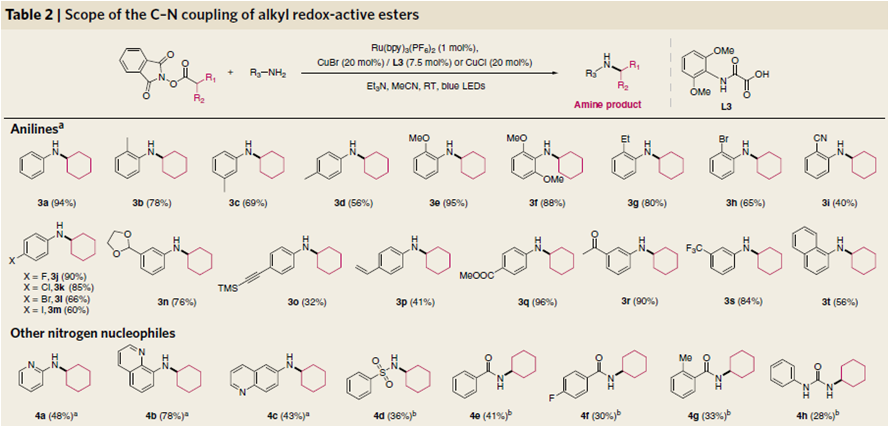
作者以环己基活性酯为底物,在最优条件下首先考察了芳胺的适用范围,发现芳环上邻、间、对都能以较好产率得到相应产物,在供电子底物中发现,供电子能力越强的取代基,反应效果更好,产率更高。卤素F、Cl、Br,甚至活性很高容易产生自由基的碘代芳烃都能很好的兼容,更多样更具应用价值的官能团,如腈基、被保护的醛基、乙炔基、烯基、乙酰基、甲酰氧基、三氟甲基都能很好地适用这一转化。其他氮亲核试剂,1-氨基吡啶,氨基喹啉,苯磺酰胺,芳甲酰胺,苯基脲等都能兼容,相对产率较低。
图6. 羧酸底物拓展
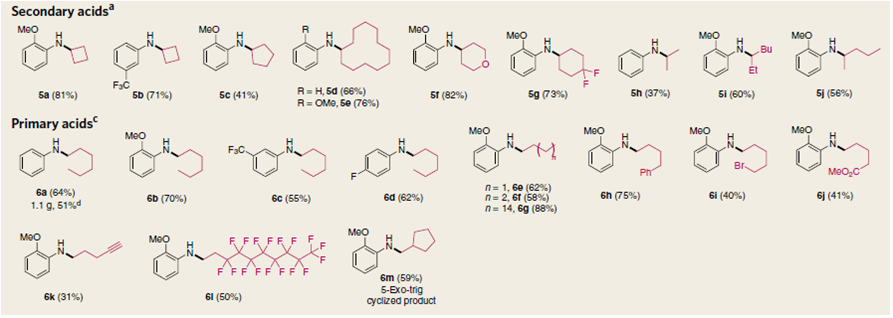
以邻甲氧基苯胺为底物,二级羧酸底物都能较好地适应这一转化,二级烷基羧酸能获得中等收率的产物,环烷基取代的羧酸,小环如环丁酸、环戊酸,大环如环十二酸都能以较好的产率得到相应的产物,比较而言,环烷基取代的羧酸对应的酯活性相对更高。一级羧酸都能以中等到良好的产率得到相应的产物,其中各种官能团取代的一级羧酸,如苯基、溴、甲酰氧基、乙炔基、环戊基都能兼容,多氟取代的一级羧酸也能获得中等的收率,而三级羧酸,反应活性很低,几乎无法得到相应的胺,1-金刚烷酸对应的活性酯只能转化得到9%的产物。
图7. 合成应用
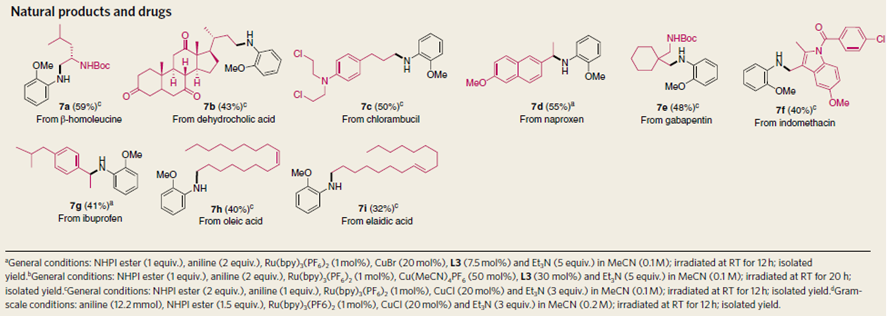
作者也对这一转化做了一些合成的应用,比如7a就是从一个氨基酸转化成活性酯然后胺化得到的,7b来自一个含羧酸基团的天然产物转化得到的,7c-7g都是由含羧基的药物小分子转化得到,油酸和亚油酸也可以容易地反应得到7h和7i。此外,作者也将这一方法应用于药物分子核心骨架的构建中,75%的产率一步构建核心中间体。
3. 机理研究
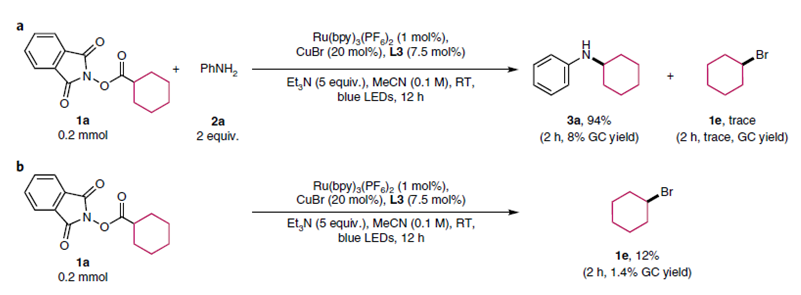
作者首先做了自由基捕获实验,在三倍量的TEMPO的作用下没有产物生成,并且得到57%的环己基取代的TEMPO,这表明反应是一个自由基历程。接下来,反应在没有胺的条件下进行,得到12%相应的溴代烷烃,而正常情况下只能得到痕量的溴代烷烃,这表明反应过程中亲核试剂胺与铜有配位作用,并且自由基很可能是被铜胺配合物捕捉。
图8. 机理控制实验
图9. 机理验证实验
此外作者也对反应过程中捕捉自由基的铜胺配合物铜的价态进行了分析,以8-氨基喹啉为底物,合成了二价铜配合物,反应只有极少量产物生成。而原位生成的二价铜与活性酯的反应中,反应有41-46%的产物生成,这表明反应产生的自由基可能是被一价铜捕捉。
结论
光催化与铜催化的协同催化能够实现烷基活性酯与胺的脱羧胺化反应,这一转化极大地拓展了金属催化Sp3碳氮键偶联反应。由于烷基羧酸与烷基卤代烃相比,在可获得性、稳定性、毒性上的优势,这一方法及其策略将有望在胺的合成中有广泛的应用。此外,由于光催化与金属催化的串联在脱羧碳碳偶联反应中应用最广的是镍催化剂与光催化的结合,因此这一铜催化与光催化的协同催化脱羧碳氮偶联反应丰富了这一策略。
参考文献
- (a)Cornella, J. et al. Practical Ni-catalyzed aryl–alkyl cross-coupling of secondary redox-active esters. J. Am. Chem. Soc.2016, 138, 2174–2177.DOI: 10.1021/jacs.6b00250.(b) Qin, T. et al. A general alkyl–alkyl cross-coupling enabled by redox-active esters and alkylzinc reagents. Science .2016, 352, 801–805.DOI: 10.1126/science.aaf6123. (c) Toriyama, F. et al. Redox-active esters in Fe-catalyzed C–C coupling. J. Am. Chem. Soc. 2016, 138, 11132–11135.DOI: 10.1021/jacs.6b07172.
- (a) Hu, D.; Wang, L.; Li, P. Org. Lett. 2017,19, 2770. DOI:10.1021/acs.orglett.7b01181. (b) Candish, L.; Teders, M.; Glorius, F. J. Am. Chem. Soc. 2017, 139, 7440-7443. DOI: 10.1021/jacs.7b03127.(c) Fawcett, A.; Pradeilles, J.; Wang, Y.; Mutsuga, T.; Myers, E. L.; Aggarwal, V. K. Science. 2017, 357, 283.DOI: 10.1126/science.aan3679. (d) Cheng, W.-M.; Shang, R.; Zhao, B.; Xing, W.-L.; Fu, Y. Org. Lett. 2017,19, 4291. DOI: 10.1021/acs.orglett.7b01950.
- Zhang, H., Zhang, P., Jiang, M., Yang, H. & Fu, H. Merging photoredox with copper catalysis: decarboxylativealkynylation of α-amino acid derivatives. Org. Lett.2017, 19, 1016–1019 (2017).DOI: 10.1021/acs.orglett.6b03888.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





















No comments yet.