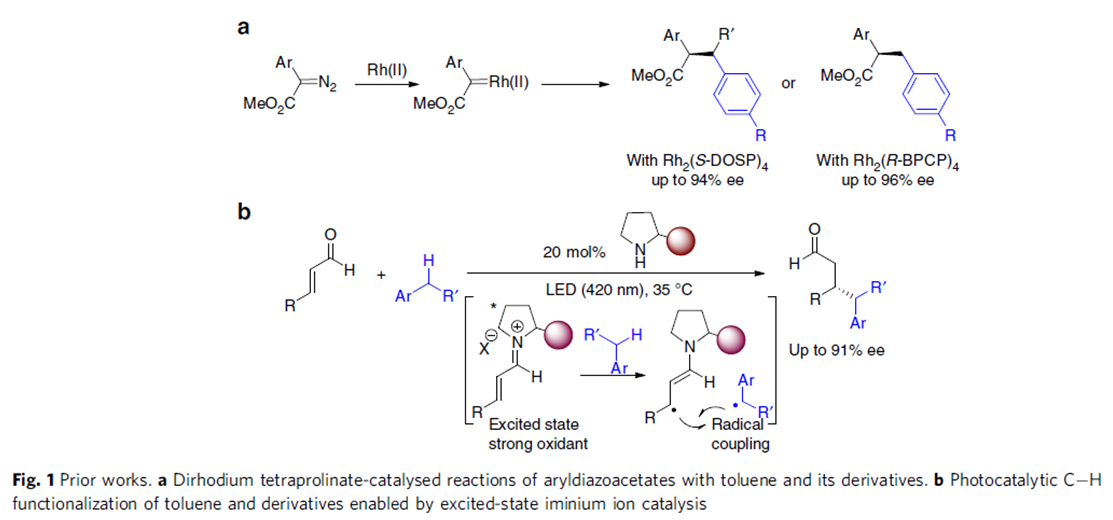
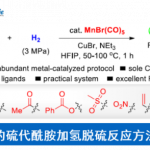
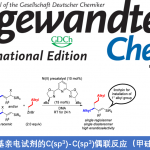
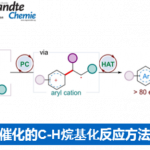
利用丰富的化工原料来合成更有价值的化学产品受到化学家们的广泛关注,甲苯C(sp3)-H官能团化则是一个典型的例子。甲苯及其衍生物C-H键活化的方法主要包括过渡金属催化的C-H键氧化反应、氢原子转移以及单电子转移氧化反应这三种,且已经取得了不错的进展,但关于不对称合成手性药物和手性功能材料的报道还很少。Davies课题组报道了手性二铑催化剂催化甲苯衍生物的仲碳和伯碳发生区域选择性和对映选择性的C-H键官能团化反应(Fig.1a)[1]。最近,Melchiorre课题组充分利用亚铵离子中间体高激发态氧化电位的优势实现了甲苯及其富电子衍生物的单电子转移反应,合成苄基自由基(Fig.1b)[2]。
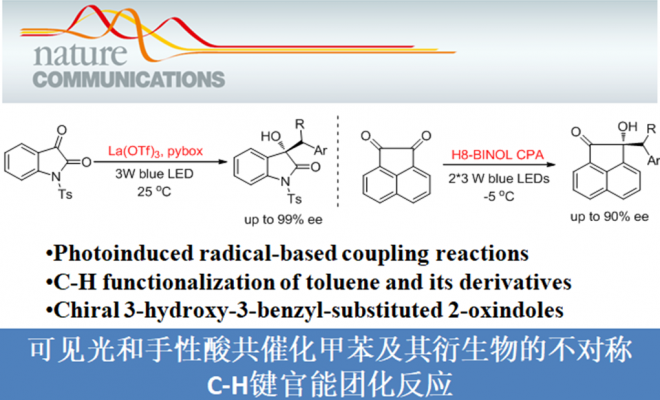
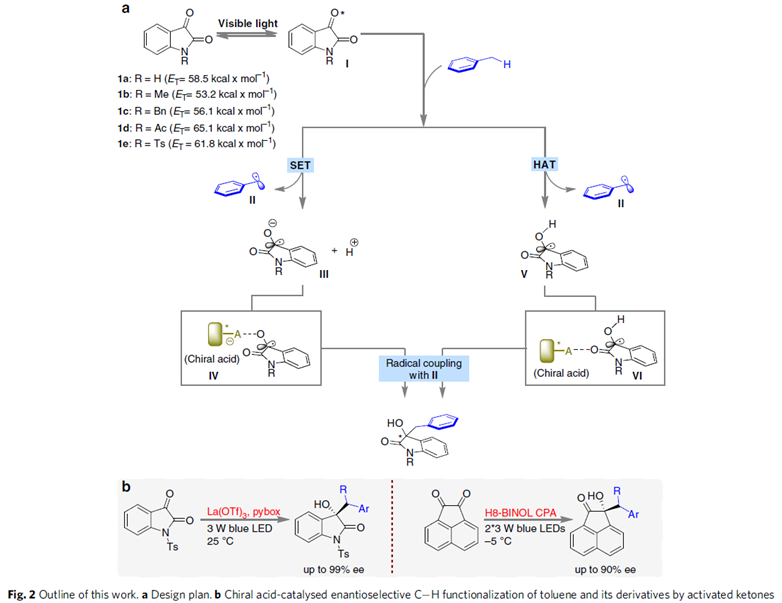
这种将自由基策略引入过渡金属催化甲苯衍生物的C-H键官能团化反应有助于产物的区域选择性,而且由于苄基自由基的稳定性较高,可以很好地将C(sp3)-H与C(sp2)-H区分开来。1909年,Paternò和Chieffi课题组报道了光催化酮与烯烃的[2+2]环加成反应。之后,该反应被证明光活化状态下的三重态与活化的烯烃、炔烃和烷烃反应是通过SET氧化还原或HAT机理。于是,化学家猜想类似的光化学机理能否直接用于甲苯及其衍生物的C(sp3)-H直接官能团化。另一方面,具有重要生物活性的3-羟基-3-苄基取代2-羟基吲哚主要通过3-苄基取代2-羟吲哚发生α-氧化反应得到,但该类反应存在起始原料制作繁琐、底物范围局限等问题,因此3-羟基-3-苄基取代2-羟基吲哚化合物的合成仍然面临巨大挑战。在上述背景研究的基础上,河南师范大学江智勇团队报道了手性Brønsted酸或Lewis酸催化剂催化甲苯及其衍生物与靛红或苯并乙二酮的C(sp3)-H直接官能团化反应,合成手性叔醇化合物(Fig.2)。新加坡科技设计大学Richmond Lee教授提供了计算化学支持。相关研究成果发表于
Chiral acid-catalysed enantioselective C−H functionalization of toluene and its derivatives driven by visible light
Li, F.; Tian, D.; Fan, Y.; Lee, R.; Lu, G.; Yin, Y.; Qiao, B.; Zhao, X.; Xiao Z.; Jiang, Z.*
Nat. Commun. 2019, early view DOI: 10.1038/s41467-019-09857-9
作者推测可能的机理(Fig.2):在可见光照射下,对于激发态还原电势与[Acr+-Mes]ClO4电势相当的靛红(如1d)可转化为具有高还原电势的三重激发态I, I可氧化甲苯形成苄基自由基II、自由基阴离子III以及质子。具有强碱性的自由基阴离子III可与Brønsted酸或Lewis酸催化剂结合,生成二氧化吲哚自由基IV。其中,二氧化吲哚自由基IV的自由基中心同时连接吸电子基和给电子基,所以较为稳定。紧接着,IV可与瞬态苄基自由基II发生偶联反应,得到不对称氧化吲哚产物。热力学稳定的靛红和甲苯则会经历HAT过程即:具有高还原电势的三重激发态能克服二氧化吲哚自由基V的O-H键和甲苯的C(sp3)-H键的键解离能。同样的,二氧化吲哚自由基V可与手性催化剂结合形成亲电性更强的自由基VI。其中,中性自由基II和IV/V易发生自身偶联反应。
论文作者介绍:
研究者:江智勇教授
研究者经历:
- 1992年9月-1996年6月,浙江大学,化学系,理学学士
- 1999年9月-2004年1月,浙江大学,化学系,有机化学专业理学博士
- 2004年2月-2005年4月,香港浸会大学,化学系,博士后,合作导师:Wing-Hong Chan教授
- 2005年8月-2009年8月,新加坡国立大学,化学系,博士后,合作导师:Choon-Hong Tan教授
- 2013年4月-2013年10月,新加坡南洋理工大学,化学与生物化学学院,高级研究员
- 2009年8月-2018,河南大学,河南省天然药物与免疫工程重点实验室,教授,博士生导师,国家百千万人才工程入选者,河南省特聘教授(有机化学)
- 2018年至今 ,河南师范大学,化学化工学院 院长
荣誉奖项:
- 河南省青年骨干教师(2010)
- 河南省教育厅学术技术带头人(2010)
- 河南省青少年科技创新奖(青年组)(2012)
- 河南省优秀青年科技专家称号(2012)
- 河南省第十一届青年科技奖(2012)
- 河南省学术技术带头人(2012)
- 河南省第十七届青年五四奖章(2013)
- 河南省教育厅科技进步一等奖(排名1,2016)
- 开封市优秀教师(2017)
- 河南省科技进步二等奖(排名1,2017)
- 国家“有突出贡献中青年专家”(2017)
条件优化:
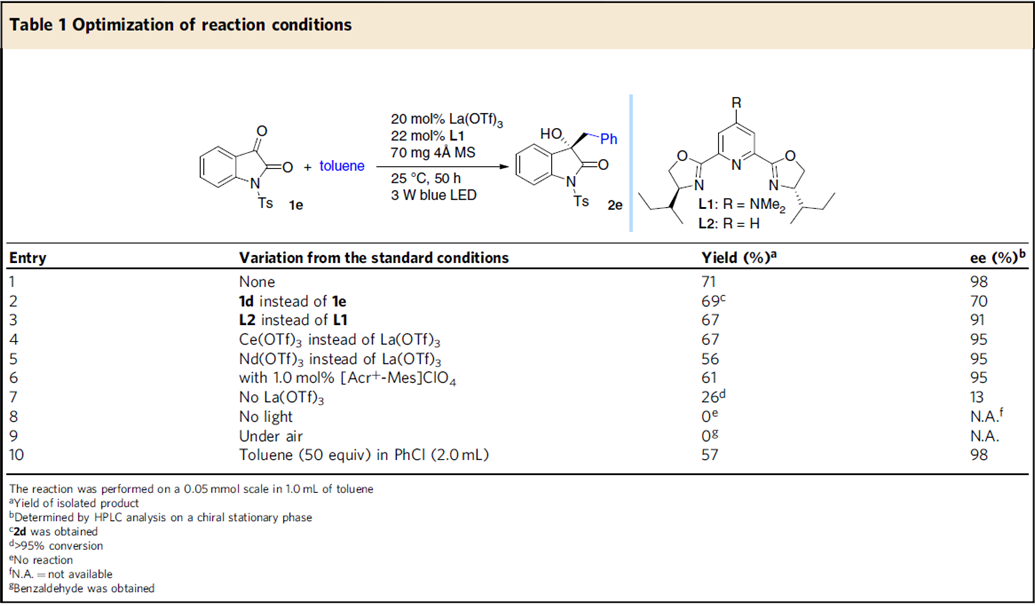
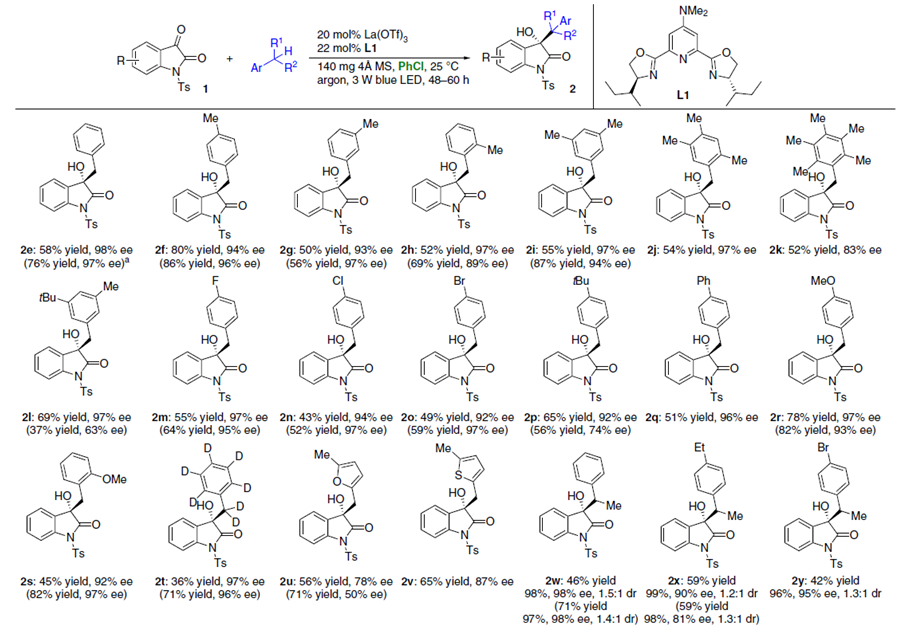
在3 W蓝光照射下,靛红1在甲苯溶剂中的反应条件进行优化,作者发现,0.1 mmol 1e和5.0 mmol 甲苯为模板底物,20 mol% La(OTf)3和22 mol%手性络合物L1为催化剂,70 mg 4 Å 分子筛为添加物,PhCl (4.0 mL)为最优溶剂,在25℃条件下反应50 h,能以57%的收率和98%的对映选择性得到目标产物2e。若换成无溶剂条件,则能以以71%的收率和98%的对映选择性得到目标产物(Table 1)。
底物扩展:
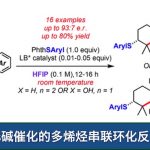
在最优条件下,作者对该反应的底物范围进行了考察(Fig. 3),括号中的数据为无溶剂条件下的反应情况。各种吸电子、给电子取代的芳环、氘代甲苯以及杂芳环均能很好的适应反应条件,能以中等至较高的收率和中等至优秀的对映选择性得到相应产物。若换成吸电子更强的硝基和三氟甲基取代的芳环,则只能生成自身偶联副产物。二级苄基衍生物以及环状二级苄基衍生物能较好的适应反应条件,能以中等的收率和优异的对映选择性得到相应产物,但二级苄基衍生物的非对映选择性较低。对于三级芳环也能以较低的收率和较高的对映选择性得到相应产物,但对位取代的三级芳环得到的产物无对映选择性。同时,各种芳环取代的靛红也具有良好的耐受性。
机理研究:
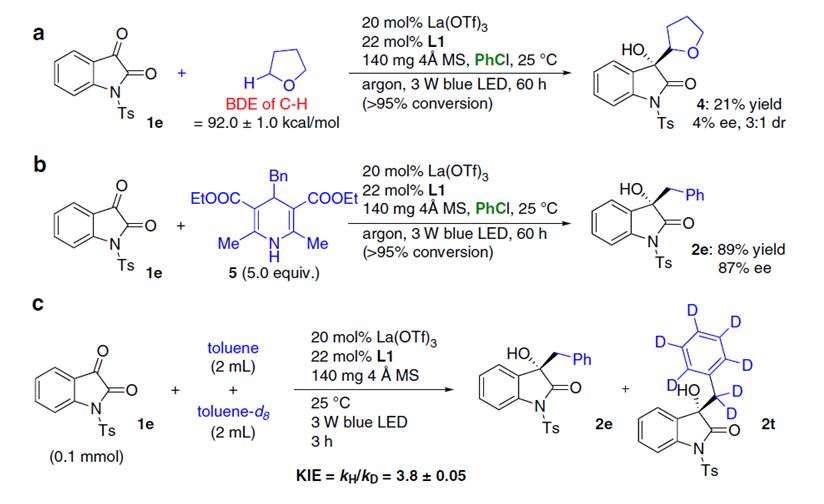
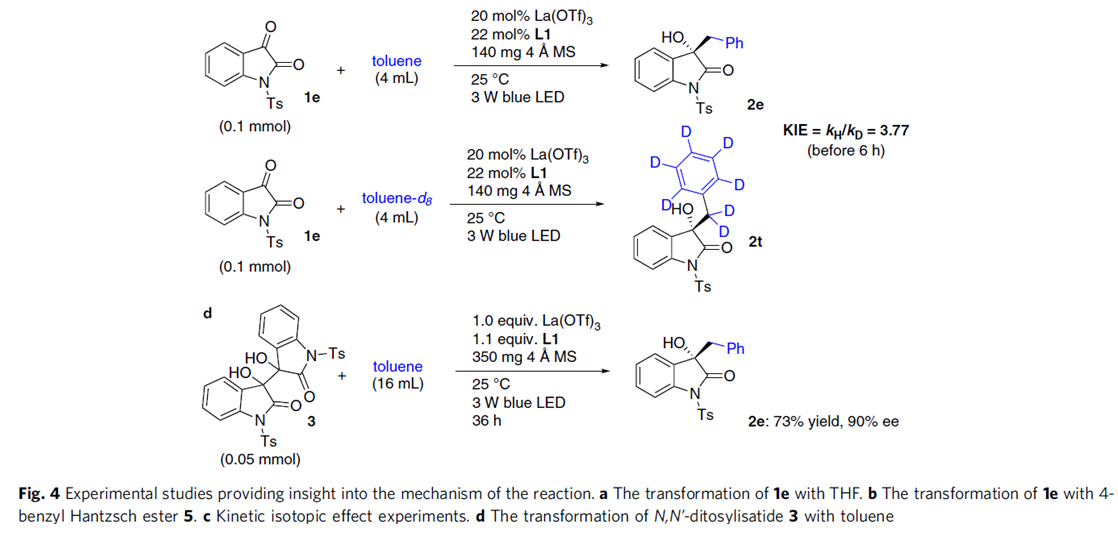
为了阐明机理,作者对该反应进行了紫外-可见光吸收光谱分析,发现反应过程中无受体-给体配位化合物生成。紧接着,作者又进行了一系列对照试验和动力学同位素效应研究。对照试验的数据说明HAT过程中确实产生了苄基自由基,同时,动力学同位素效应研究表明C-H键断裂是催化循环不可逆的第一步,是该反应的决速步骤(Fig. 4).。
底物扩展:
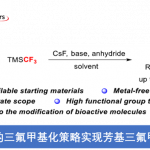
苯并乙二酮6在无溶剂的甲苯溶液中反应,20 mol% CPA-1为催化剂,80 mg 4 Å 为添加物,在 −5 °C 条件下反应60 h,能以51%的收率和90%的对映选择性得到相应产物。在得到的最优条件下,各种甲苯衍生物具有良好的耐受性,能以中等的收率和较高的对映选择性得到相应叔醇产物(Fig.5)。
论文总结评价:
河南师范大学江智勇团队报道了手性Brønsted酸或Lewis酸催化剂催化甲苯及其衍生物与可见光活化的靛红或苯并乙二酮的C(sp3)-H直接官能团化反应,能以中等的收率和优异的对映选择性得到一系列生物具有生物活性的3-羟基-3-苄基取代的2-羟基吲哚结构。这种C-H插入反应及自由基偶联策略也同样适用于苯并乙二酮,为叔醇化合物的合成提供了一种新的途径。
参考文献:
- Qin, C.; Davies, H. M. L. J. Am. Chem. Soc. 2014, 136, 9792. DOI: 10.1021/ja504797x
- Mazzarella, D.; Crisenza, G. E. M.; Melchiorre, P. J. Am. Chem. Soc. 2018, 140, 8439. DOI: 10.1021/jacs.8b05240
相关链接
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!















No comments yet.