作者:石油醚
导读:
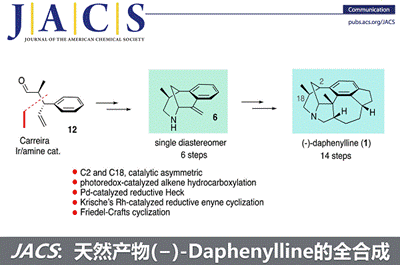
近日,中科院昆明植物研究所的杨玉荣研究员团队在J. Am. Chem. Soc.上,以 “Enantioselective Total Synthesis of (−)-Daphenylline” 为题,报道了六环Daphniphyllum 生物碱(−)-Daphenylline的简洁全合成。其中关键步骤涉及1)Carreira铱/胺双元催化烯丙基化(Carreira’s Ir/amine dual-catalyzed allylation.)构建两个手性立体中心;2)Wickens光氧化还原催化烯烃的氢羧基化(Wickens’ photoredox-catalyzed hydrocarboxylation of olefin)和CuBr2催化酮的α-胺化等6步快速制备桥头烯丙基胺中间体;3)Pd催化的还原Heck反应(Pd-catalyzed reductive Heck reaction)或Krische Rh催化还原1,6-炔环化(Krische’s Rh-catalyzed reductive 1,6-enyne cyclization)构建四环骨架。此外,在此合成中Wickens光氧化还原催化的氢羧基化使用两次,Friedel-Crafts酰化使用三次。
“Enantioselective Total Synthesis of (−)-Daphenylline
Bing-Lu Wu, Jian-Neng Yao, Xiang-Xi Long, Zong-Qin Tan, Xiao Liang, Li Feng, Kun Wei, and Yu-Rong Yang*
J. Am. Chem. Soc., 2024. ASAP. doi: 10.1021/jacs.3c12741”
正文
Daphniphyllum生物碱是由Yagi于1910年首次从落叶树Yuzuriha中首次分离获得的一种具有的一类多环天然产物。一百多年,科学家已经分离表征了300多个该家族的成员。Daphniphyllum生物碱因其复杂多样的化学结构以及包括抗癌、抗氧化、抗艾滋病、促进神经生长因子等广泛的生物活性引起了众多科学家极大的关注[1]。20世纪80年代,Heathcock等人首次完成Daphniphyllum生物碱methyl homosecodaphniphyllate的全合成[2]。2011年,Carreira[3]和Weiss完成了(+)-daphmanidin E的全合成。此后,许多科学家完成多个具有挑战性结构的Daphniphyllum生物碱全合成[4],特别是李昂, Smith,Fukuyama,Hanessian,Dixon,翟宏斌,邱发洋,徐晶,高栓虎,Sarpong,李超,陆海华和李闯创分别完成了Daphniphyllum生物碱的一个或多个家族成员的全合成(Figure 1)。上述众多科学家在全合成中的工作不仅丰富了用于复杂靶点的新策略和新方法,而且促进了对生物合成与化学结构之间内在相关性的理解,进而补充了Heathcock的角鲨烯猜想[5]。
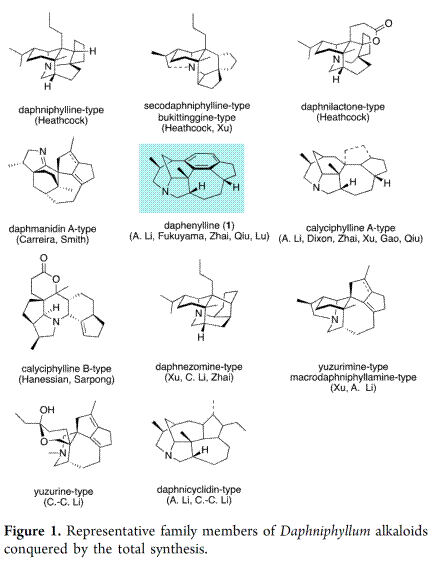
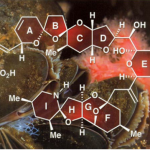
天然产物(−)-Daphenylline是Daphniphyllum生物碱家族中具有结构独特的成员之一,其是由中国科学院郝小江院士及其同事于2009年首次分离获得[6]。Daphenylline因其它具有独特1,2,3,4-四取代苯环结构,进而在calyciphylline A-型生物碱中脱颖而出,成为全合成的理想目标(Figure 2),如1)李昂研究员以6π-电环化为关键步骤首次完成了(-)Daphenylline的全合成 (2013)[7];2) Fukuyama教授以1,3-偶极环加成的关键步骤完成了该分子的全合成(2016) [8];3) 李昂研究员[9]和翟宏斌[10]教授分贝采用仿生重排为主要策略策略完成该分子的构建(2018);4)邱发洋以Diels-Alder反应为关键反应构建该分子的骨架[11, 12] (2019)(2021);5) 陆海华教授以氧化脱芳构化的策略实现此分子的合成[13]。近日,中科院昆明植物研究所的杨玉荣研究员团队从简单易得原料出发,仅需14步反应成功实现六环Daphniphyllum 生物碱(−)-daphenylline的简洁全合成。并发表于J. Am. Chem. Soc.上。
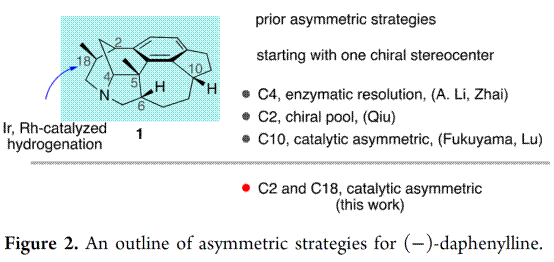
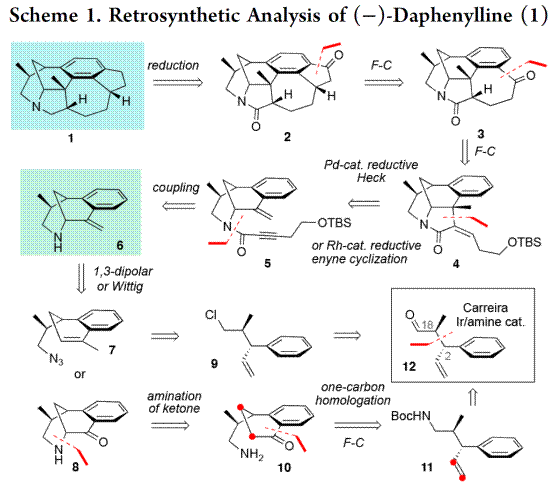
天然产物(−)-Daphenylline是唯一一个具有苯环6/6/6/5/7/5六环稠合的虎皮楠生物碱,分子中具有氮杂二环[3.3.1]壬烷结构单元,6个手性中心,其中一个是全碳的季碳中心(Figure 2)。基于上述结构,作者对(−)-Daphenylline (1)进行了相关的逆合成分析(Scheme 1)。即以市售的烯丙醇和丙醛经Carreira’s 铱/胺双元催化烯丙基化[14]构建两个叔碳立体中心构建砌块(12),(12)经还原胺化构建(11),(11)通过单-碳同系化和Friedel–Crafts酰化反应合成(10),(10)经酮α-胺化合成桥头胺中间体(8)。另外,(12)经还原和氯代构建(9),(9)通过单-碳同系化和Friedel–Crafts酰化反应合成(7)。随后,(7)通过叠氮和烯烃1,3-偶极环加成[15]或(8)经Wittig反应生成桥头烯丙基胺中间体(6)。(6)经过偶联合成中间体(5),(5)通过 Pd催化的还原Heck反应[16]或Krische’s Rh催化还原1,6-炔环化[17]构建四环骨架(4),(4)通过两次Friedel–Crafts反应合成关键砌块(2)。最后,(2)经还原反应完成天然产物(−)-Daphenylline的全合成。
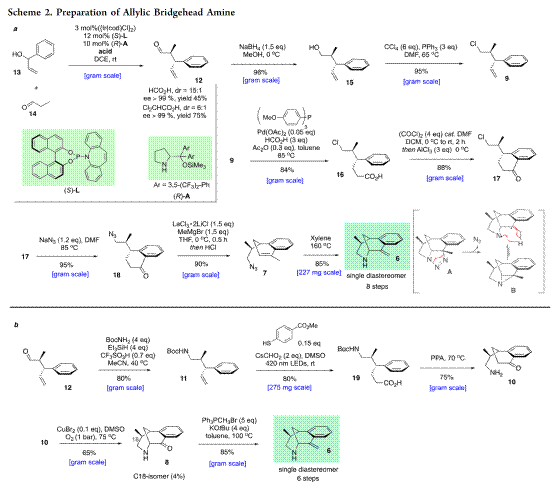
首先,作者通过两种方法对中间体(6)进行了相关合成分析,见Scheme 2 所示。

最后,作者完成了天然产物(−)-Daphenylline的全合成,见Scheme 3 所示。
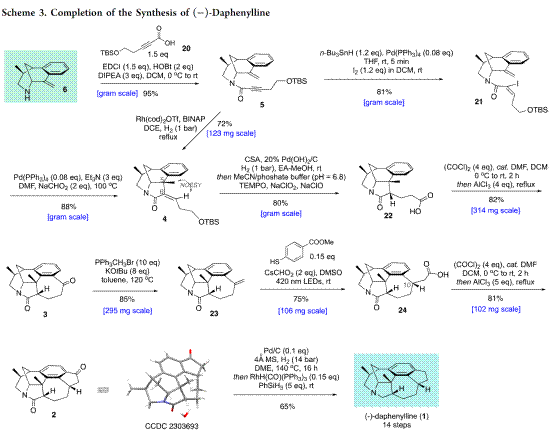

总结,杨玉荣研究员团队从简单易得原料出发,仅需14步反应成功实现六环Daphniphyllum 生物碱(−)-daphenylline的简洁全合成。其中关键步骤涉及1)Carreira铱/胺双元催化烯丙基化(Carreira’s Ir/amine dual-catalyzed allylation.)构建两个手性立体中心;2)Wickens光氧化还原催化烯烃的氢羧基化(Wickens’ photoredox-catalyzed hydrocarboxylation of olefin)和CuBr2催化酮的α-胺化等6步快速制备桥头烯丙基胺中间体;3)Pd催化的还原Heck反应或Krische Rh催化还原1,6-炔环化构建四环骨架。
参考文献:
- [1] J. i. Kobayashi, T. Kubota, Nat. Prod. Rep. 2009, 26, 936. doi:10.1039/B813006J.
- [2] C. H. Heathcock, S. K. Davidsen, S. Mills, M. A. Sanner, J. Am. Chem. Soc. 1986, 108, 5650. doi:10.1021/ja00278a061.
- [3] M. E. Weiss, E. M. Carreira, Angew. Chem., Int. Ed. 2011, 50, 11501. doi:10.1002/anie.201104681.
- [4] A. K. Chattopadhyay, S. Hanessian, Chem. Rev. 2017, 117, 4104. doi:10.1021/acs.chemrev.6b00412.
- [5] https://pubs.acs.org/doi/10.1021/ol9007958W. Zhang, M. Lu, L. Ren, X. Zhang, S. Liu, M. Ba, P. Yang, A. Li, J. Am. Chem. Soc. 2023, 145, 26569. doi:10.1021/jacs.3c06088.
- [6] Q. Zhang, Y.-T. Di, C.-S. Li, X. Fang, C.-J. Tan, Z. Zhang, Y. Zhang, H.-P. He, S.-L. Li, X.-J. Hao, Org. Lett. 2009, 11, 2357. doi:10.1021/ol9007958.
- [7] Z. Lu, Y. Li, J. Deng, A. Li, Nat. Chem. 2013, 5, 679. doi:10.1038/nchem.1694.
- [8] R. Yamada, Y. Adachi, S. Yokoshima, T. Fukuyama, Angew. Chem., Int. Ed. 2016, 55, 6067. doi:10.1002/anie.201601958.
- [9] Y. Chen, W. Zhang, L. Ren, J. Li, A. Li, Angew. Chem., Int. Ed. 2018, 57, 952. doi:10.1002/anie.201711482.
- [10] X. Chen, H.-J. Zhang, X. Yang, H. Lv, X. Shao, C. Tao, H. Wang, B. Cheng, Y. Li, J. Guo, J. Zhang, H. Zhai, Angew. Chem., Int. Ed. 2018, 57, 947. doi:10.1002/anie.201709762.
- [11] B. Xu, B. Wang, W. Xun, F. G. Qiu, Angew. Chem., Int. Ed. 2019, 58, 5754. doi:10.1002/anie.201902268.
- [12] B. Wang, B. Xu, W. Xun, Y. Guo, J. Zhang, F. G. Qiu, Angew. Chem., Int. Ed. 2021, 60, 9439. doi:10.1002/anie.202016212.
- [13] M.-Y. Cao, B.-J. Ma, Q.-X. Gu, B. Fu, H.-H. Lu, J. Am. Chem. Soc. 2022, 144, 5750. doi:10.1021/jacs.2c01674.
- [14] S. Krautwald, D. Sarlah, M. A. Schafroth, E. M. Carreira, Science 2013, 340, 1065. doi:10.1126/science.1237068.
- [15] R. Huisgen, 1963, 2, 565. doi:10.1002/anie.196305651.
- [16] S. Cacchi, A. Arcadi, J. Org. Chem. 1983, 48, 4236. doi:10.1021/jo00171a016.
- [17] H.-Y. Jang, F. W. Hughes, H. Gong, J. Zhang, J. S. Brodbelt, M. J. Krische, J. Am. Chem. Soc. 2005, 127, 6174. doi:10.1021/ja042645v.
- [18] S. N. Alektiar, J. Han, Y. Dang, C. Z. Rubel, Z. K. Wickens, J. Am. Chem. Soc. 2023, 145, 10991. doi:10.1021/jacs.3c03671.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.



















No comments yet.