最近小编在对课题中制备的化合物进行1H-NMR表征时,通过分析图谱意外发现了一个有意思的现象,某底物分子内的某个氢质子相比同系列其他底物中该位置的化学位移发生了非常显著的变化,多达3.00 ppm。小编在经过一番观察后发现了一个在起初设计时不易察觉到的分子内的屏蔽效应,判断正是底物中的一个芳环在空间取向上正好位于该质子下方而引起了这个奇异的变化。实验之余,小编对于这个效应突然起了兴致,因为去屏蔽效应在日常的核磁表征中是司空见惯的,芳环上的氢几乎都受去屏蔽效应影响,然而由芳环屏蔽效应引起的变化却并非常见。于是闲暇之余小编对相关文献进行了简单梳理,想对这个小的问题进行一个小小的归纳总结。
在进行这一写作时,小编不禁想起了有机全合成一代宗师R. B. Woodward在纪念Sir Robert Robinson诞辰七十周年的文集Perspectives in Organic Chemistry中,其所写的Synthesis一章中谈及五十年代尚处于萌芽时期的新的波谱学方法时对有机化学研究者的教诲:
“The capacity of the physical specialist to place his results properly in the context of an organic chemical investigation is often narrow and unrealistic, and the organic chemist will find himself magnificently rewarded, who takes pains to be himself in a position to understand and interpret the physical aids he wishes to use. In any event, physical methods, and the principle that they should be used whenever possible, are now part of our armamentarium, and we expect no surcease of further developments in this direction.”
他告诫有机化学家不要指望仰仗于物理学家和波谱学家来分析结果,因为他们对有机反应并不熟悉,给出的解释往往是不全面的,我们需要的是自己不辞辛劳地钻研。时至今日,核磁共振早已取代紫外以及红外成为有机化学日常研究中最为重要的技术手段,熟练掌握以及灵活应用这个手段,也就是能够读谱解谱,对于每一位研究人员来说是至关重要的。
背景介绍
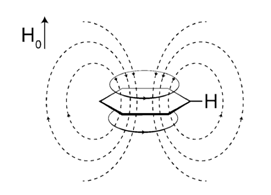
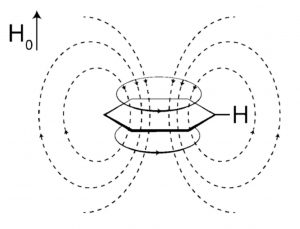
言归正传,一般常见的波谱解析书籍中在谈及影响氢谱的化学位移因素时都会提到环状共轭体系的环电流效应,简单说来可参考图1,以苯环为例所示,当苯环分子与外加磁场方向垂直时(即使不垂直成其他角度,也可以将其分解为水平与垂直磁场),其离域π电子将产生环电流,进而诱导产生磁场。环电流产生的磁场方向在苯环上下方与外加磁场方向相反,但在苯环侧面(苯环的氢正处在苯环侧面),两者的方向则相同,即诱导产生的磁场增强了外加磁场的作用,氢核被去屏蔽,化学位移向低场移动。
图1. 苯环的环电流效应
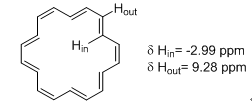
不仅是苯,有类似性质的还有具有4n+2个离域电子的环状共轭烯烃,都有强烈的环电流效应。如果在该环的上下方则受到强烈的屏蔽作用,这样的氢就会在高场出峰,δ值甚至会小于零。比如图2中的[18]轮烯,其环内的Hin化学位移为-2.99ppm,而环外Hout则为9.28ppm。
图2. [18]轮烯环内环外氢的化学位移
影响因素
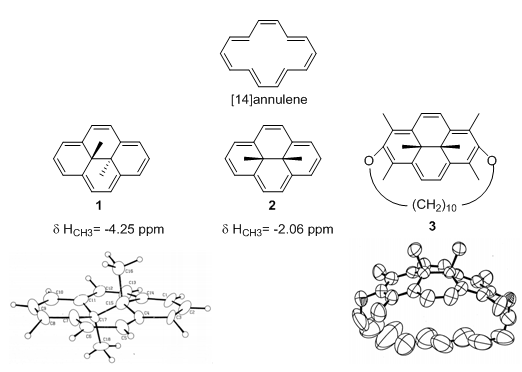
由于在芳香性研究中具有重要的理论价值,轮烯以及相似的芳环体系已经被系统地研究过。与[14]轮烯结构类似的还有10b,10c-二氢芘系统,其中的代表性化合物反式-10b,10c二甲基-10b,10c-二氢芘(trans-DMDHPs, 1)在1967年首次被制备成功,成为该类化合物中先驱性的研究。[1]然而,Reginald H. Mitchell在经过长达二十年的尝试后,才最终获得该化合物令人满意的晶体结构并在1995年发表。[2]对于其相应的顺式异构体2,直到2001年才第一次得到了具有顺式-10b,10c二甲基-10b,10c-二氢芘骨架的化合物3的单晶。[3]从图3中可以看到,1中二氢芘环较为平坦,两个处于反式的甲基的上的氢几乎位于分子中心区域,受环电流影响最大,而从3的提篮状结构反映出2的两个甲基进一步移动到远离分子中心的一侧,也就是远离屏蔽效应最强的区域。从实际数据分析,1的甲基的化学位移为-4.25 ppm,受屏蔽作用也的确强于2中化学位移为-2.06 ppm的两个顺式甲基。
图3. 10b,10c-二氢芘系统化合物的化学位移与晶体结构
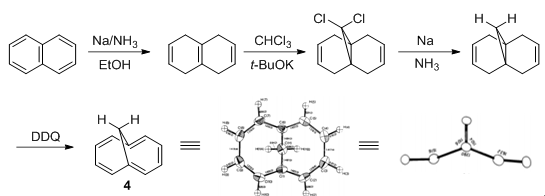
另一个常见的结构单元是1,6-亚甲基桥[10]轮烯(4),该化合物最早是由Vogel于1964年得到的,[4]可以萘为原料按图示1中路线制备。[5]
图示1. 1,6-亚甲基桥[10]轮烯的制备与晶体结构
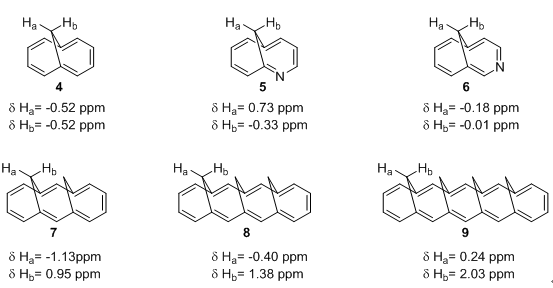
如图4,对于Vogel的1,6-亚甲基桥[10]轮烯进行修饰后测定亚甲基桥上的氢的化学位移可以发现,氮原子如果靠近亚甲基桥对于参考氢的化学位移会有明显影响,化合物5中两者数值之差可达1.00 ppm,而位置偏移后,6中两者化学位移就更接近。在Vogel制备的同系列化合物4,7,8和9中,Ha总是受屏蔽效应最强的,而整个环系列的趋势则呈现环电流变小,屏蔽效应减弱。[6]
图4. 1,6-亚甲基桥[10]轮烯及其衍生物的Ha,Hb化学位移
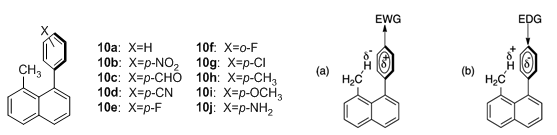
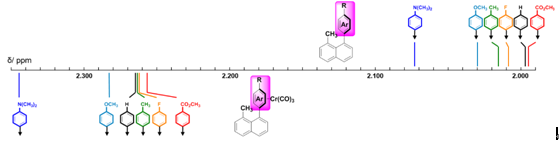
最近,Thamattoor等系统研究了芳环上取代基对处于芳环屏蔽区氢原子化学位移的影响。[7]与芳环上取代基对环上氢化学位移有显著影响不同,取代基对屏蔽区化学位移的影响十分有限。Thamattoor以图5中1,8-二取代萘环为模型,引入了一系列取代苯环,覆盖了强吸电子基团与供电子基团。
图5. 1,8-二取代萘系列化合物与极化模型
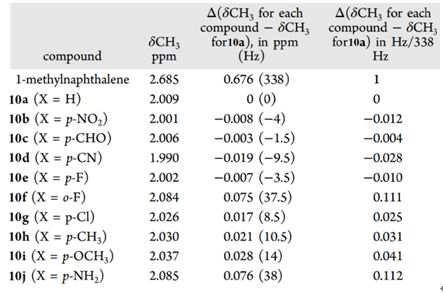
研究发现改变苯环取代基,表1中屏蔽区内氢原子的化学位移只有不超过0.08 ppm的变化范围。进一步的观察可以发现吸电子基团有一定的屏蔽作用,其氢偏向高场,而供电子基团则有去屏蔽作用,相应的氢处于低场。作者推测可能这些较弱的效应可能由取代基诱导通过空间产生的极化作用而引起,此外在氟取代的产物(10e与10f)观察到的异常现象与场效应也重要联系。
表1. 1,8-二取代萘系列化合物中处于苯环屏蔽区内氢的化学位移
在此研究基础之上,Thamattoor又以Cr(CO)6为原料对萘环上的取代苯环与Cr(CO)3进行配位,合成了一系列η6-1,8-二取代的萘金属复合物。[8]如图6对该系列化合物甲基上的氢的化学位移与其配位前体进行对比分析,可以发现取代苯环与金属配位后,甲基氢的化学位移明显比其前体处于低场(约0.25 ppm),并且富电子取代的苯环金属复合物相比于未取代的苯环处于更低场。总的来说配位金属片段对于化学位移的影响能力较苯环上的取代基更为显著,作者推测屏蔽效应的效果可能与金属复合物芳环芳香性减弱有关。
图6. 1,8-二取代萘金属复合物及其前体处于苯环屏蔽区内氢的化学位移对比
合成应用
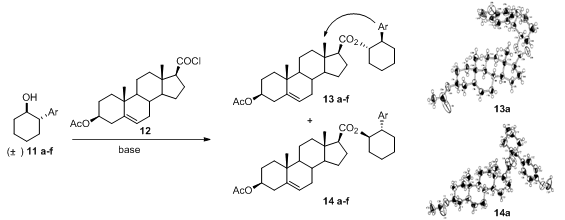
由于该屏蔽效应的产生对于分子内基团的空间取向有较强的要求,所以在分子存在不同结构的可能性时,例如不同立体异构体存在的情况下,屏蔽效应会表现出完全不同结果,利用该屏蔽效应可以达到区分立体异构体的效果。
图7. 11与12反应所得两种产物构型与产物13a,14a的单晶结构
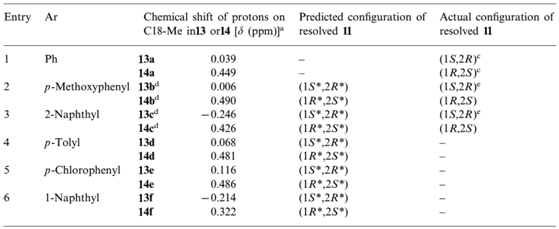
Yasuyuki等在2001年曾报道利用此效应成功区分反式-2-芳基环己醇的绝对构型。[9]Yasuyuki发现如图7中反式-2-芳基环己醇11中的芳环与具有甾体骨架的酰氯12中的C-18角甲基在反应后的产物中存在CH/π相互作用,在表2中可以看出核磁谱图中两种异构体产物的C-18甲基上氢的化学位移存在显著的区别,进一步的研究发现(1S,2R)构型芳基环己醇的产物由于存在分子内屏蔽作用而使其C-18甲基氢大幅度往高场移动,甚至低于0 ppm,而另外一个异构体该甲基氢则处于较低场,利用此方法可以从1H-NMR方便确定手性底物的绝对构型。
表2. 产物C-18甲基氢的化学位移与原料11的绝对构型
参考文献
- Boekelheide, V.; Phillips, J. B. J. Am. Chem. Soc. 1967, 89, 1695.
- Mitchell, R. H.; Iyer, V. S.; Khalifa, N.; Mahadevan, R.; Venugopalan, S.; Weerawarna, S. A.; Zhou, P. J. Am. Chem. Soc. 1995, 117, 1514.
- Bodwell, G. J.; Bridson, J. N.; Chen, S.-L.; Poirier, R. A. J. Am. Chem. Soc. 2001, 123, 4704.
- Vogel, E.; Roth, H. D. Angew. Chem., Int. Ed. Engl. 1964, 3, 228.
- Vogel, E.; Klug, W.; Breuer, A. Org. Synth. 1974, 54, 11.
- Mitchell, R. H. Chem. Rev. 2001, 101, 1301.
- Anson, C. W.; Thamattoor, D. M. J. Org. Chem. 2012, 77, 1693.
- Miles, W. H.; Robinson, M. J.; Lessard, S. G.; Thamattoor, D. M. J. Org. Chem. 2016, 81, 10791.
- Matsugi, M.; Itoh, K.; Nojima, M.; Hagimoto, Y.; Kita, Y. Tetrahedron Lett. 2001, 42, 6903.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





















No comments yet.