本文作者:杉杉
导读
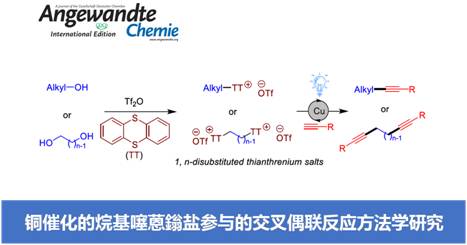
近日,南京大学史壮志与陆红健课题组在Angew. Chem. Int. Ed.中发表论文,报道一种在温和的光诱导条件下,将新型的烷基化试剂,即烷基噻蒽鎓盐 (thianthrenium salts),成功应用于铜催化剂促进的Sonogashira偶联反应方法学,进而有效地完成C(sp3)-C(sp)键的构建。同时,研究表明,多种不同类型的烷基噻蒽鎓盐以及双取代的噻蒽鎓盐,同样能够有效地参与上述的偶联过程。并且,具有敏感性的基团 (例如Cl、Br与I)的噻蒽鎓盐底物,同样均能够与上述的偶联反应条件良好地兼容。此外,研究发现,这一全新的噻蒽鎓盐烷基化试剂同样能够较好地应用于铜催化的Kumada反应。
Enabling Alkyl Thianthrenium Salts in Cross-Couplings by Copper Catalysis
C. Chen, M. Wang, H. Lu, B. Zhao, Z. Shi, Angew. Chem. Int. Ed. ASAP. doi:10.1002/anie.202109723
正文
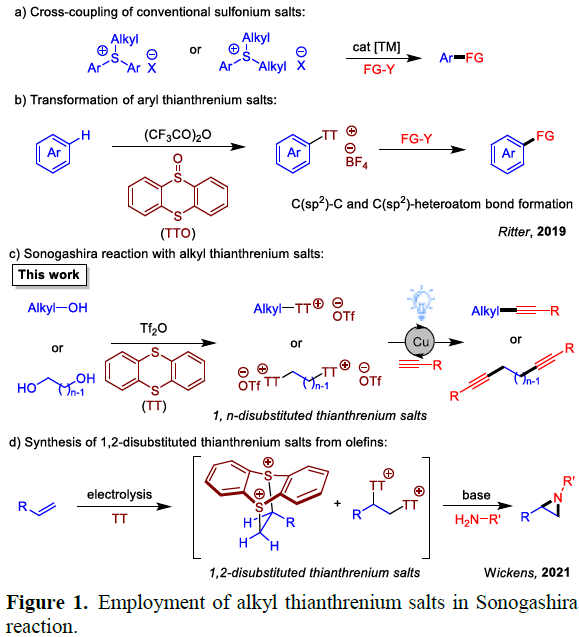
锍盐 (sulfonium salt)由于其高度的化学反应活性,长期以来,备受合成化学家的广泛关注。上述化合物类似于有机卤代物,具有优良的离核性能 (nucleofugal properties),因此,能够较为容易地参与相应的单电子还原过程,并能够与各类过渡金属试剂进行相关的氧化加成过程。同时,由于锍盐中C(sp2)-S键更容易断裂,锍盐可作为芳基化试剂,目前已经广泛应用于多种不同类型的合成转化过程(Figure 1a)。而且,锍盐类化合物同样能够通过α-去质子化过程,较为容易地转化为相应的硫叶立德。然而,通过C(sp3)-S键的断裂过程,由锍盐形成相应的烷基化中间体,并进一步应用于新型交叉偶联策略的设计,则具有较多的挑战。近期,涉及噻蒽鎓盐 (thianthrenium salt)参与的相关方法学研究,已有诸多的文献报道[1]。2019年,Ritter课题组[2]报道一种通过芳香C-H键官能团化过程,形成的芳基噻蒽鎓盐参与的C(sp2)-C以及C(sp2)-杂原子键的构建 (Figure 1b)。受到上述报道的启发,作者设想,噻蒽鎓盐同样可能通过选择性的C(sp3)-S键断裂,形成相应的烷基化中间体,进而应用于后续交叉偶联反应策略的设计。
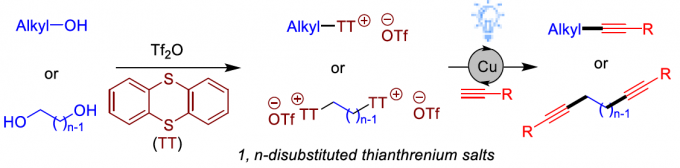
这里,南京大学史壮志与陆红健课题组报道在蓝光LED辐射条件下,通过铜催化剂促进的一系列烷基噻蒽鎓盐 (烷基化试剂)参与的Sonogashira反应方法学,进而成功实现C(sp3)-C(sp)键的高效构建 (Figure 1c)。同时,研究发现,烷基噻蒽鎓同样能够有效地应用于Kumada反应[3]。其中,烷基噻蒽鎓盐能够通过在相应的醇原料中加入噻蒽 (thianthrene, TT)与Tf2O试剂,较为方便地进行合成。值得注意的是,Wickens课题组[4]通过电化学策略,采用烯基化合物与TT作为起始原料,顺利完成一系列1,2-二取代噻蒽鎓盐的合成,并将其作为关键中间体,成功应用于各类氮丙啶分子的构建 (Figure 1d)。而采用本课题组发展的相关策略,则能够采用各类二醇化合物作为起始原料,进而成功获得一系列1,n-二取代噻蒽鎓盐。
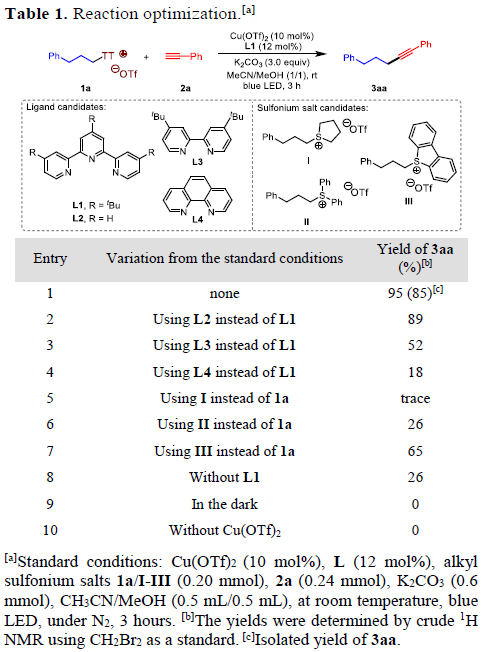
首先,作者采用烷基噻蒽鎓盐1a与苯乙炔2a作为模型底物,进行相关偶联反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用Cu(OTf)2作为催化剂,L1作为配体,K2CO3作为碱,在MeCN与MeOH的混合溶剂中,蓝光LED辐射条件下,室温反应3 h,最终获得95%收率的偶联产物3aa。
在上述的最佳反应条件下,作者首先对烷基噻蒽鎓盐的底物应用范围进行考察 (Table 2)。研究表明,一系列一级烷基噻蒽鎓盐底物,均能够与苯乙炔顺利进行相应的偶联过程,并获得偶联产物3ba–3ra,收率为42-92%。值得注意的是,与传统的Sonogashira偶联反应相比,这一全新的偶联策略具有独特的化学选择性,并能够良好地兼容噻蒽鎓盐底物中的卤烷基以及卤代芳基 (3ga–3ma)。同时,上述的标准反应条件对于具有杂芳基、烯基以及炔基的噻蒽鎓盐,同样能够良好地兼容,并获得产物3na–3ra。并且,该小组进一步发现,非环以及环状的二级烷基噻蒽鎓盐底物,同样能够高效地参与上述的偶联过程,并获得产物3sa–3va,收率为62-75%。此外,研究发现,上述的最佳反应条件对于具有三重cis-双键的α-亚麻酸 (α-linolenic acid)衍生的噻蒽鎓盐底物,同样能够以50%的收率获得相应偶联产物3wa,并且,反应过程中,双键的Z-构型能够完全保持。最后,该小组观察到,上述的标准反应条件对于采用石胆酸 (lithocholic acid)作为起始原料制备的噻蒽鎓盐底物,同样能够表现出良好的反应活性,并获得目标产物3xa。
接下来,作者对端炔底物的应用范围进行进一步考察 (Table 3)。研究表明,一系列芳基不同位置中具有吸电子与供电子基团取代的芳乙炔底物,均能够与1a顺利进行相应的Sonogashira偶联过程,并获得预期的目标产物3ab–3ak,收率为63-93%。之后,作者发现,具有有三甲苯基、萘基与菲基取代的端炔以及杂环芳基取代的端炔底物,同样能够较好地与上述的标准反应体系兼容,并获得相应的产物3al–3aq,收率为70-88%。同时,研究发现,采用硅烷基乙炔底物2r与1a反应时,同样能够获得相应的偶联产物3ar,并通过后续的去保护步骤,进一步构建新的端炔分子。此外,烷基取代的端炔底物同样能够较好地参与上述的Sonogashira偶联过程,并以58-81%的收率,获得非对称二烷基炔产物3as–3av。并且,作者进一步观察到,上述的标准反应条件对于具有三重端炔基团的底物,同样能够顺利地完成相应的三重偶联反应过程,并获得42%收率的产物3aw。
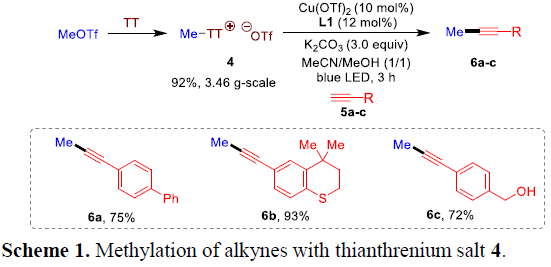
S-腺苷甲硫氨酸 (S-adenosylmethionine, SAM)类化合物为天然存在于生物体内的锍盐分子,能够通过SN2机理路径,对核酸、蛋白质以及天然产物等复杂分子进行有效的甲基化反应。受上述生物甲基化过程的启发[5],作者采用MeOTf与TT作为原料,成功制备出相应的甲基噻蒽鎓盐4 (Scheme 1)。令人兴奋的是,作者发现,端炔底物5a–5c均能够顺利与噻蒽鎓盐4进行相关的Sonogashira偶联反应,并获得甲基化产物6a–6c,收率为72-93%。
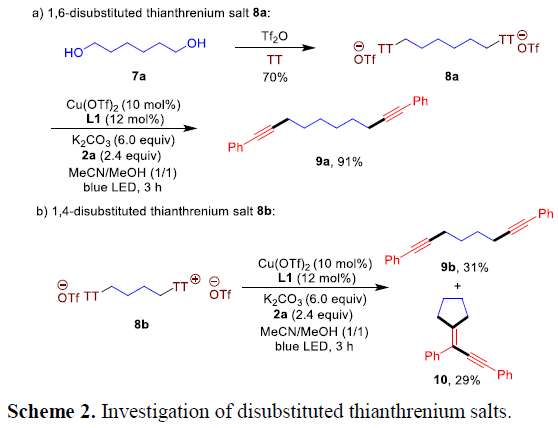
除文献中已经报道的[4]通过烯基化合物的电化学策略,进行1,2-二取代噻蒽鎓盐的制备以外,同样能够通过二醇化合物作为起始原料,直接合成相应的二取代噻蒽鎓盐底物。例如,通过二醇7a与TT以及Tf2O之间的反应,制备出所需的1,6-二取代噻蒽鎓盐8a,之后,再与2a在上述标准条件下,进行相应的Sonogashira偶联反应,即可获得91%收率的二炔产物9a。有趣的是,在采用1,4-二取代噻蒽鎓盐8b作为反应底物与2a进行反应时,能够获得31%收率的目标产物9b以及29%收率的副产物10 (可能源自于通过环化以及乙烯基自由基捕获步骤进行的自由基串联过程)。
此外,该小组发现,上述的烷基噻蒽鎓盐底物同样能够较好地应用于一系列复杂分子的后期衍生化过程 (Scheme 3)。例如,D-葡萄糖衍生物11、具有敏感性NH基团的天冬氨酸衍生物 (aspartic acidderivative)13、带有端炔结构单元的药物分子mestranol15与erlotinib17等,均能够在上述的最佳反应条件下,顺利完成相应的后期烷基化反应 (late-stage alkylation)过程。
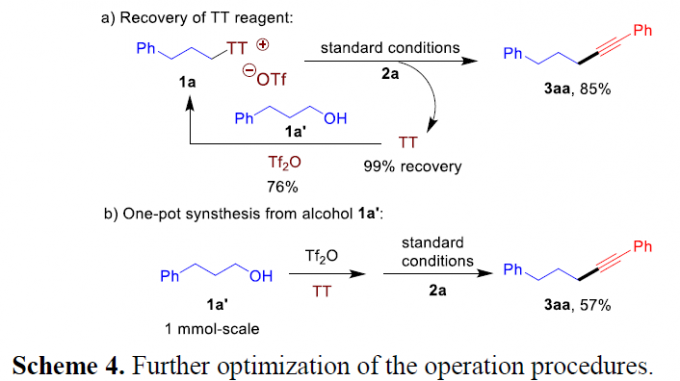
接下来,作者对上述偶联反应策略的合成实用性进行深入研究 (Scheme 4)。首先,作者发现,在上述的标准条件下,1a与2a之间的反应中,TT试剂能够在反应结束后,以近乎定量的收率进行回收 (Scheme 4a)。之后,作者发现,采用醇作为初始原料进行的一锅tandem反应过程,同样能够获得相应的炔基化产物 (Scheme 4b)。例如,通过醇1a’与TT以及Tf2O试剂反应,形成的噻蒽鎓盐1a,在上述标准条件下,进一步与2a反应,最终能够获得57%收率的产物3aa。
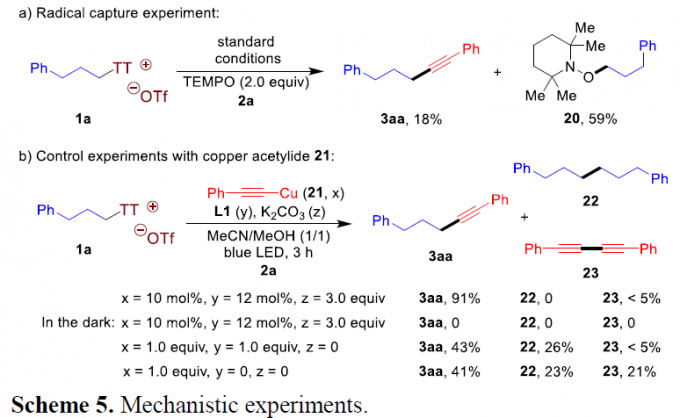
为提出合理的反应机理,作者进行相关的自由基捕获实验与控制实验研究(Scheme 5)。首先,作者发现,在1a与2a的标准反应体系中,加入2eq.自由基捕获剂TEMPO时,产物3aa的收率出现显著降低,并获得59%收率的TEMPO加合物20 (Scheme 5a),进而表明反应过程中涉及自由基中间体的形成。之后,作者发现,在采用预先合成的炔铜21作为催化剂时,1a与2a能够在蓝光LED辐射条件下,顺利地完成上述的偶联过程,并获得91%收率的产物3aa,这一事实表明,炔铜21作为催化循环过程中的关键中间体。同时,该小组观察到,在选择化学计量的配合物21与三联吡啶类 (terpyridine)配体L1结合时,2a能够参与相应的二聚反应过程,形成副产物22。接下来,作者观察到,配体L1的加入,对于抑制端炔同偶联产物23的形成尤为关键。并且,该小组通过CV (cyclic voltammetry)研究,进一步证实,在激发态的炔铜配合物21与配体L1配位之后,氧化还原电势显著增强(E1/2 = -1.20 V vs. Ag/AgNO3),并能够有效地还原相应的噻蒽鎓盐底物1a (E1/2 = -0.95 V vs. Ag/AgNO3,参阅supporting information)。基于上述的实验事实以及前期的研究报道[6]-[7],作者假设,激发态的炔铜配合物能够对噻蒽鎓盐底物进行还原,并产生相应的烷基自由基,进而形成C(sp3)-C(sp)键。
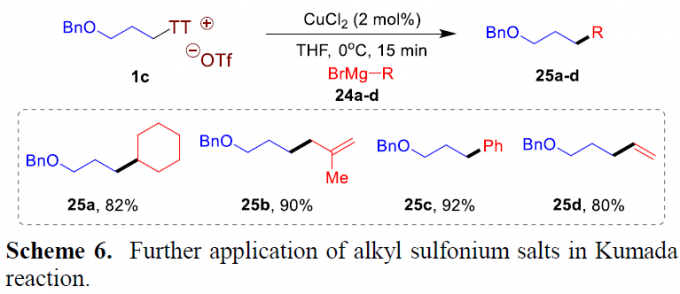
此外,作者进一步研究发现,烷基噻蒽鎓盐底物同样能够与Grignard试剂进行相应的Kumada偶联反应 (Scheme 6)。并且,在铜催化体系中,一系列不同类型的Grignard试剂,例如,烷基、烯丙基、苯基以及乙烯基Grignard试剂,均能够与烷基噻蒽盐1c顺利地完成相应的Kumada偶联过程,并获得目标产物25a–25d,收率为80-92%。
总结
南京大学史壮志与陆红健课题组报道一种通过新型的烷基化试剂即烷基噻蒽鎓盐 (thianthrenium salts)参与的铜催化Sonogashira偶联反应方法学,进而顺利完成相应C(sp3)-C(sp)键的构建。这一全新的偶联策略具有反应条件温和、底物应用范围广泛以及高度的官能团兼容性等优势。同时,该小组通过对各类复杂分子的后期衍生化实验,进一步阐明上述策略的合成应用价值。























No comments yet.