本文作者:杉杉
导读
轴手性联芳基化合物广泛存在于功能材料、生物活性分子、天然产物、药物、手性催化剂/配体中。近日,武汉大学周强辉教授课题组在Nature Catalysis上发表论文,报道了通过钯/手性降冰片烯协同催化,成功建立了一种构建轴手性化合物的通用方法。该方法涉及芳基碘、2,6-二取代的芳基溴与烯烃(或炔烃,硼酸等)的三组分串联过程,从而获得带有多种官能团的手性联芳基化合物(高达88个)。此外,该方法学具有出色的对映选择性、步骤经济性以及易克级放大等优点。
Construction of axial chirality via palladium/chiralnorbornene cooperative catalysis
Ze-Shui Liu, Yu Hua,, Qianwen Gao, Yuanyuan Ma, Hua Tang, Yong Shang, Hong-Gang Cheng and Qianghui Zhou
Nat. Cata. ASAP. DOI: 10.1038/s41929-020-0494-1
正文
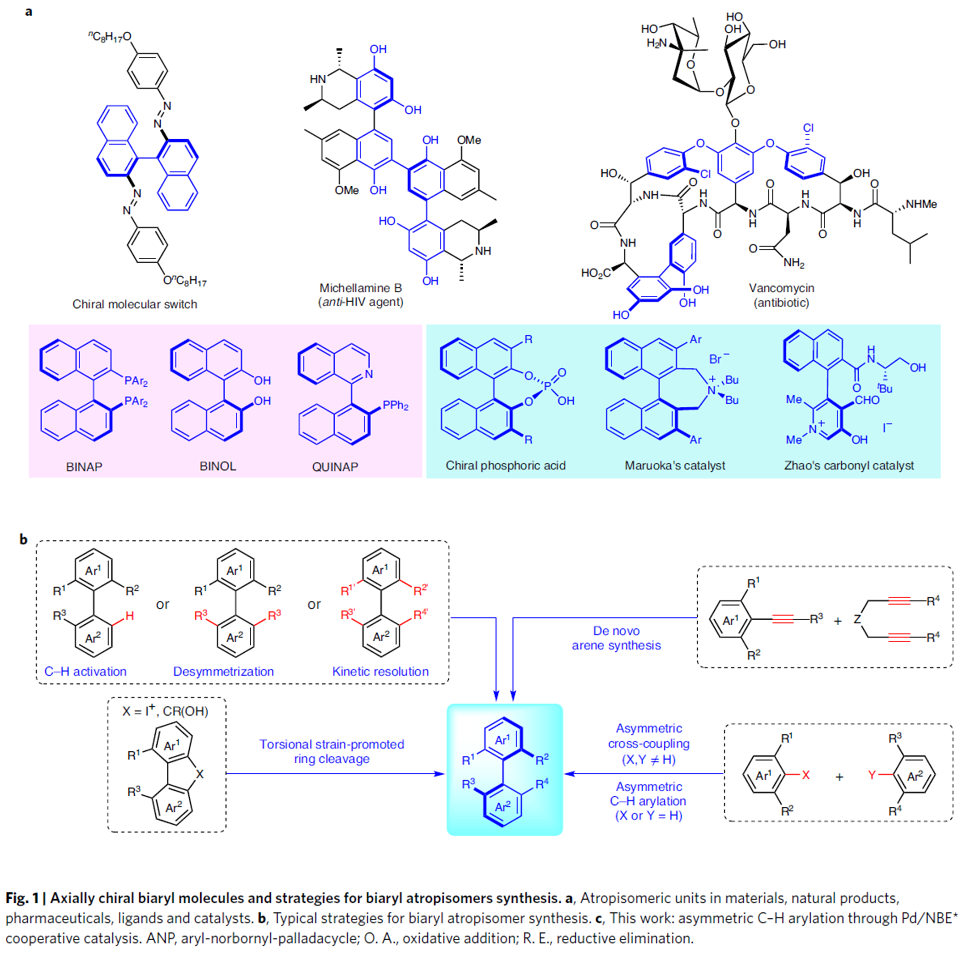
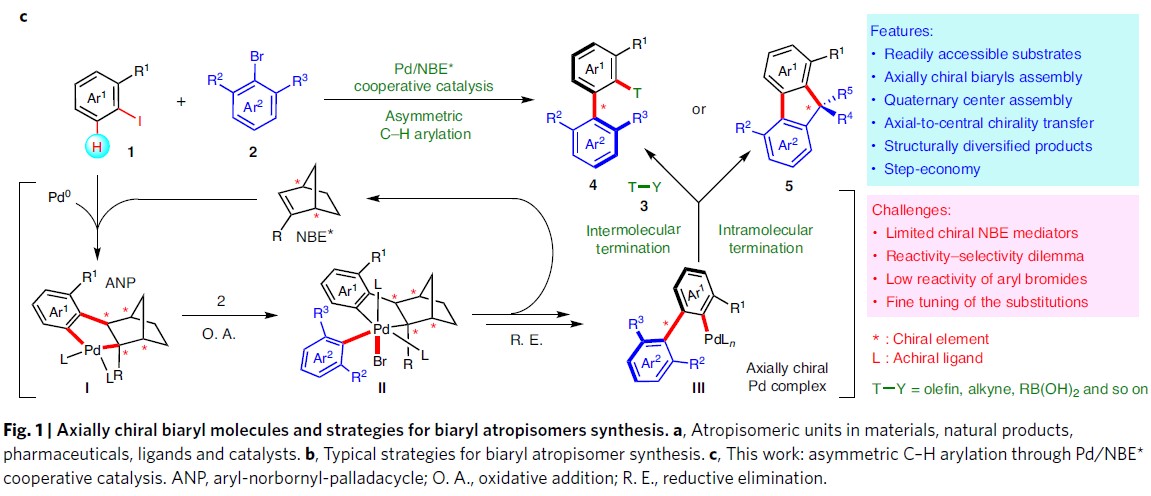
轴手性,通常是由具有较大位阻的芳基-芳基键的旋转受阻产生,代表了一种独特的立体异构模式。轴手性化合物广泛存在于在手性材料、天然产物、药物、手性配体和催化剂中(Fig. 1a)。因此,联芳的阻转选择性合成(Atroposelective synthesis),一直作为有机化学领域的热点。到目前为止,已取得了显著的研究进展,如C-H键活化、去对称化、动力学拆分、不对称交叉偶联、不对称C-H芳基化等等(Fig. 1b)。由于此类方法常需使用官能团化的底物或复杂的催化剂,从而使其应用受到限制。
Itami、Waldmann、Cramer课题组,发现不对称C(sp2)-H芳基化是合成轴手性联芳类化合物最为简便的策略。然而,些方法中面临的巨大挑战在于起始原料存在较高的立体位阻,进而导致反应活性与立体选择性存在一定的竞争关系。Catellani反应是运用金属-有机协同催化策略,高效合成联芳基化合物典型实例。然而,目前为止,几乎没有实现不对称形式,并且唯一成功的例子是使用手性膦配体。
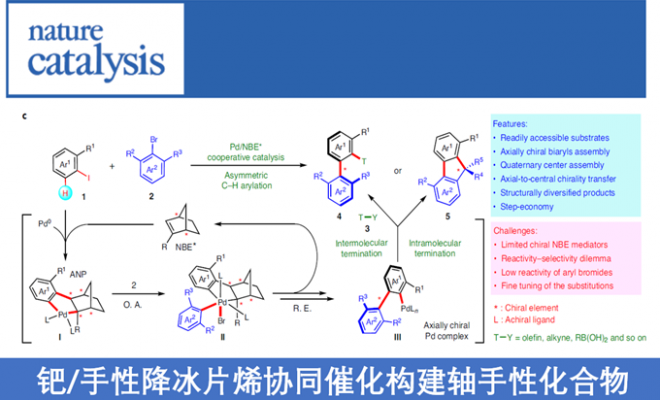
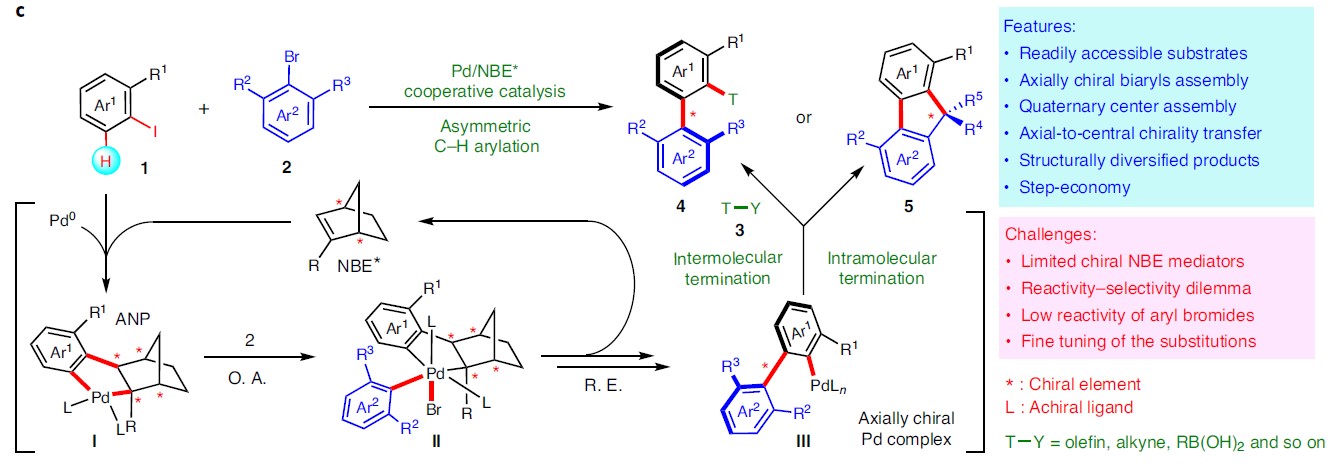
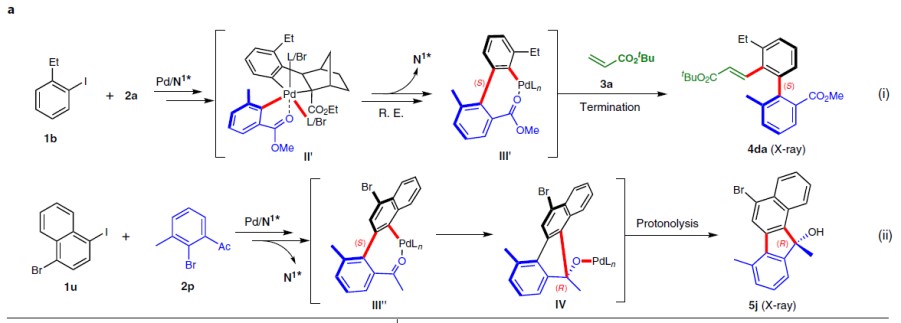
作者受钯与2-降冰片烯(Pd/NBE)协同催化(cooperative catalysis))能够在芳卤的本位与邻位同时进行官能化启发,作者设想通过钯与手性降冰片烯(Pd/NBE*)的协同催化策略,应该能够顺利完成轴手性联芳的构建(Fig. 1c)。首先,芳基碘1与钯催化剂、NBE*进行氧化加成以及NBE与Pd(II)间发生钯碳化反应,形成ANP配合物I,随后通过2,6-二取代的芳基溴2的进一步氧化加成,形成手性PdIV配合物II。接下来,经过还原消除与β-碳消除的串联过程 (cascade process),形成轴手性PdII配合物III。配合物III既能够与常规终止剂(T-Y,3)偶联,形成轴手性联芳4,又能够通过分子内过程终止(轴手性向中心手性的转化),产生具有季碳中心的手性芴5。由于芳卤以及终止剂均廉价易得,因而,该策略可成为各类常见的手性联芳与手性芴合成的通用与标准化的方法。此外,该方法存在如下挑战:(1)由于空间位阻的增加,2,6-二取代底物2的反应活性出现显著下降。(2)1和3之间的直接偶联反应存在在竞争性副反应。(3)需要筛选出同时具有优良反应活性与优良立体化学诱导性能的NBE*不对称诱导媒介,从而打破这种反应活性与立体选择性的竞争关系存在一定困难。在此,武汉大学周强辉教授课题组报道了一种基于Pd/NBE*协同催化,从而实现轴手性联芳化合物合成的通用方法。该方法以常见的芳基碘作为底物,2,6-取代芳基溴作为芳基化试剂,并通过与各类终止剂(如烯烃、炔烃、硼酸等)进行后续的分子间终止过程,从而获得一系列结构多样化的轴手性联芳化合物。此外,如果以分子内方式终止(即通过轴手性向中心手性的传递),最终可以完成各类手性芴醇分子的构建。
首先,作者以2-碘甲苯(1a),2-溴-3-甲基苯甲酸甲酯(2a)与丙烯酸叔丁酯(3a)为模型反应,进行相应反应条件的筛选。最终,作者发现,当采用10 mol%的Pd(OAc)2作为催化剂,50 mol%的(1S, 4R)-2-乙氧羰基取代的手性降冰片烯(99%e.e.)(N1*)作为NBE*不对称诱导媒介,可获得65%收率与97%e.e.的联芳产物4aa。
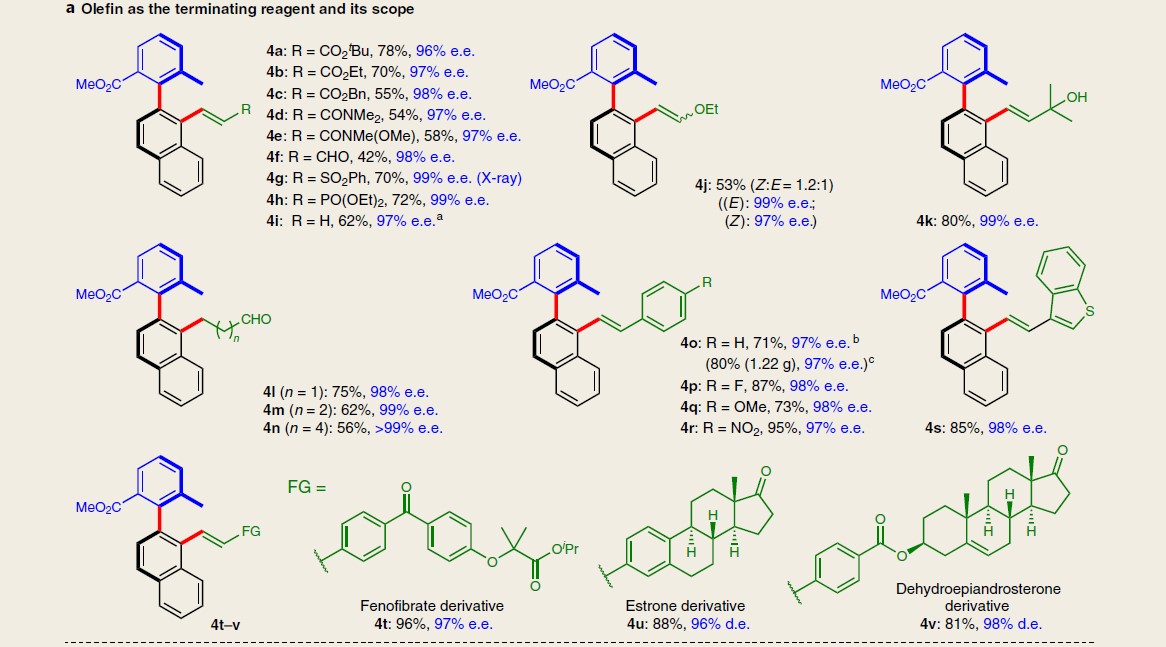
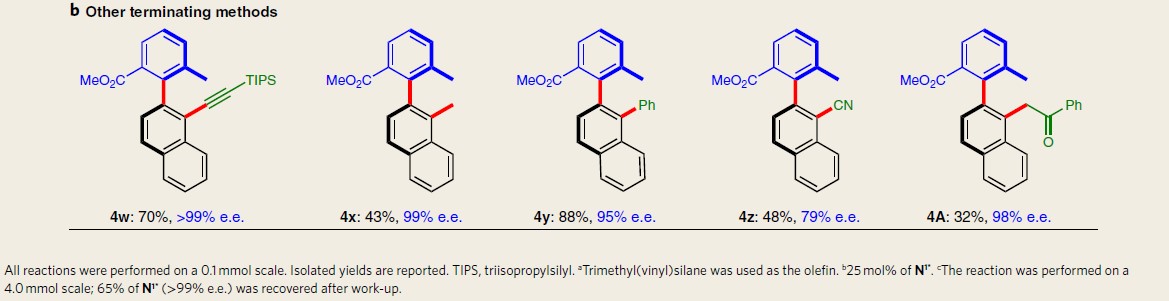
在获得上述最佳反应条件后,作者首先开始考察终止剂3的应用范围(Table 1)。为方便在手性色谱柱中更好地测定反应过程的对映选择性,作者采用1t代替1a。研究表明,烯烃底物不受电子效应的影响,均以中等至良好的产率与优良的对映选择性获得各类取代的轴手性联芳产物4a–4v。值得注意的是,采用烯丙位无取代基的烯丙醇参与上述反应,以良好的产率与优良的对映选择性,获得相应轴手性芳香醛产物4l–4n。而在与一些药物衍生的复杂苯乙烯底物反应时,同样可以获得相应的轴手性联芳产物4t–4v。除烯基化合物外,其他类型的终止剂也适用(如炔烃、硼酸、氰化物和酮),均可获得相应的轴手性联芳产物4w–4z以及4A,但由于产物4z具有较低的构型稳定性,因而导致收率偏低。
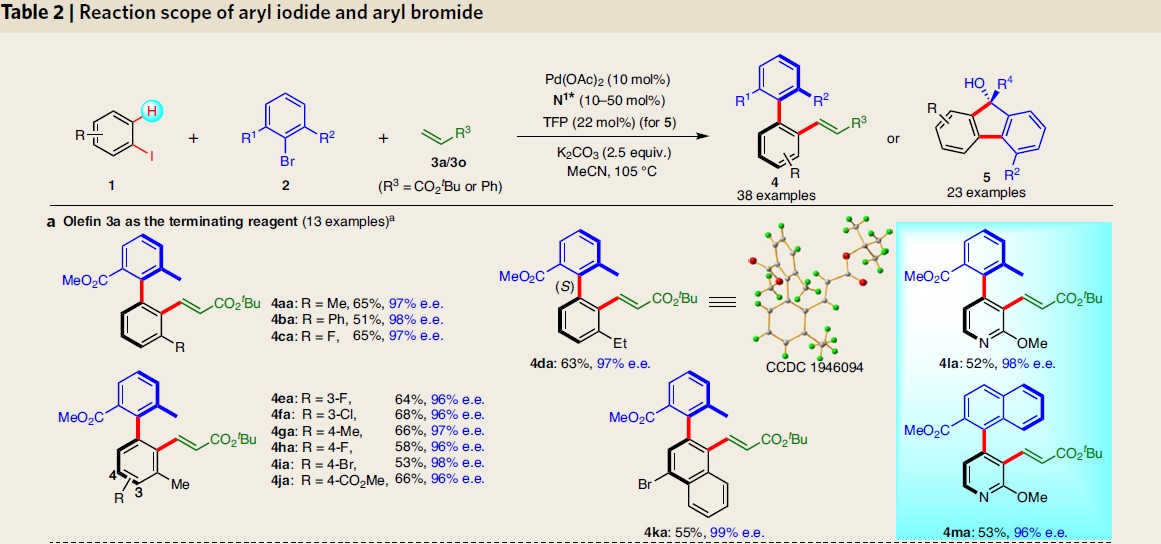
接下来,作者溴化物2a以及烯烃3a或3o与芳基碘的反应研究,进一步对芳基碘1的应用范围进行考察(Table 2a)。研究表明芳基碘底物中取代基电子效应对反应无显著影响,该反应条件对于卤素、烷氧基、酯等官能团化的芳基碘均能够良好的耐受,均以51-93%的收率和96-99%的e.e.获得所需的手性联芳4aa–4ma。同时,作者进一步发现,采用苯乙烯3o代替3a时,通常收率会更高,可能是由于其反应性较低,从而导致Heck反应途径受到抑制。
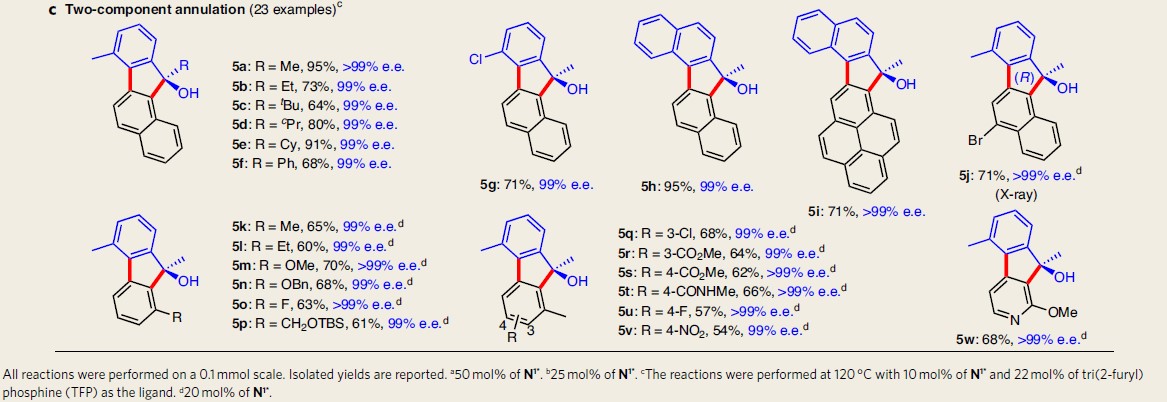
同时,作者对芳基溴2的应用范围进行了考察(Table 2b)。结果表明,含有各种官能团(如酯、酰胺、羧酸、硝基、磷酰基、烷基、羟甲基等)取代的芳基溴底物,均能够以良好的产率与优良的对映选择性获得相应轴手性联芳产物4jo–4yo。此外,作者观察到,当底物2中存在邻乙酰基取代时,仅能够获得99%e.e.的芴醇5a(Table 2c)。同时,作者提出5a的形成源自于活性乙酰基中的羰基基团向亲核Ar-Pd键内有利的分子内迁移插入过程,并伴随轴手性向中心手性的传递。因此,作者同样对该不对称环化的底物范围进行扩展研究。作者发现,芳基碘1与各种不同基团 (如烷基5a-5c、环烷基5d-5e、苯基5f)取代的2-羰基的芳基溴2均是合适的底物,获得相应的产物5a–5w。
值得注意的是,非手性配体TFP有利与该转化过程的顺利进行。此外,对于5a–5i,N1*的用量可降低至10 mol%。更重要的是,尽管反应温度高达120 ℃,然而,所有底物的不对称环化过程均能够以优良的对映体选择性,获得相应手性芴醇。这表明该方法具有强有力的立体化学控制性能。
随后,作者根据Fig 1中的机理假设,提出了相应的立体诱导模型(Fig. 2a),2的芳基部分位于PdIV配合物II’的平面位置(使其立体阻碍最小)。重要的是,底物2中的吸电子基团能够与钯中心配位,因此,使底物2中芳基的位置固定,从而与底物1的芳基部分形成稳定的二面角。在经与β-碳消除之后,获得S-构型的钯配合物III’并通过与终止剂进一步作用,最终获得S-构型产物4da(Fig. 2ai)。类似地,通过底物1u与2p反应,形成的S-构型钯配合物III”,随后经分子内迁移插入与去钯化质子化串联过程,进而获得R-构型的芴醇5j(Fig. 2aii)。
此外,作者也对反应的实用性进行了研究(Fig. 2b)。轴手性的联芳化合物是构建具有合成应用价值的配体与催化剂的关键砌块,例如还原4xo,可获得手性膦-烯配体6,进而用于钯催化的不对称烯丙基化反应(Fig. 2biii)。同样,将4wo还原为手性醛7,并进一步转化为Guo手性醛催化剂(Fig. 2biv)。同时,通过氧化裂解,能够将7进一步转化为二醛8,进而用于合成各类有用的手性催化剂与配体(Fig. 2bv)。
总结
武汉大学周强辉教授课题组通过Pd/NBE*协同催化,实现了一种构建轴手性化合物(手性联芳基和芴醇)的有效策略。该策略具有独特的立体诱导方式、优良的对映选择性、高度的官能团兼容性、步骤经济性等优点。此外,通过该方法学,能够顺利完成各类具有合成应用价值的手性配体与催化剂的构建。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



























No comments yet.