本文作者:杉杉
导读
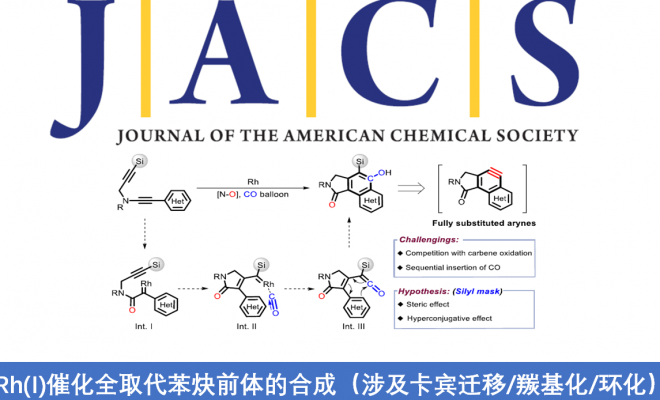
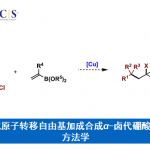
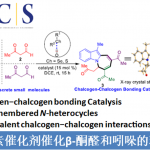
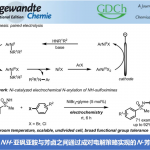
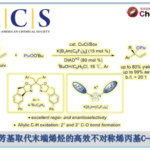
近日,华东师范大学姜雪峰课题组在J. Am. Chem. Soc.发表论文,报道了Rh(I)催化卡宾(carbenoid)的串联反应,然后进行羰基化环化反应,合成多种邻甲硅烷基取代的酚类化合物(phenolics),再通过氟磺化反应(fluorosulfurylation)即可获得全取代芳炔前体。值得注意的是,炔烃末端的甲硅烷基不仅可抑制不希望的氧化,而且还可以控制CO插入的选择性。此外,该方法作为直接构建全取代芳炔的有效途径,并可用于多环芳烃分子的构建。
Rh(I)-Catalyzed Carbene Migration/Carbonylation/Cyclization: Straightforward Construction of Fully Substituted Aryne Precursors
Guohao Zhu, Wen-Chao Gao, Xuefeng Jiang*
J. Am. Chem. Soc.ASAP DOI:10.1021/jacs.0c13012
正文
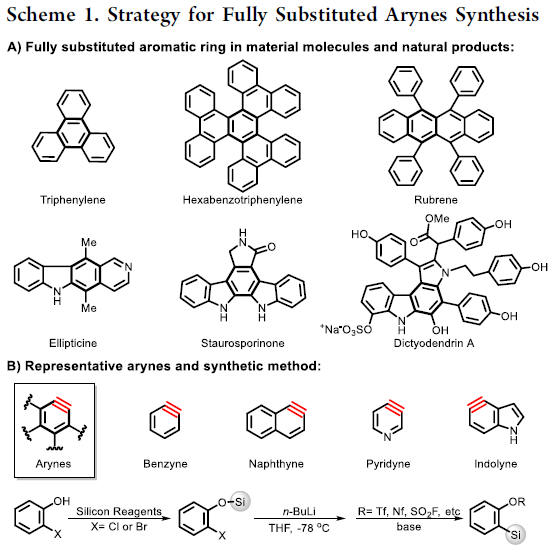
长期以来,芳炔(Arynes)由于具有出色的反应活性而作为构建功能性芳烃(arenes)的强大底物。自1953年Robert等[1]利用苯炔(benzyne)三键性质以来,已报道多种苯炔,如萘基炔、吡啶炔和吲哚炔,用于合成功能材料分子和天然产物。同时,含有全取代芳环骨架的三亚苯基(Triphenylenes),六苯并三亚苯基(hexabenzotriphenylenes)和红荧烯(rubrenes)可分别由苯炔,9,10-菲基炔和萘基炔构建。此外,苯炔也可有效地用于多环天然产物的合成,如通过吡啶炔的环加成反应获得玫瑰树碱(Ellipticine),由苯炔的串联反应构建dictyodendrin A的全取代芳烃体系(Scheme 1A)。
早期对于获得芳炔的方法,主要依赖于在碱性条件下芳基卤化物的脱卤化氢(dehydrohalogenatio)作用。随后,Kobayashi等[2]开发了一种简便合成芳炔的方法,即通过氟化物诱导2-(三甲基甲硅烷基)苯基三氟甲磺酸酯的1,2-消除,从邻卤代苯酚中获得芳炔,然后引入一种甲硅烷基取代基和离去基团(Scheme 1B)。最近,Hoye等[3]通过三炔的六脱氢-Diels-Alder(HDDA)工艺开发了一种创新的多环芳烃合成策略。
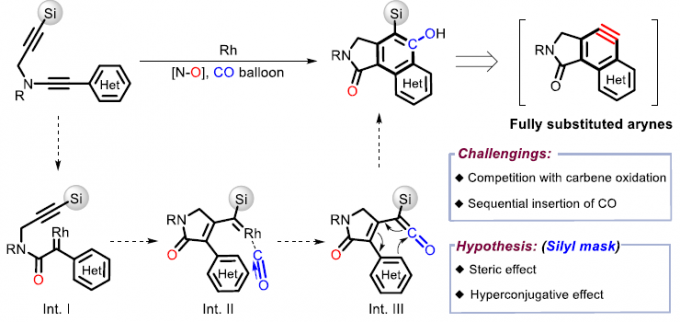
基于本课题组对过渡金属催化芳炔羰基环化反应研究 [4],作者设想是否可以通过卡宾迁移,CO插入和6π电环化的串联过程,从炔基-炔胺(yne-ynamides)中直接合成全取代的芳炔前体(Scheme 1C)。然而,两种卡宾之间的氧化竞争性和一氧化碳的插入顺序作为反应关键性的挑战。由于硅取代基的空间效应和超共轭效应,作者设计了一种含有甲硅烷基的炔基-炔胺,以抑制不希望的氧化和CO插入的选择性,同时促进了芳炔前体。
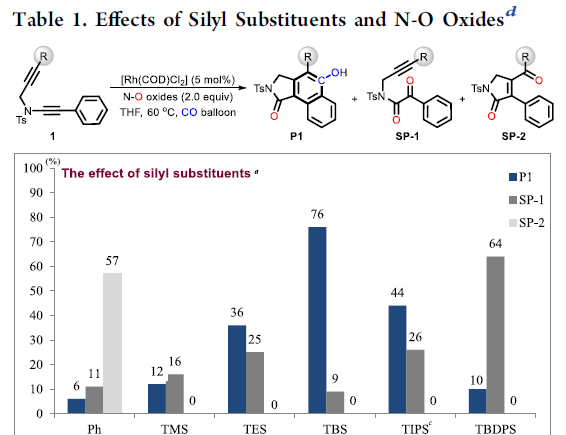
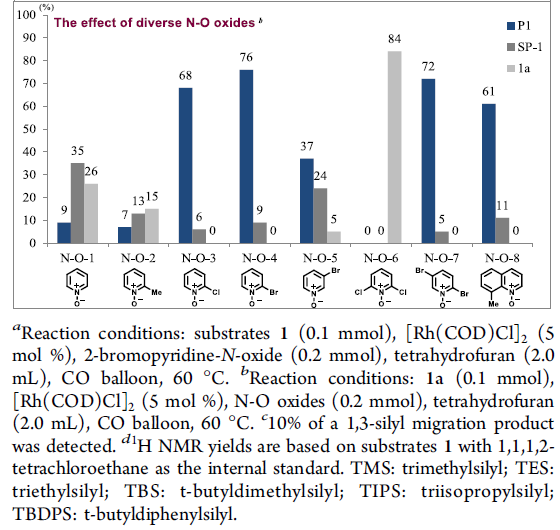
首先,作者以二炔1作为模型底物,对末端炔烃上的取代基和N-O氧化物进行了筛选(Table 1)。反应结果表明,反应受硅取代基的空间位阻以及吡啶-N-氧化物的2-位的空间和电子效应影响,当使用末端炔烃取代基为TBS的二炔底物,以Rh(COD)Cl2为催化剂,N-O-4为亲核试剂,可在60°C的THF溶剂中反应,获得82%收率的目标产物P1。
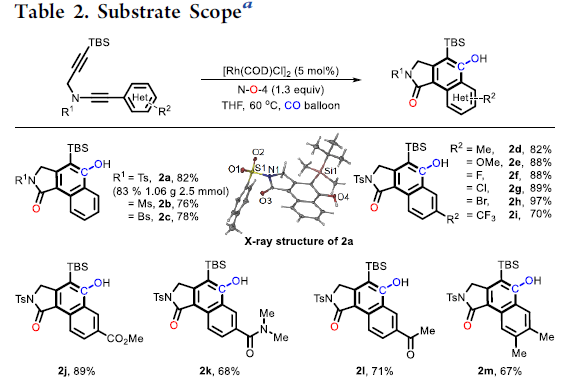
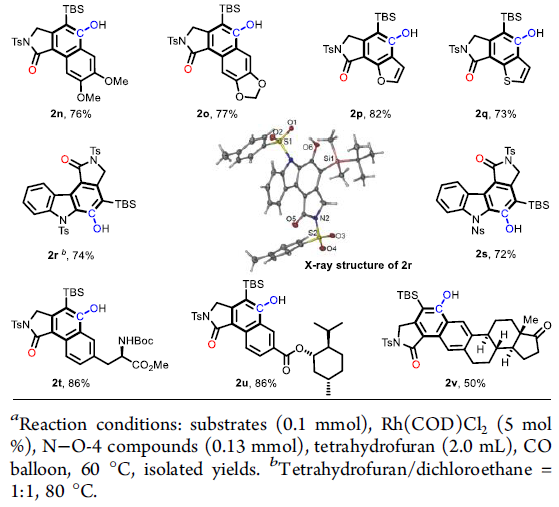
在获得上述最佳反应条件之后,作者对二炔的底物(可通过铜催化炔基溴化物的酰胺化反应制备[5])范围进行了扩展(Table 2)。首先,具有不同N-取代的磺酰基(如Ts、Ms、Bs),以76-83%的收率获得所需的酚类产物2a–2c。同时,克级实验,成功以83%的收率(1.06 g,2.5 mmol)得到2a。接下来,芳环上具有给电子和吸电子基时,均以高收率获得相应的产物2d–2i。含有各种官能团(如酯(2j),酰胺(2k)和乙酰基(2l))的底物,均具有良好的耐受性。此外,芳环上含有3,4-二取代和杂环取代的二炔底物,均能顺利进行反应,获得相应的产物2m–2q。值得注意的是,该方法可有效合成咔唑类生物碱骨架(2r和2s),并可对氨基酸、薄荷醇和雌酮进行相关的后期修饰(2t–2v)。
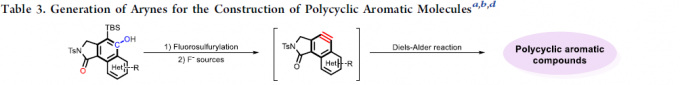
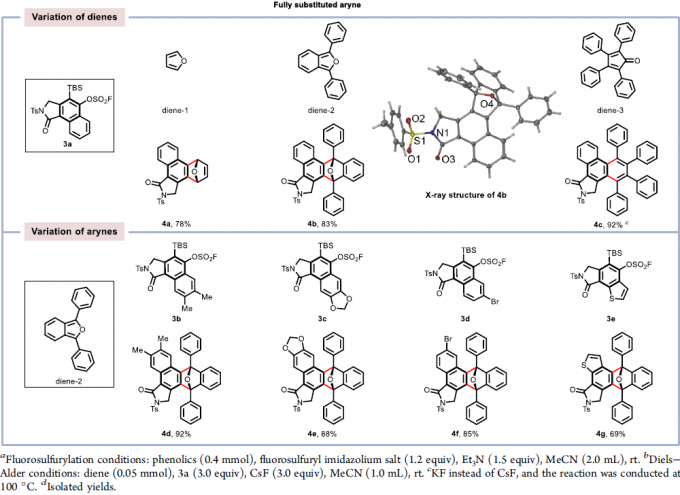
多环芳烃分子(PAMs)由于其在材料科学中的独特光电特性而备受关注。作者通过在乙腈溶剂中加入F–源,可使芳炔前体3a与各种二烯(如呋喃,1,3-二苯基异苯并呋喃和四环酮)的环加成反应顺利进行,得到相应的多环芳烃产物4a–4c,收率为78-92%(Table 3)。此外,各种全取代的芳烃前体与1,3-二苯基异苯并呋喃均能进行环加成反应。芳香环上的富电子和缺电子官能团均具有良好的耐受性,以85-92%的收率获得相应的产物4d–4f,其中溴取代的分子可进一步进行相关的偶联反应。同时,噻吩取代的底物,也以69%的收率获得环加成产物4g。令人兴奋的是,这些多环芳烃分子在溶液中表现出强烈的荧光,显示了在有机光电材料中的潜在应用。
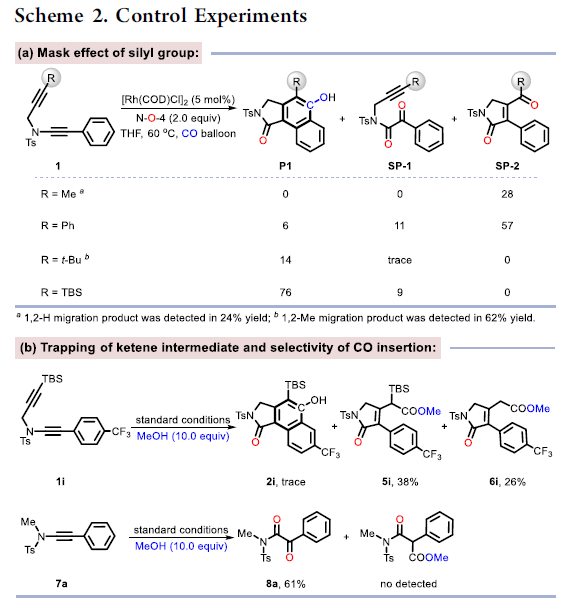
为了进一步了解羰基化环化过程,作者对机理进行了研究(Scheme 2)。首先,除TBS取代基外,其他取代基也可引入在炔烃的末端上,如带有甲基和苯基的底物,分别形成28%和57%收率的氧化副产物SP-2。空间位阻的增加(R = tBu)可以防止副产物SP-2的生成,但不利于CO的插入。这些实验表明,不仅空间位阻,并且炔烃末端的电子效应在串联过程中也起着至关重要的作用(Scheme 2a)。接下来,为了在转化过程中捕获可能的乙烯酮中间体,作者将1i于标准条件下反应,并加入10当量的甲醇,分别获得38%收率的甲酯5i,26%收率的去甲硅烷基化应物6i以及微量的目标产物2i。同时,7a在标准条件下反应,仅获得61%收率的二酮产物8a,这表明第一步中的Rh卡宾不适合插入CO(Scheme 2b)。
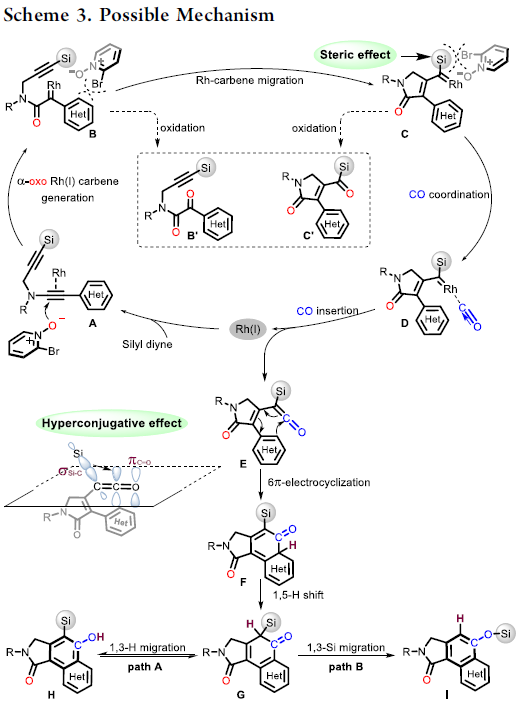
根据上述的实验,作者提出了一种可能的反应机理(Scheme 3)。首先,催化剂Rh(I) 优先与富电子三键配位,然后受到N-氧化物的亲核进攻,获得Rh(I)卡宾中间体B(底物与吡啶N-氧化物之间的空间和电子效应可完全抑制生成氧化副产物B’)。紧接着,卡宾中间体B从苄基位迁移至甲硅烷基的α-位,得到中间体C(甲硅烷基的空间位阻效应可防止C到二酮C’的二次氧化),经CO配位和插入,得到乙烯酮中间体E,同时解离和再生Rh(I)催化剂。随后,E的6π电环化得到中间体F,经1,5-H迁移,得到环己二烯酮G。最后,芳构化经历两种可能途径:通过1,3-H迁移得到动力学目标产物(path A),而在较高温度下发生1,3-Si迁移得到热力学稳定的副产物I(path B)。
总结
华东师范大学姜雪峰课题组报道了一种Rh(I)催化的卡宾迁移/羰基化/环化串联反应,可轻松构建全取代芳炔化合物,并在有机光电材料合成中具有巨大的潜力。此外,在该串联过程中,炔烃上的甲硅烷基的空间和超共轭效应对于通过防止卡宾中间体的氧化来控制选择性CO的插入至关重要。
参考文献
[1] (a) Roberts, J. D.; Simmons, H. E., Jr.; Carlsmith, L. A.; Vaughan, C. W. Rearrangement in the Reaction of Chlorobenzene-1-C14 with Potassium Amide. J. Am. Chem. Soc. 1953, 75, 3290−3291. (b) Tadross, P. M.; Stoltz, B. M. A. Comprehensive History of Arynes in Natural Product Total Synthesis. Chem. Rev. 2012, 112, 3550−3577. (c) Goetz, A. E.; Garg, N. K. Enabling the Use of Heterocyclic Arynes in Chemical Synthesis. J. Org. Chem. 2014, 79, 846−851. (d) Goetz, A. E.; Shah, T. K.; Garg, N. K. Pyridynes and Indolynes as Building Blocks for Functionalized Heterocycles and Natural Products. Chem. Commun. 2015, 51, 34−45. (e) Corsello, M. A.; Kim, J.; Garg, N. K. Total Synthesis of (−)-Tubingensin B Enabled by the Strategic use of An Aryne Cyclization. Nat. Chem. 2017, 9, 944−949. (f) Takikawa, H.; Nishii, A.; Sakai, T.; Suzuki, K. Aryne-based Strategy in the Total Synthesis of Naturally Occurring Polycyclic Compounds. Chem. Soc. Rev. 2018, 47, 8030−8056. [2] Himeshima, Y.; Sonoda, T.; Kobayashi, H. Fluoride-induced 1,2-Elimination of O-trimethylsilylphenyl Triflate to Benzyne Under Mild Conditions. Chem. Lett. 1983, 12, 1211−1214. [3] (a) Bradley, A. Z.; Johnson, R. P. Thermolysis of 1,3,8-Nonatriyne: Evidence for Intramolecular [2+4] Cycloaromatization to A Benzyne Intermediate. J. Am. Chem. Soc. 1997, 119, 9917−9918. (b) Miyawaki, K.; Suzuki, R.; Kawano, T.; Ueda, I. Cycloaromatization of a Non-conjugated Polyenyne System: Synthesis of 5H-Benzo[d]fluoreno[3,2-b]pyrans via Diradicals Generated from 1- [2-{4-(2-Alkoxymethylphenyl)butan-1,3-diynyl}]phenylpentan-2,4-diyn-1-ols and Trapping evidence for the 1,2-Didehydrobenzene Diradical. Tetrahedron Lett. 1997, 38, 3943−3946. (c) Hoye, T. R.; Baire, B.; Niu, D.; Willoughby, P. H.; Woods, B. P. The Hexadehydro-Diels-Alder Reaction. Nature 2012, 490, 208−212. (d) Yun, S. Y.; Wang, K.-P.; Lee, N.-K.; Mamidipalli, P.; Lee, D. Alkane C-H Insertion by Aryne Intermediates with a Silver Catalyst. J. Am. Chem. Soc. 2013, 135, 4668−4671. (e) Diamond, O. J.; Marder, T. B. Methodology and Applications of the Hexadehydro-Diels-Alder (HDDA) Reaction. Org. Chem. Front. 2017, 4, 891−910. [4] (a) Feng, M.; Tang, B.; Wang, N.; Xu, H. X.; Jiang, X. Ligand Controlled Regiodivergent C1 Insertion on Arynes for Construction of Phenanthridinone and Acridone Alkaloids. Angew. Chem. Int. Ed. 2015, 54, 14960−14964. (b) Ding, D.; Mou, T.; Feng, M.; Jiang, X. Utility of Ligand Effect in Homogenous Gold Catalysis: Enabling Regiodivergent π-Bond-Activated Cyclization. J. Am. Chem. Soc. 2016, 138, 5218−5221. (c) Ding, D.; Zhu, G.; Jiang, X. Ligand-Controlled Palladium(II)-Catalyzed Regiodivergent Carbonylation of Alkynes: Syntheses of Indolo[3,2-c]coumarins and Benzofuro[3,2-c]-quinolinones. Angew. Chem. Int. Ed. 2018, 57, 9028−9032. [5] Zhang, Y.; Hsung, R. P.; Tracey, M. R.; Kurtz, K. C. M.; Vera, E. L. Copper Sulfate-Pentahydrate-1,10-Phenanthroline Catalyzed Amidations of Alkynyl Bromides. Synthesis of Heteroaromatic Amine Substituted Ynamides. Org. Lett. 2004, 6, 1151−1154.
















No comments yet.