本文作者:芃洋雪
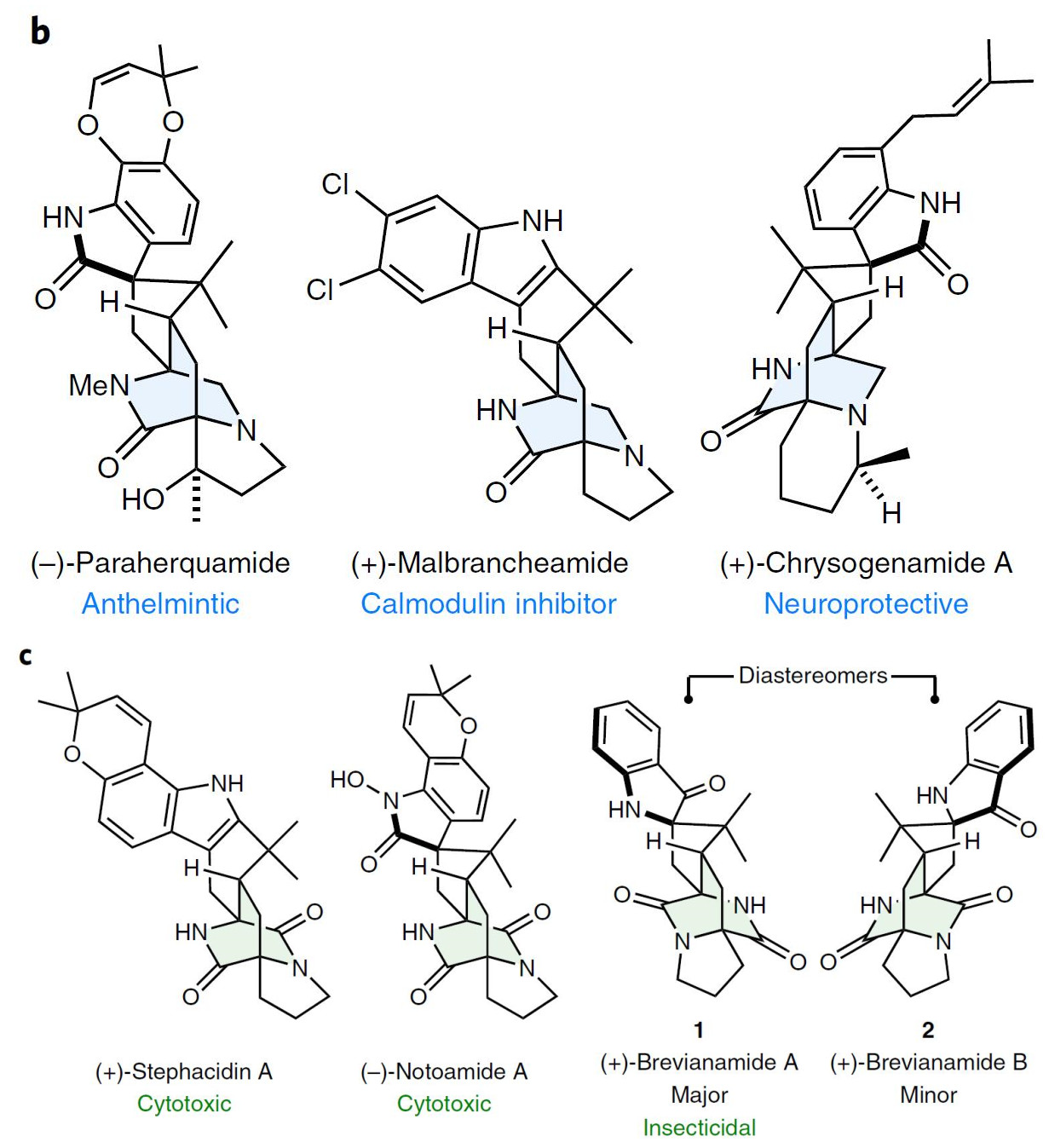
双环重氮辛烷类[2,2,2]diazaocatne生物碱广泛存在于海洋生物和真菌中,具有多种生物活性。根据环上的氧化程度,可分为单氧代哌嗪型,如图1b的(-)-Paraherquamide、(+)-Malbrancheamide、(+)-Chrysogenamide A;双氧代哌嗪型,如图1c中的(+)-Stephacidin A、(–)-Notoamide A和本文的主角(+)-Brevianamide A及(+)-Brevianamide B。
图1. [2,2,2]双环重氮辛烷类生物碱结构. 图片来源:Nature Chemistry
Brevianamide A和B最初由Birch和Wright于1969年从Penicillium brevicompactum真菌中分离出来,结构如图1c所示,它们也是第一种双环生物碱。Brevianamide A具有杀虫活性,如草地贪夜蛾Spodoptera frugiperda和烟草绿棉铃虫Heliothis virescens. Brevianamide A是主要的非对映异构体(d.r. ≳90:10)。
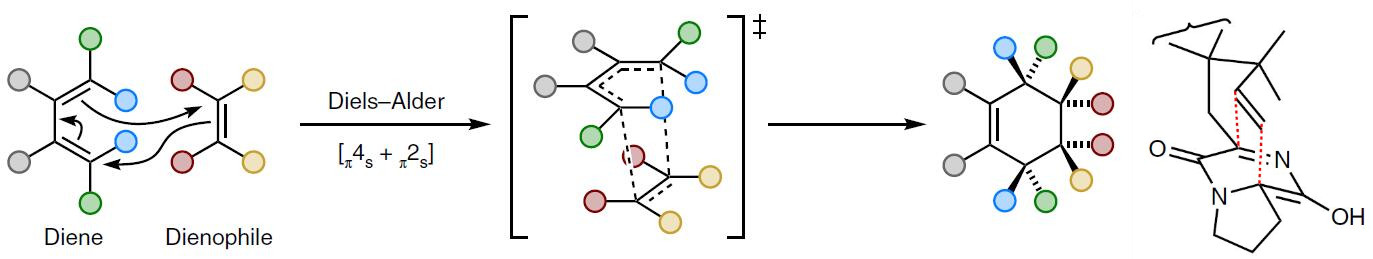
化学家早就注意到这种[2,2,2]双环结构,可以通过分子内异Dieles-Alder环加成反应构建骨架结构,如图2所示,这也是合成Brevianamide骨架的关键反应。
图2 Dieles-Alder环加成反应. 图片来源:Nature Chemistry
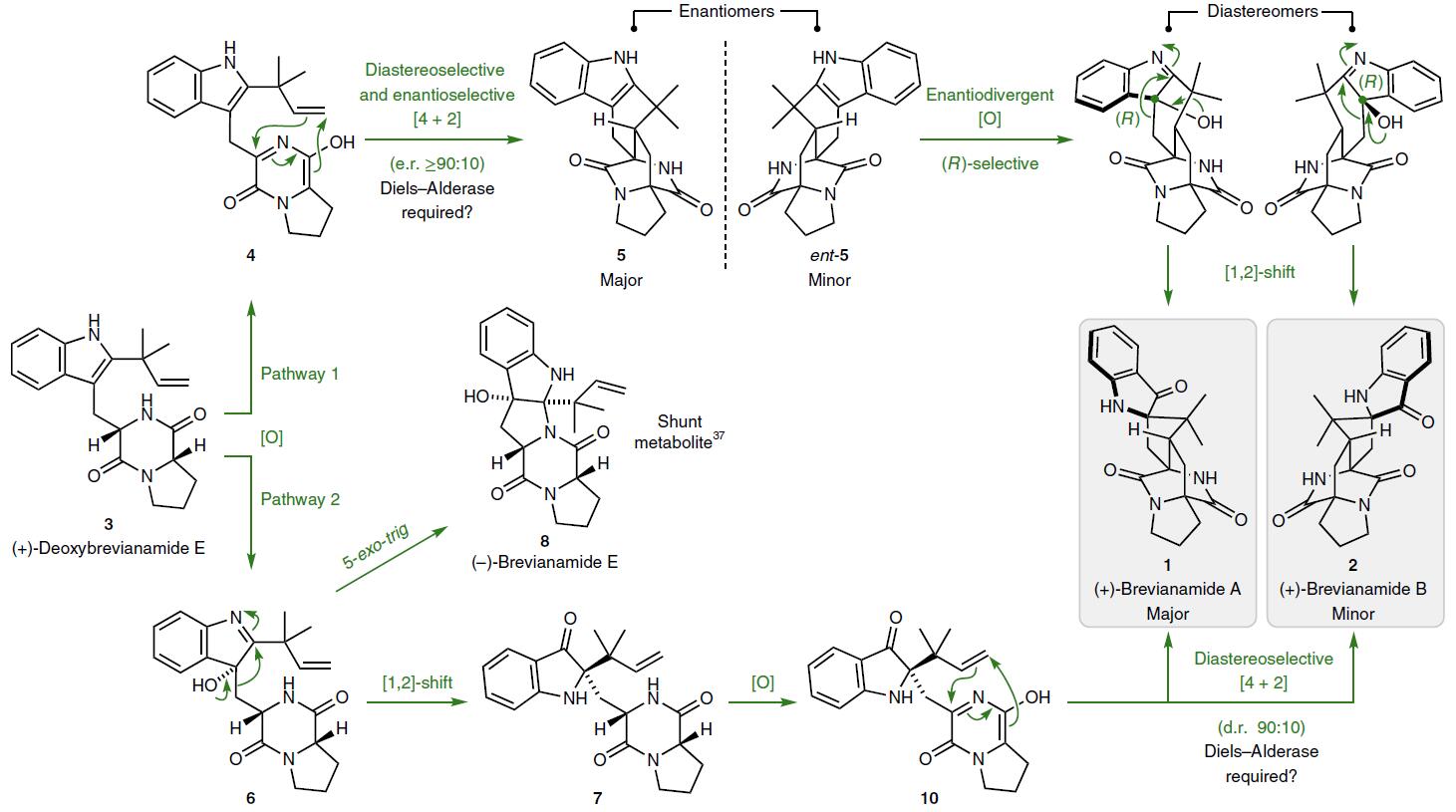
尽管距离发现Brevianamide A已有50余年,除异构体B被合成出来外,它的合成仍是个难以实现的目标,主要是由于难以逾越的反应性和选择性。1989年Williams等先驱奠定了Brevianamide A的合成策略。以化合物3(+)-deoxybrevianamide E氧化为非手性的氮杂二烯4,接着进行立体选择性Diels-Alder环加成反应得到双环重氮辛烷类消旋混合物5和ent–5,两个异构体经过(R)-选择性吲哚氧化和[1,2]-烷基迁移,主要的异构体5生成Brevianamide A,次要的异构体ent–5生成Brevianamide B。1993年又开发了路线2,仍然是以3(+)-deoxybrevianamide E开始,经非对映选择性吲哚氧化得到羟基伪吲哚6,再发生立体选择性[1,2]-烷基迁移反应得到吲哚酮7,通过氧化和Dieles-Alder环加成,得到Brevianamide。合成路线如图3所示。
图3. Brevianamide的已报道合成路线. 图片来源:Nature Chemistry
最近英国爱丁堡大学的Andrew L. Lawrence等另辟蹊径,论文《Total synthesis of brevianamide A》发表在Nature Chemistry上,https://doi.org/10.1038/s41557-020-0442-3。他们以天然产物(+)-dehydrodeoxybrevianamide E 9为关键物料进行了生物合成,其结构中的哌嗪二酮环已处于氧化位。以色氨酸甲酯13为起始物料,与邻苯二甲酸酐反应得到14,不经分离直接和B-异戊二烯基-9-硼双环[3.3.1]壬烷反应得到中间体15,两步收率为69%。在LiCl的DMF溶液中生成锂盐17,一锅法与脱氢脯氨酸酯反应得到19,再在氨气中反应不仅脱去了保护基还自发成环得到化合物9。经5步反应后,总收率高达34%。使用不同的氧化剂如过氧化酮、氧氮丙啶、单线态氧、过氧酸等将9的氧化为dehydrobrevianamide E 12和对映异构体20,间氯过氧苯甲酸的选择性最好(d.r. 64:36,)。在生物合成领域,选择性吲哚氧化是黄素依赖性单加氧酶控制的。这两种产物,正好可以用来合成Brevianamide A 1和B 2。化合物12在LiOH的水溶液中,环境温度下30分钟就可以转化为1和2,两个产物的收率和为63%。柱层析提纯后得到750mg1和60mg2,手性分析发现两者的对映体比例都为93:7,这和从短密青霉菌Penicillium brevicompactum提取的天然产物的数值吻合。重结晶后1的对映体比例提高至99:1。因此,作者推断这个Dieles-Alder反应并不需要酶的催化,而是自发进行的。整个合成路线如下图4所示:
图4. Brevianamide的合成路线. 图片来源:Nature Chemistry
总结:自50年前Birch发现Brevianamide A以来,它的合成也仅有几个报道,此次合成的关键是受生物合成启发的一步串联反应,从并五环化合物12经Diels-Alder环加成和[1,2]-迁移反应生成更复杂的六环化合物Brevianamide A。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.