本文作者:杉杉
导读
在烷基腈(alkylnitrile)的加成反应中,乙腈与醛的催化不对称加成(ee > 90%)一直具有挑战。近日,日本微生物化学研究所Masakatsu Shibasaki教授课题组在Angew. Chem. Int. Ed.上发表论文,通过使用Ni(II)-卡宾配合物成功实现乙腈与醛的催化不对称加成反应,从而获得对映体富集的β-羟基腈衍生物。其中,日本微生物化学研究所Masakatsu Shibasaki教授和Naoya Kumagai博士为共同通讯作者。
Direct Catalytic Asymmetric Addition of Aklylnitriles to Aldehydes with Designed Ni-Carbene Complexes
Akira Saito, Shinya Adachi, Naoya Kumagai, and Masakatsu Shibasaki
Angew. Chem. Int. Ed. ASAP DOI: 10.1002/anie.202016690
正文
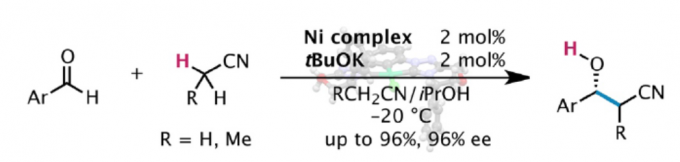
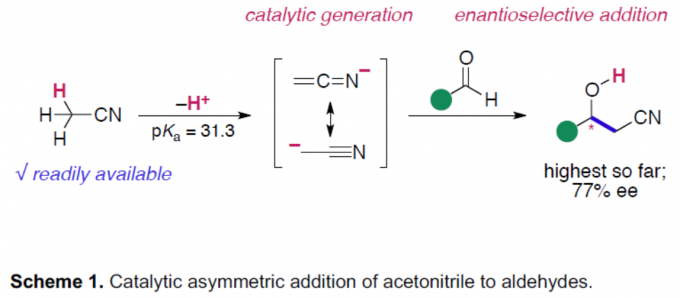
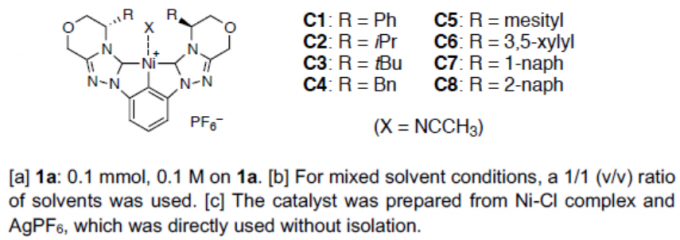
阴离子碳亲核试剂的催化不对称加成反应,作为构建复杂对映体富集分子的有效策略。其中,烯醇盐作为常见的活性亲核试剂,但其范围有限。对于腈类化合物(作为α-氰基碳阴离子的直接前体),由于其惰性和稳定性,已被用于各类色谱和反应的溶剂。其中,乙腈作为使用最广泛的溶剂。然而,由于乙腈具有高pKa显着影响了相应的α-氰基碳阴离子的生成,并且在某些亲电试剂形成碳-碳键的过程中,由于空间偏倚导致难以实现立体选择性的控制(Scheme 1)。目前为止,虽然已实现金属配合物催化乙腈与各种亲电试剂的加成反应,但立体选择性均难以控制。最近,本课题组[1] 报道了Ni(II)配合物催化乙腈和N-二苯基膦酰基(N-Dpp)亚胺的加成反应,从而实现高度对映选择性。然而,对于乙腈与醛的直接加成合成β-羟基腈衍生物,仍具有挑战。在本文中,作者成功实现醛和烷基腈的不对称加成,从而获得一系列对映体富集的β-羟基腈衍生物。
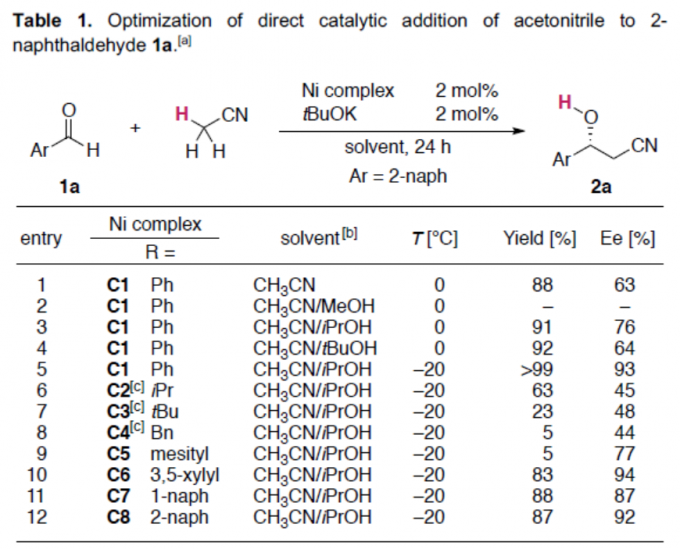
基于前期的研究成果[2,3],作者以乙腈与2-萘醛1a作为模型底物,进行了相关加成反应条件的筛选(Table 1)。筛选结果表明,以2 mol%的C1为催化剂,2 mol%的tBuOK为碱,可于CH3CN/iPrOH的混合溶剂中-20 ℃反应,获得99%收率和93% ee的目标产物2a。
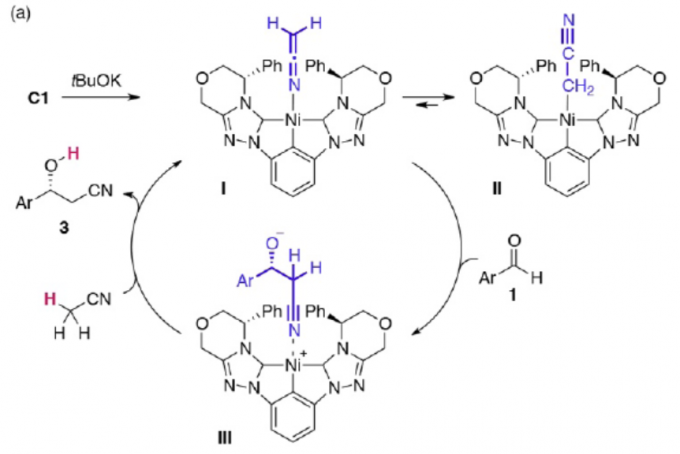
同时,根据Ariafard等对此类反应相关DFT的研究 [4],作者提出了一种可能的反应机理(Figure 2)。首先,C1和tBuOK反应形成C1配合物I,并与配合物II处于平衡状态。随后,配合物I与醛经加成反应,生成中间体III。最后,再与乙腈反应,即可生成目标产物3。
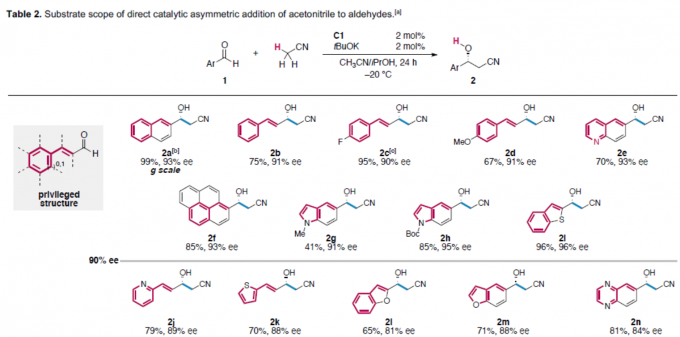
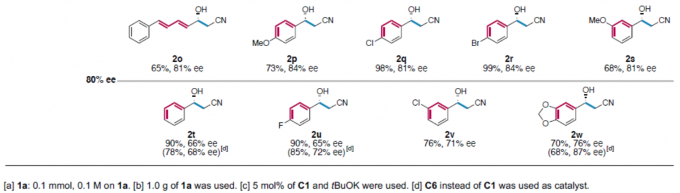
在获得上述最佳反应条件之后,作者对反应范围进行了扩展(Table 2)。首先,具有萘基、取代苯乙烯基、喹啉基、吲哚基、苯并噻吩基的醛,均可顺利反应,获得>90% ee的相应产物2a–2l。同时,对于吡啶基、噻吩基、呋喃基取代的醛以及p-MeO、-Cl、-Br或m-MeO取代苯甲醛,获得80-90%ee的相应产物2j–2s。此外,对于无取代、p-F、m-Cl、胡椒基取代的苯甲醛,均获得中等以上ee的目标产物2t–2w。
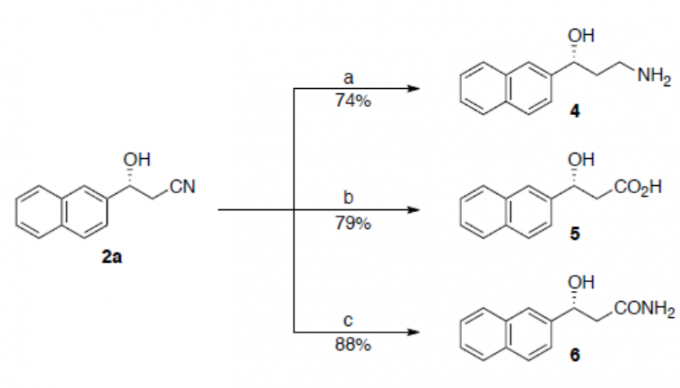
为了进一步证明反应的实用性,作者对产物进行了相关的后期衍生化(Scheme 3)。若使用BH3•SMe2在THF中回流反应则生成氨基醇4。若在强碱性条件下使用H2O2水溶液水解,则生成羧酸5。若在弱碱性条件下使用H2O2水溶液水解,则生成酰胺6。
总结
日本微生物化学研究所Masakatsu Shibasaki教授课题组报道了一种通过使用Ni(II)-卡宾配合物为催化剂,成功实现乙腈与醛的高度对映选择性加成反应,从而获得对映体富集的β-羟基腈衍生物。同时,该反应具有广泛的底物范围,惰性的乙腈以及各类醛(芳醛)均与体系兼容。此外,通过对产物的后期修饰,进一步证明了反应的实用性。





















No comments yet.