本文作者:杉杉
导读
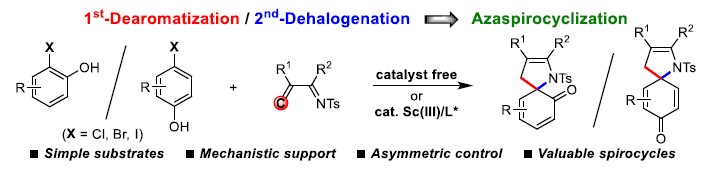
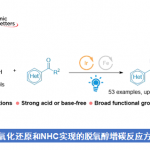
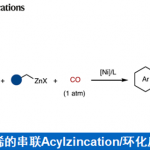
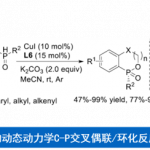
近日,西北大学栾新军教授课题组在德国应化杂志(Angewandte Chemie-International Edition)上发表论文,实现了邻(对)溴酚与α, β-不饱和亚胺的[4+1]螺环化反应,直接合成多种新型氮杂螺环分子。同时,其它几种卤代酚(X = Cl,I)也适用于该转化。此外,通过使用手性Sc(III)/ Py-Box催化剂,实现1-溴-2-萘酚的不对称催化反应。反应机理研究表明,该反应通过苯酚衍生物的去芳化作用后,再经自由基的SRN1过程实现偶联。
A Dearomatization/Debromination Strategy for the [4+1] Spiroannulation of Bromophenols with α, β-Unsaturated Imines
Yicong Ge, Cheng Qin, Lu Bai, Jiamao Hao, Jingjing Liu,* and Xinjun Luan*
Angew. Chem. Int. Ed. ASAP DOI:10.1002/anie.202008130
正文
卤代苯酚作为有机合成中通用且常见的结构单元之一。据文献查阅,卤代酚在大多数化学反应中主要脱卤、偶联反应等。相比之下,苯酚的去芳化已成为合成环己二酮的有效手段。迄今为止,含有卤素或硝基的酚羟基亲电体,几乎限制了卤代苯酚的去芳化过程(Scheme 1a)。同时,使用碳亲电试剂引发卤代酚的去芳化作用仍具挑战。据文献查阅,Wang课题组报道了一个成功的例子,该例子证明MgII可实现1-氟-2-萘酚与炔基C(sp)-亲电试剂的去芳化过程(Scheme 1b)。然而,对于使用C-亲电试剂,实现卤代苯酚去芳化过程尚未被实现,可能是由于竞争性的O-烷基化或不稳定的C(sp3)-X(X = Cl,Br,I)键。此外,曾有课题组提出将亚氨基-迈克尔-烷基化-烯胺-迈克尔级联反应直接用于溴酚的去芳化过程,该反应通过将富电子酚类的AlIII络合物与乙烯基环氧化合物进行去芳化作用(Scheme 1c)。基于上述的总结,作者提出了一种新型去芳化/脱卤化的策略,该反应是通过化学选择性的迈克尔加成,用缺电子的共轭烯烃对卤代苯酚进行去芳化,然后通过原位形成的亲核试剂促进分子内脱卤,从而实现[[4+1]螺环化反应(Scheme 1d)。据推测,除了引发去芳化第一步的独特问题外,同时也需确定合适的亲核试剂(Y),以从高能去芳化中间体A取代卤化物。根据文献的先例,A中的叔烷基卤化物有两种反应方式:(i)相当小的亲核试剂(如醇和叠氮化物)取代SN2型(path a)。(ii)通过亲核性SN2X或基于自由基的SRN1型,较大的亲核试剂对卤化物的反向攻击(path b)。
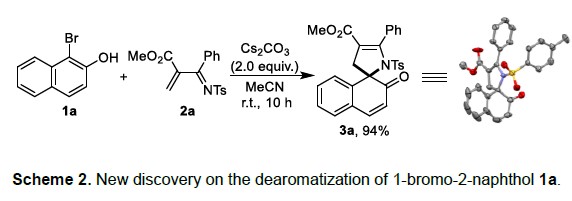
首先,作者以1-溴-2-萘酚(1a)与各种α,β-不饱和羰基衍生物(2)作为底物,开始对反应进行了研究。当使用α,β-不饱和亚胺2a时,可在非常简单的无催化条件下,实现预期的[4+1]螺环化反应,获得94%收率的产物3a(Scheme 2)。
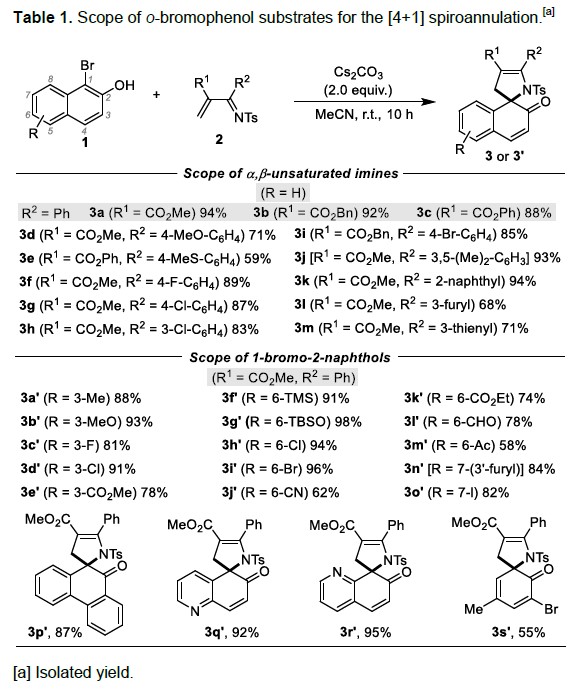
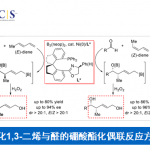
随后,作者对该反应的底物范围进行了研究(Table 1)。反应结果表明,当固定1-溴-2-萘酚作为底物时,可与各种α, β-不饱和亚胺(2a–2m)反应,获得58-94%收率的产物3a–3m。同样,当固定α, β-不饱和亚胺时,也可与各种不同取代的1-溴-2-萘酚反应,获得相应的产物3a’–3o’。此外,菲酚、喹啉衍生物也同样适用于该体系,获得产物3p’–3r’。对于邻溴苯酚,同样获得预期的产物3s’。
值得注意的是,当以2,4-二溴苯酚4a作为底物时,反应的去芳化和脱溴的过程仅发生在4a的对位,并以90%的收率获得产物5a,同时,并未观察到邻位去芳化的过程(Scheme 3)。
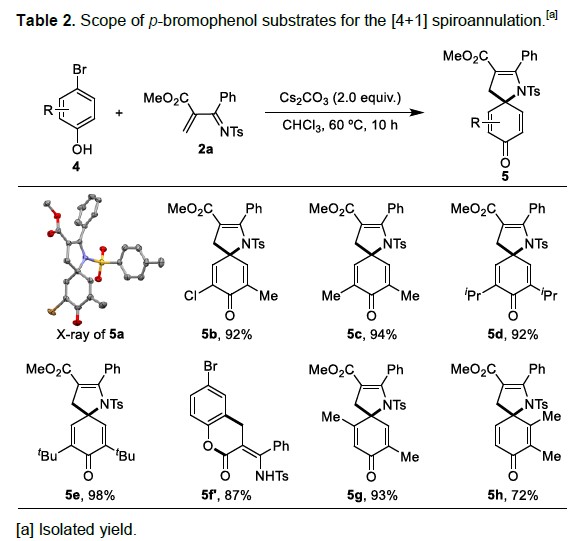
紧接着,作者以对溴苯酚作为底物,对反应进行了研究(Table 2)。反应结果表明,含有氯(4b)、甲基(4c)、正丙基(4d)、叔丁基(4e),均可顺利反应,获得相应的产物5a–5e。然而,使用缺少邻位取代基的4-溴苯酚4f时,反应通过完全不同的烷基化/酯化途径进行,从而获得产物5f’。此外,作者也发现酚环(4g–4h)的另外两个取代模式(通过4c中的甲基转位来说明)。通过将一个甲基转移到相邻的间位,与4g反应可有效进行,获得93%的收率的5g。通过将一个甲基转移到相反的间位(4h),可以发生[4+1]螺环化反应,以72%的收率获得5h。但该反应对于较少亲核性的4-溴萘-1-醇并不适用。
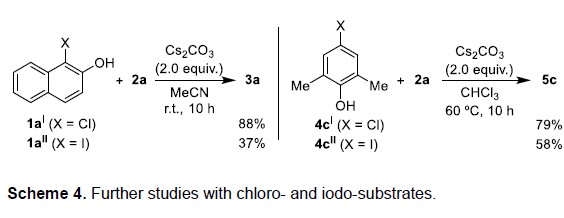
接下来,作者开始对其他卤代酚(X = Cl,I)进行了研究(Scheme 4)。反应结果表明,氯和碘代底物(1aI,1aII,4cI,4cII)均可顺利反应,通常,氯代底物收率高,而碘代底物收率偏低。
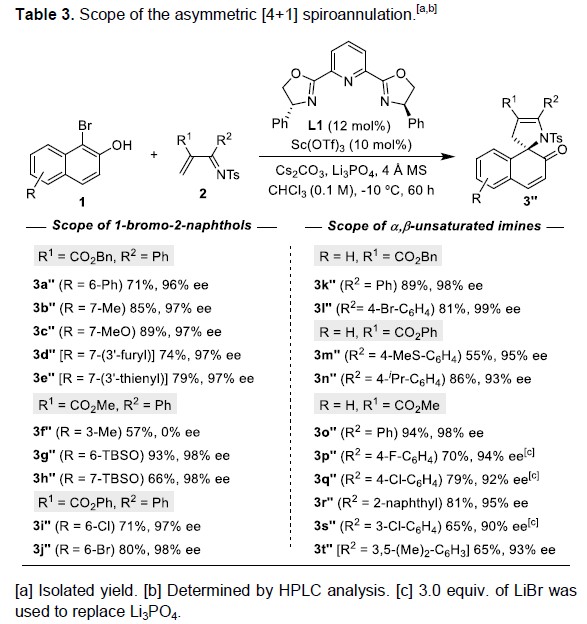
为了进一步证明用反应的实用性,作者开发了一种不对称反应(Table 3)。通过大量条件的筛选,作者发当以手性Sc(III)/Py-Box催化剂时,能够促进1-溴-2-萘酚(1)与α, β-不饱和亚胺(2)的不对称[4+1]螺环化反应,并以高产率(55-94%)和优异的对映选择性(90-99%ee)获得多种手性螺环产物3a”–3t”。值得注意的是,萘环的6、7位上的变化保持了高水平的对映选择性(在所有情况下,ee均> 96%),但在3位取代导致结果相当差(3f”),可能由于增加的空间位阻直接中断了羟基与Sc(III)-中心之间的必要结合。
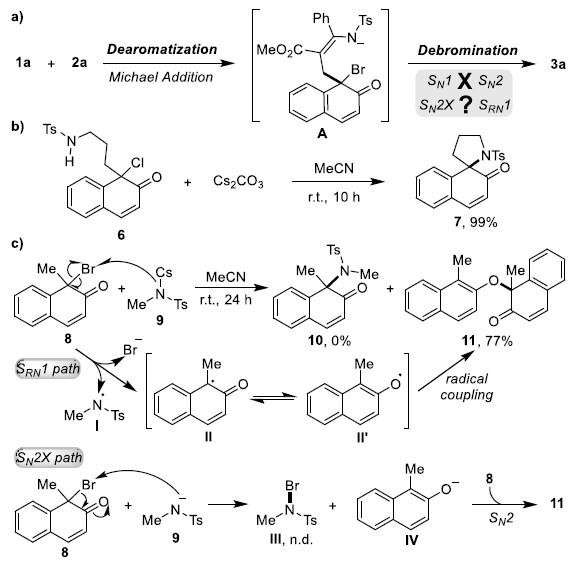
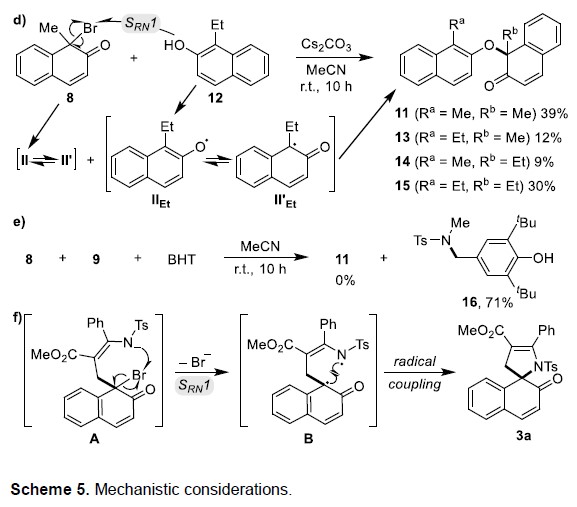
基于上述的讨论,作者提出了合理反应机理(Scheme 5)。首先,作者提出了经迈克尔加成反应形成去芳化的中间体A。当以去芳化6作为底物时,也可实现螺环化反应(Scheme 5b)。而对于脱溴步骤,可能涉及SN2X或SRN1机理(Scheme 5c)。通过8和9反应的结果表明,去芳化的8充当9中磺酰胺阴离子的单电子氧化剂,产生氮自由基I和碳自由基II(SRN1 path)。值得注意的是,II自由基转移形成体积较小的氧自由基II”,可与自由基II发生偶联,形成11。此外,8与1-乙基-2-萘酚(12)的反应结果排除了有争议的SN2X途径,因为通过单电子转移SRN1途径原位生成四个可能的自由基II,II’,IIEt和II’Et,可发生交叉偶联形成四种产物11和13–15的混合物(Scheme 5d)。此外,氮自由基I可以被BHT捕获(Scheme 5e)。因此,作者认为该[4+1]螺环反应的脱溴步骤遵循基于自由基的SRN1机制(Scheme 5f)。
总结
西北大学栾新军教授课题组通过去芳化/脱卤策略,实现了邻(对)溴酚与α, β-不饱和亚胺的[4+1]螺环化反应,直接合成多种新型氮杂螺环分子。同时,其它几种卤代酚(X = Cl,I)也适用于该转化。此外,通过使用手性Sc(III)/ Py-Box催化剂,实现1-溴-2-萘酚的不对称催化反应。反应机理研究表明,该反应通过苯酚衍生物的去芳化作用后,再经自由基的SRN1过程实现偶联。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.