本文作者:杉杉
导读
近日,东京大学Yasuhiro Yamashita和Shu̅ Kobayashi合作在JACS上发表论文,通过使用手性双(三甲基硅烷基)氨基钾(KHMDS)-双(恶唑啉)钾盐(K-Box)催化体系,成功实现亚胺和弱酸性酰胺的催化不对称Mannich反应。反应具有高收率、高非对映和对映选择性的特点。此外,K烯醇酮与K-Box相互作用形成手性烯醇酮,可与亚胺有效地反应。并且,K-Box充当活化钾物种的手性配体。
Chiral Metal Salts as Ligands for Catalytic Asymmetric MannichReactions with Simple Amides
Yasuhiro Yamashita,* Aika Noguchi, Seiya Fushimi, Miho Hatanaka, and Shu̅ Kobayashi*
J.Am. Chem. Soc.ASAP DOI:10.1021/jacs.0c13317
正文
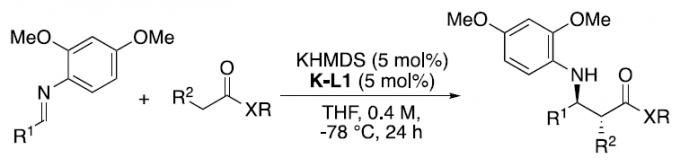
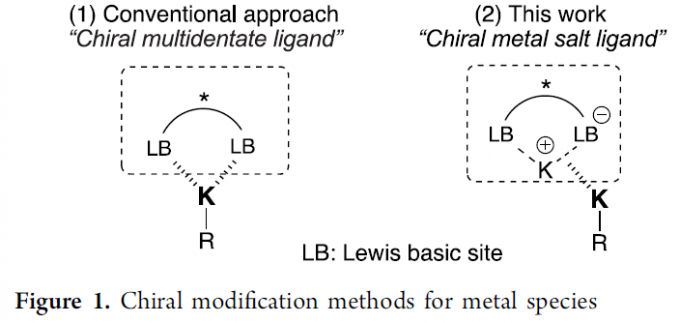
不对称催化是一种高效合成光学活性分子的有效方法。迄今为止,已开发出多种手性金属和有机催化不对称转化的策略。碱金属化合物,通常作为有机合成中化学计量Brønsted碱或强亲核试剂。其中,手性配体修饰的锂化合物已广泛应用于不对称反应,但其它手性配体修饰的碱性金属化合物(如钠和钾化合物),却很少被研究。据推测,可能是由于其Lewis酸度较低,并且其离子半径大于锂离子的离子半径。但是,它们的反应性很高,特别是在Brønsted碱催化中。传统上使用手性多齿Lewis碱配体用于手性修饰,如手性冠醚;然而,其他有效的方法尚待开发。在此,本文将报道手性钾盐-钾碱混合体系,可作为不对称反应中有效的手性钾Brønsted碱催化剂(Figure 1)。此外,亚胺与酰胺和酯的催化不对称Mannich反应,作为合成β-氨基酸衍生物的最有效且经济的方法之一,无需任何氧化还原过程。迄今为止,尽管已开发出多种易烯醇化的羰基化合物(如醛和酮)的催化不对称Mannich反应,但对于酰胺和酯(α位上没有任何吸电子基团)的反应均失败。在此,本文将报道一种新型的手性强Brønsted碱催化体系,可实现弱酸性简单酰胺(如丙酰胺)与亚胺的催化不对称Mannich反应。
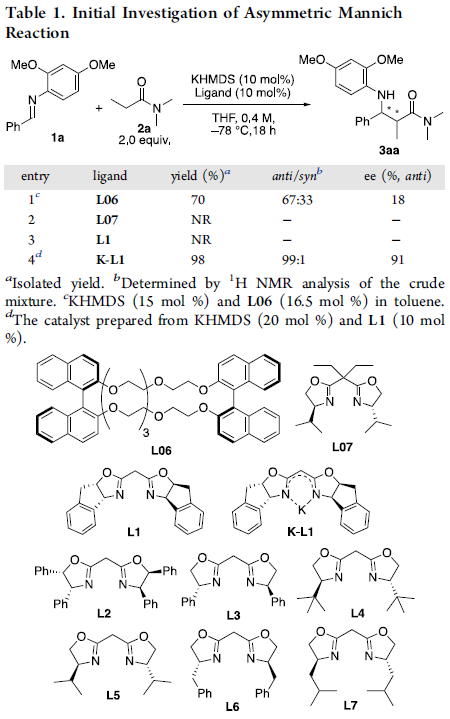
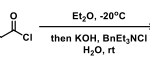
首先,作者以亚胺1a和N,N-二甲基丙酰胺2a作为模型底物,进行了相关Mannich反应条件的筛选(Table 1)。反应结果表明,当在双(三甲基硅烷基)氨基钾(KHMDS)-双(恶唑啉)钾盐(K-Box)催化体系中,可于-78℃的THF溶液中顺利反应,从而获得高收率、高非对映体和对映体选择性的产物3aa。
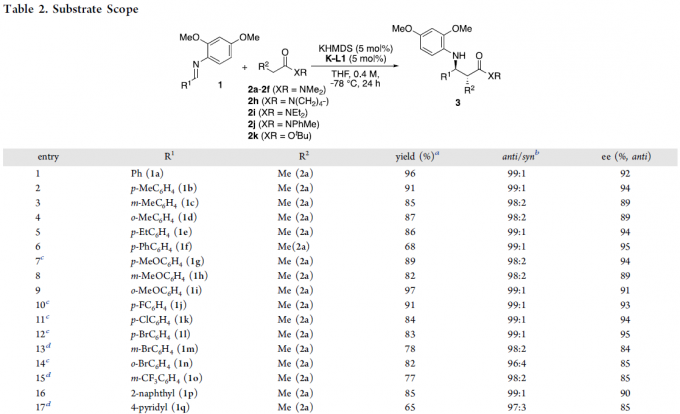
在获得上述最佳反应条件后,作者开始对底物进行了扩展(Table 2)。当亚胺的R1取代基为芳基时,反应不受电子效应和定位效应的影响,均可顺利反应(entries 1-15)。同时,对于亚胺的R1取代基为萘基、杂芳基、环丙基、叔丁基等,也与体系兼容(entries 16-22)。其次,当酰胺的R2取代基为其它长链时,也可顺利反应(entries 23-26)。同时,N,N-二甲基乙酰胺(2f)也显示出良好的对映选择性(entry 27)。此外,对于其它取代的丙酰胺2h–2j,均具有良好的对映选择性(entries 28-30)。并且,丙酸叔丁酯(2k)也以高收率和高对映选择性得到目标产物,但非对映选择性中等(entry 31)。
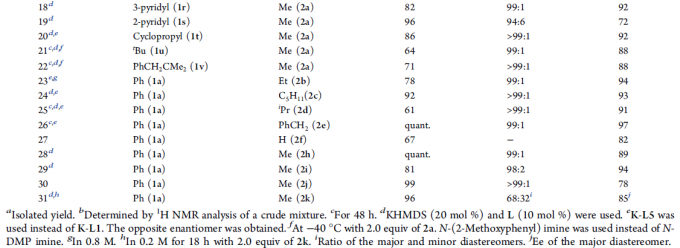
紧接着,作者对反应的实用性进行了研究(Scheme 1)。首先,3aa中氮原子上的DMP基团可使用硝酸铈铵(CAN)轻松除去,再经苯甲酰化,可获得高收率的5aa,且对映选择性没有任何损失(eq 1)。其次,3aa在酸性条件下,可酰胺部分转化为酯,以高收率获得β-氨基酯6aa(eq 2)。此外,3aa的克级实验,同样取得了预期的结果(eq 3)。
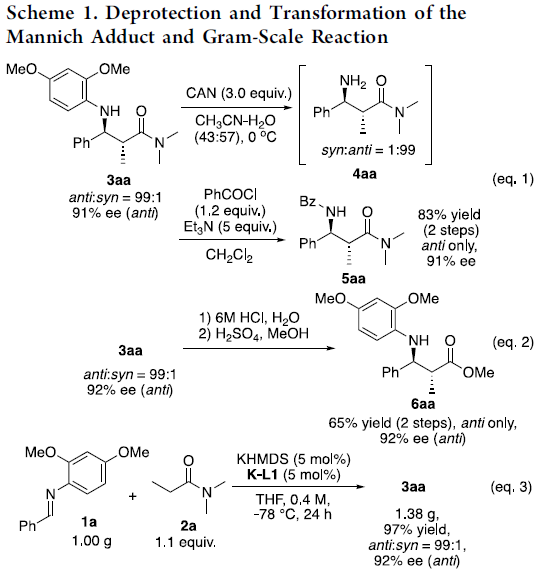
随后,作者对胆固醇吸收抑制剂SCH-48462进行了合成(Scheme 2)。首先,使用KHMDS和K-L5催化体系,可实现亚胺1g与酰胺2g的反应,以高收率、高非对映选择性和对映选择性获得所需产物3gg。随后,3gg经Tf2O和NaOH处理后,以良好的产率获得β-内酰胺7gg。除去DMP基团后,获得含N-H键的β-内酰胺8gg,其光学纯度通过重结晶而提高。最后,引入对甲氧基苯基后,即可获得SCH-48462。
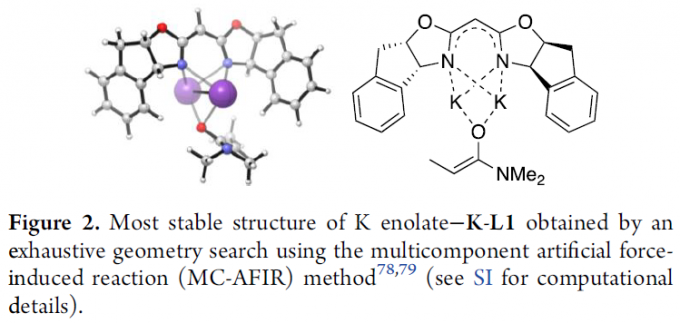
此外,作者也进行了相关的DFT计算研(Figure 2)。计算结果表明,两个钾离子对称地位于L1两个氮原子之间,并且烯醇盐位于两个钾离子之间。配合物的稳定性归因于烯醇酸钾和K-L1之间明显的静电相互作用,从而表明烯醇酸酯中的K和O原子在不对称环境中紧密固定。
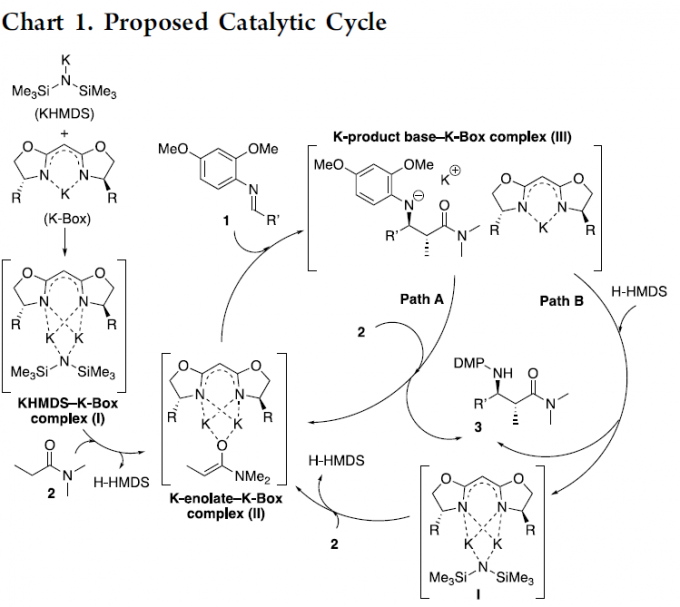
最后,作者提出了一种可能的反应机理(Chart 1)。首先,KHMDS与K-Box相互作用生成KHMDS-K-Box配合物I,再与去质子化的化合物2反应,形成配合物II。随后,配合物II与亚胺1反应形成配合物III。最后,可能经历两种形成目标产物3。
总结
东京大学Yasuhiro Yamashita和Shu̅ Kobayashi合作报道了通过使用手性双(三甲基硅烷基)氨基钾(KHMDS)-双(恶唑啉)钾盐(K-Box)催化体系,成功实现亚胺和弱酸性酰胺的催化不对称Mannich反应。同时,反应具有高收率、高非对映体和对映体选择性。此外,K烯醇酮与K-Box相互作用形成手性烯醇酮,可与亚胺有效地反应。并且,K-Box充当活化钾物种的手性配体。




















No comments yet.