本文作者:杉杉
导读
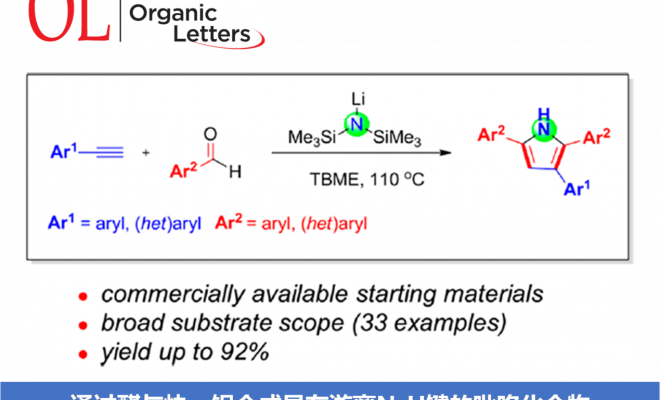
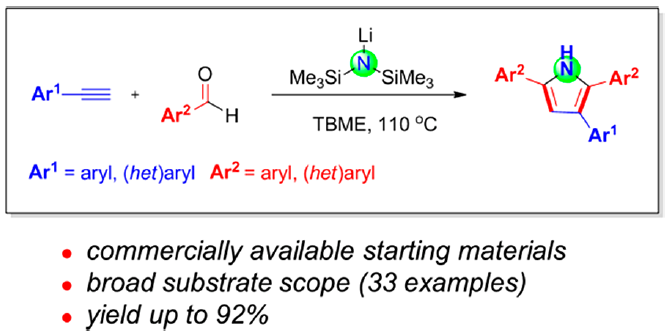
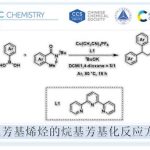
本文首次报道通过碱媒介 (LHMDS, LiN(SiMe3)2)促进的芳香醛与苯乙炔之间的分子间环化反应方法学,从而合成出一系列吡咯衍生物。该方法学具有原料易得、反应条件温和、底物适用范围广泛、收率高(高达92%)等优势。本文中南京工业大学的毛建友教授与河北农业大学的张金林教授为共同通讯作者。
One-Pot Synthesis of N-H-Free Pyrroles from Aldehydes and Alkynes
L. Chen, J. Huo, He. Si, X. Xu, S. Kou, J. Mao, J. Zhang, Org. Lett. ASAP. doi: 10.1021/acs.orglett.1c01287.
正文
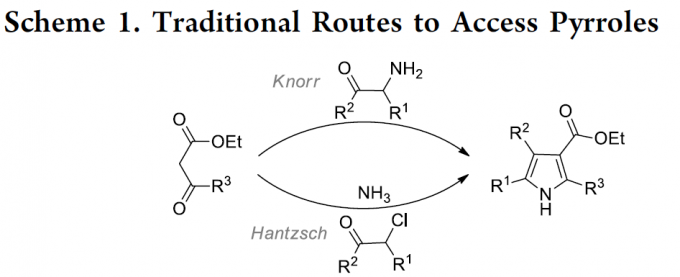
吡咯作为最为常见的五元杂环骨架之一,广泛存在于各类天然产物、药物分子、农用化学品以及功能材料分子中。而构建吡咯骨架的常规路线主要涉及Knorr反应与Hantzsch反应 (Scheme 1)。而在当代有机合成化学中,吡咯骨架的构建主要采用过渡金属催化的吡咯官能团化反应[1]-[3]与多组分反应等[4]-[10],然而,上述反应中,通常需要采用高度官能团化的底物或相应中间体的预先制备,并且,将上述方法学应用于构建生物活性分子时,容易出现因痕量金属残留产生的污染问题。因此,迫切需要开发出一种无需过渡金属催化,并通过廉价易得的起始原料,直接构建吡咯类化合物的高效合成策略。
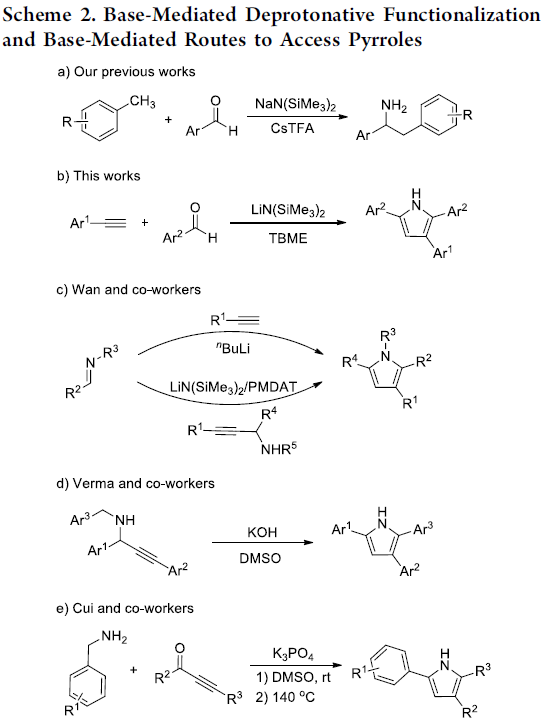
前期,本课题组[11]已经报道采用NaN(SiMe3)2促进的醛与甲苯之间的一锅氨基苄基化 (aminobenzylation)反应, 该反应涉及形成C-N与C-C键的串联过程 (Scheme 2a)。近期,同样有文献报道[12]采用催化计量的碱参与的上述转化过程。同时,研究发现,上述策略同样能够进一步应用于一系列官能团化的杂环分子的构建,例如,2-芳基吲哚以及2-氮杂芳基四氢喹啉等。而在上述的合成转化过程中,下列因素可能起到关键作用:(1) 由第一主族元素阳离子产生的阳离子-π相互作用 (cation-π interaction),促进甲苯的去质子化。(2) 反应过程中,MN(SiMe3)2 (M = Li,Na,K,Cs)的作用主要涉及如下两方面:首先,能够促进弱酸性C(sp3)-H键的直接去质子化,其次,能够与苯甲醛缩合,原位形成N-(三甲基甲硅烷基)亚胺中间体。受上述研究报道的启发,作者开发出首例由简单起始原料 (醛与端炔)通过一锅法,直接完成2,3,5-三取代吡咯骨架的构建 (Scheme 2b)。与Wan、Verma与Cui小组的合成策略[13]相比,该方法学为具有游离N-H键的吡咯 (N−H-free pyrrole)分子的合成开辟出全新的替代路线,并能够有效避免亚胺、炔丙基胺以及官能团化炔酮等原料的预先制备 (Scheme 2c-e)。
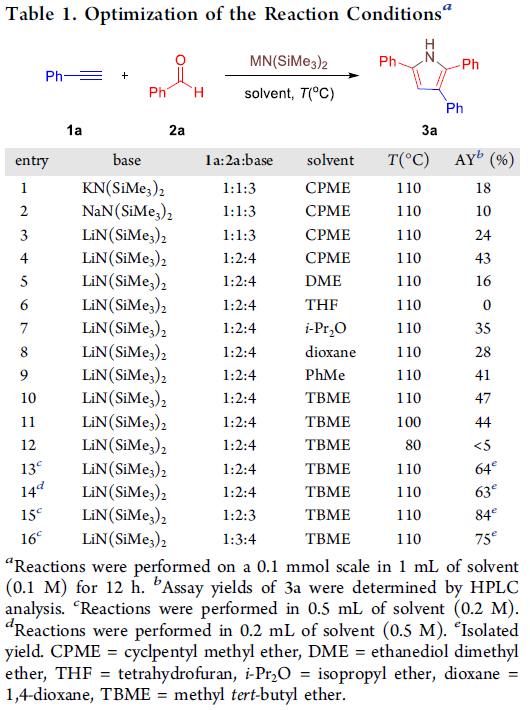
首先,作者采用苯乙炔1a与苯甲醛2a作为模型底物,进行了相关反应条件的筛选(Table 1)。进而确定最佳的反应条件为:采用LiN(SiMe3)2作为碱,TBME (methyl tert-butyl ether)作为反应溶剂,反应温度为120℃,最终获得84%收率的环化产物3a。
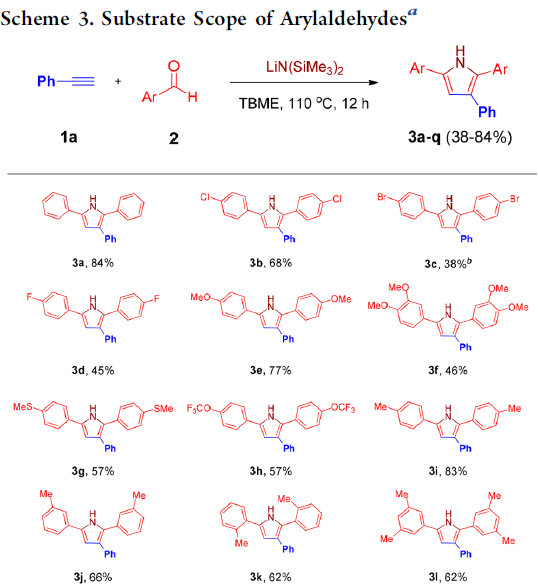
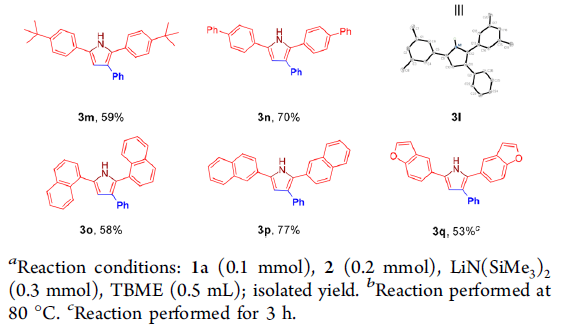
在获得上述最佳反应条件之后,作者开始对芳香醛底物2的应用范围进行考察 (Scheme 3)。研究发现,各类具有吸电子基与供电子基取代的芳香醛底物,均能够顺利完成上述转化过程,并获得相应吡咯产物3a–3k。并且,上述反应条件对于3,5-二甲基、叔丁基以及4-苯基取代的芳香醛底物,同样能够较好地兼容,并获得吡咯产物3l–3n。此外,π-扩张的 (π-extended) 芳香醛底物,例如1-萘甲醛与2-萘甲醛,则分别能够以58%与77%的收率获得相应目标产物3o与3p。同时,作者观察到,带有苯并呋喃杂环取代的芳香醛底物,同样能够顺利参与上述转化过程,并以53%的收率获得相应的吡咯3q。然而,作者进一步研究发现,肉桂醛,N-甲基吡咯-2-甲醛以及噻吩-2-甲醛底物,在上述反应条件下则均发生分解。
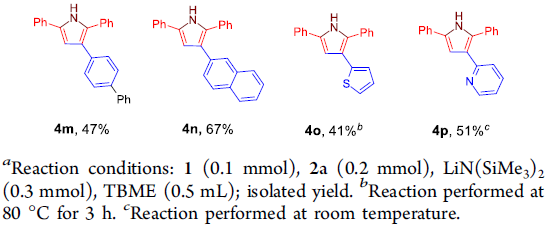
随后,作者对芳基乙炔底物1的应用范围进行深入研究 (Scheme 4)。实验结果表明,各类供电子基与吸电子基取代的芳基乙炔底物均能够与上述最佳反应条件良好地兼容,并获得相应的目标产物4a–4l。其次,作者发现,具有扩张π-体系的 (extended π-system) 芳基乙炔底物, 例如4-联苯乙炔 1m与2-乙炔基萘 1n,同样能够顺利参与上述反应,并获得产物4m与4n。此外,带有芳香杂环取代基的端炔底物,例如2-噻吩乙炔1o与2-吡啶乙炔1p,同样能够顺利完成上述反应。并获得最终目标产物4o与4p。然而,研究表明,带有脂肪族取代基 (例如1-环己基、环丙基、n-Bu等)的端炔底物,则无法有效地参与上述合成转化过程。
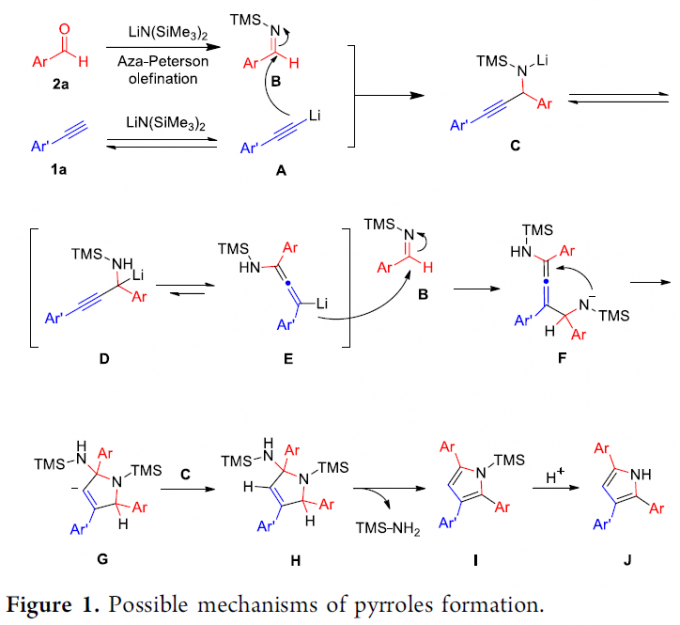
最后,作者提出一种合理的反应机理 (Figure 1)。首先,醛2a与LiN(SiMe3)2经历aza-Peterson烯基化反应,形成亚胺中间体B。 同时,苯乙炔1a与LiN(SiMe3)2通过去质子化过程,形成炔基锂中间体A。接下来,中间体A与亚胺B经历亲核加成步骤,形成炔丙基胺负离子C,C进一步通过1,2-负离子迁移 (1,2-anion shift)途径,获得相应炔丙基锂试剂D (D通常与联烯基锂 (allenyllithium)E处于平衡状态,并且,在平衡过程中联烯基锂占优势)。随后,联烯基锂E与亚胺中间体B通过亲核加成过程,形成中间体F,F通过分子内环化过程,形成中间体G。最终,G经历质子化、TMS-NH2消除与水解过程,获得相应的吡咯产物J。
总结
本文首次报道通过芳香醛与端炔作为起始原料,直接合成三芳基取代吡咯的全新策略。该策略具有原料廉价易得、底物应用范围广泛以及良好的官能团兼容性等优势。同时,该策略中,能够通过一步的反应操作,实现C-N与C-C键的构建,从而表明这一策略在杂环骨架的构建中具有良好的应用前景。
参考文献
[1] M. Yamaguchi, S. Fujiwara, K. Manabe, Org. Lett. 2019, 21, 6972. doi: 10.1021/acs.orglett.9b02559. [2] J. Roger, A. L. Gottumukkala, H. Doucet, Chem. Cat. Chem. 2010, 2,20 doi: 10.1002/cctc.200900074. [3] K. Kawakita, E. P. Beaumier, Y. Kakiuchi, H. Tsurugi, I. A. Tonks, K. Mashima, J. Am. Chem. Soc. 2019, 141, 4194. doi: 10.1021/jacs.8b13390. [4] H. Xu, H. Liu, K. Chen, G. Wang, J. Org. Chem. 2018, 83, 6035. doi: 10.1021/acs.joc.8b00665. [5] V. Estévez, M. Villacampa, J. C. Menéndez, Chem. Soc. Rev. 2014, 43, 4633. doi: 10.1039/C3CS60015G. [6] H. Chai, L. Wang, T. Liu, Z. Yu, Organometallics 2017, 36, 4936. doi: 10.1021/acs.organomet.7b00774. [7] M. Li, Y. Sun, Y. Xie, Y. Yu, F. Huang, H. Huang, Chem. Commun. 2020, 56, 11050. doi: 10.1039/D0CC04157B. [8] B. S. Karki, L. Devi, A. Pokhriyal, R. Kant, N. Rastogi, Chem. – Asian J. 2019, 14, 4793. doi: 10.1002/asia.201901068. [9] M. Zhao, Z. Ren, D. Yang, Z. Guan, Org. Lett. 2018, 20, 1287.doi: 10.1021/acs.orglett.7b04007. [10] L. Zhu, Y. Yu, Z. Mao, X. Huang, Org. Lett. 2015, 17, 30. doi: 10.1021/ol503172h. [11] Z. Wang, Z. Zheng, X. Xu, J. Mao, P. J. Walsh, Nat. Commun. 2018, 9, 3365. doi: 10.1038/s41467-018-05638-y. [12] G. Liu, P. J. Walsh, J. Mao, Org. Lett. 2019, 21, 8514. doi: 10.1021/acs.orglett.9b02737. [13] (a) Y. Hu, C. Wang, D. Wang, F. Wu, B. Wan, Org. Lett. 2013, 15, 3146. doi: 10.1021/ol401369d.(b) P. K. Mishra, S. Verma, M. Kumar, A. K. Verma, Org. Lett. 2018, 20, 7182. doi: 10.1021/acs.orglett.8b03112.(c) J. Shen, G. Cheng, X. Cui, Chem. Commun. 2013, 49, 10641. doi: 10.1039/C3CC43844A.

















No comments yet.