本文作者:海猫
导读
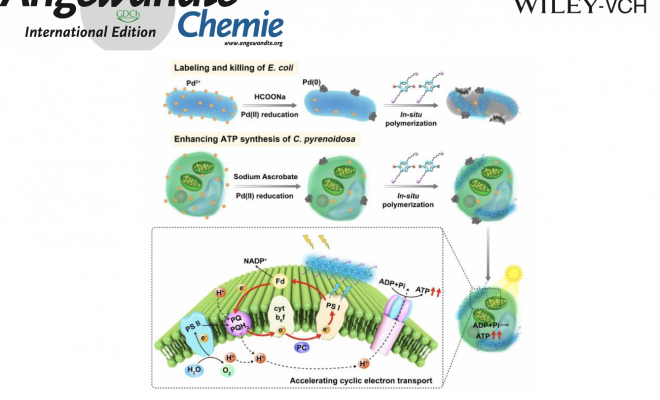
在本文中,中科院的王树课题组报道了一种生物钯催化的聚合策略,用于在活细胞表面原位合成共轭聚合物。作者在细胞表面进行Sonagashira偶联反应,通过附着在细胞表面的Pd催化剂合成了光敏性聚对苯撑乙炔(polyphenyleneethynylene, PPE)。原位合成的PPE具有比较好的光吸收能力,并在E.coli和C.pyrenoidosa表面发射出蓝色荧光。除了可以对微生物成像以追踪聚合过程,PPE还表现出对E.coli的抗菌活性,并可以通过增加光的吸收和加速光合作用系统的电子传递来增强C.pyrenoidosa的ATP合成。这种聚合方法为细胞表面原位合成功能性聚合物以调节细胞功能开辟了新的途径。
“In-Situ Synthesis of Photoactive Polymers on Living Cell Surface via Bio-Palladium Catalysis for Modulating Biological Functions”
Ruilian Qi, Hao Zhao, Xin Zhou, Jian Liu, Nan Dai, Yue Zeng, Endong Zhang, Fengting Lv, Yiming Huang, Libing Liu, Yilin Wang*, and Shu Wang*
Angew. Chem. Int. Ed. ASAP, DOI: 10.1002/anie.202015247 https://doi.org/10.1002/anie.202015247
正文
细胞表面工程(cell surface engineering)是调节细胞功能的重要方法,可以保护细胞免受恶劣环境的影响,提高生物合成效率,或者使细胞更具功能化等。受这种方法的启发,目前一些功能性材料如金属/半导体纳米颗粒、聚合物、金属有机复合物等常被修饰在细胞的表面上1,2,3。由于这些材料与细胞膜之间可能存在排斥作用,常常需要过量的反应物。为了提高利用率,研究者发展出原位聚合的策略,产生的聚合物的电荷结构与活细胞表面具有较高的亲和力。目前主要的原位研究集中在自由基聚合反应上,但是引发剂和单体产生的自由基可能对细胞具有潜在的毒性,因此需要开发新的表面聚合方法。
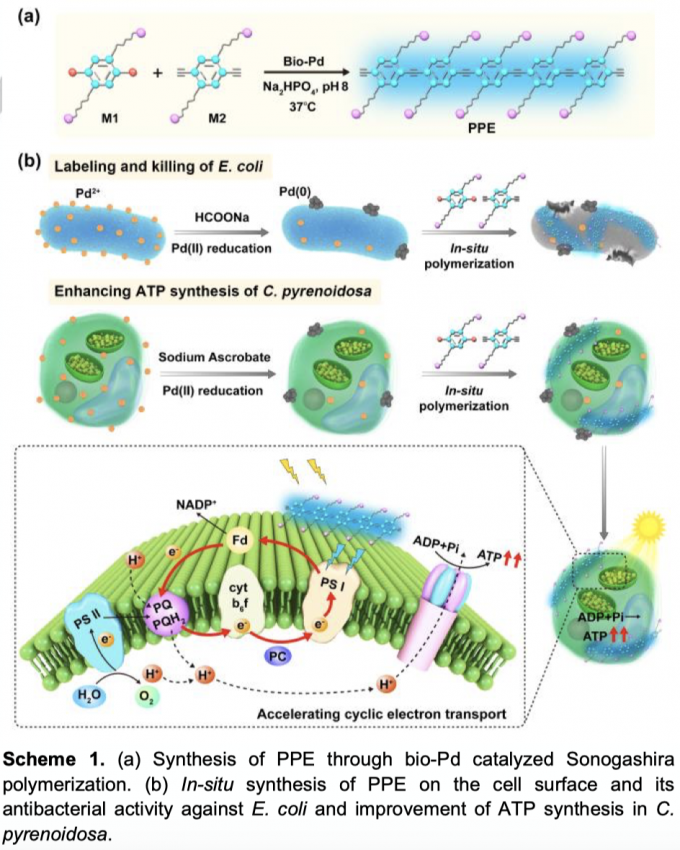
在活细胞系统中已经实现了钯催化的偶联反应,用于标记和药物合成等。细胞表面具有多个钯结合位点,包括羧基、氨基和磷酸基团等,有利于钯纳米颗粒的形成。此外,在细菌表面形成的钯纳米颗粒(bio-Pd)在Heck反应中表现出比胶体Pd更高的催化活性。因此,作者设计了一种新的原位聚合系统,使用细胞表面的bio-Pd来催化Sonagashira聚合反应,生成光敏的聚对苯撑乙炔(PPE)以修饰细胞表面(Scheme 1a)。该PPE带正电,可以通过静电相互作用与带负电的细胞表面相结合。由于PPE发蓝色荧光,因此可以验证细胞表面聚合物的形成。凭借共轭聚合物较强的吸光能力,它展现出对E.coli的抗菌活性和促进C.pyrenoidosa中ATP的合成,为原位聚合调控生物功能提供了一种新的策略。
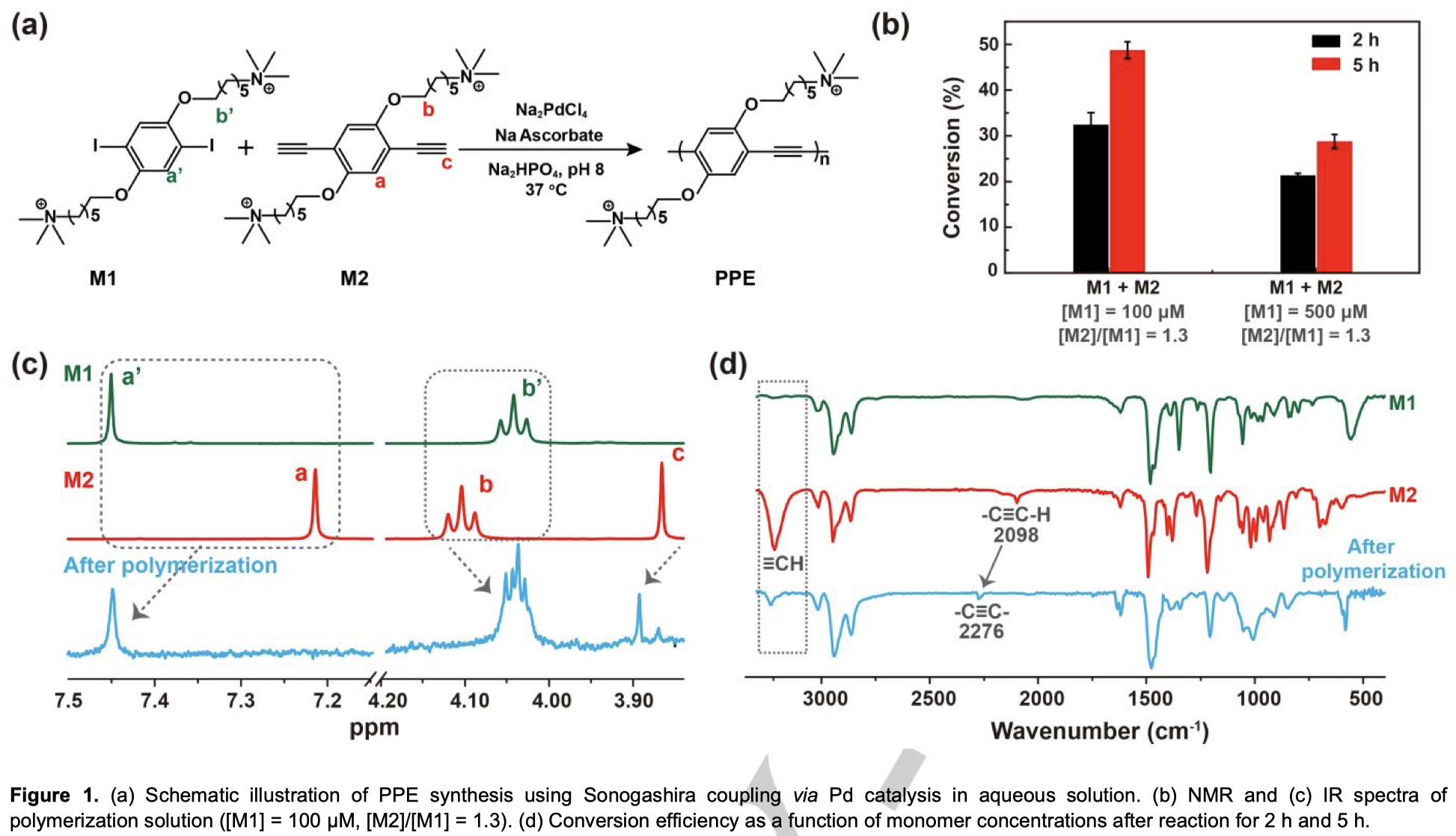
首先,作者研究了水溶液中的Sonagashira聚合反应(Figure 1)。作者选取了单体M1和M2,它们都带有正电荷,除了大大增强其水溶性之外,还可以与带负电荷的细胞表面相结合,从而靠近同样附着在细胞表面的钯催化剂。在M1/M2=1:1.3下,作者用HPLC研究了聚合物的转化效率(相对于M2,Figure 1b)。聚合物转化效率随着反应时间的增加而增加,在低单体浓度下([M1]=100 μM)反应2小时和5小时后,转化率分别达到32%和49%。将单体浓度提高至500 μM会使转化效率降低。由核磁和红外谱图可以看出(Figure 1c和1d),聚合后M2单体末端乙炔中的H和C-H拉伸峰(3220 cm-1)明显降低,表明M2的消耗。同时,C≡C的拉伸峰从2098 cm-1变为2276 cm-1,这表明形成了双取代的炔基,从而说明了聚合的进行。作者做了GPC测试,发现在100和500 μM下形成聚合物的分子量均为约3.5*103(约9个重复单元,详见SI)。此外,PPE聚合物发出的荧光比单体要强很多,因此溶液荧光的明显增加也进一步表明了PPE的生成。
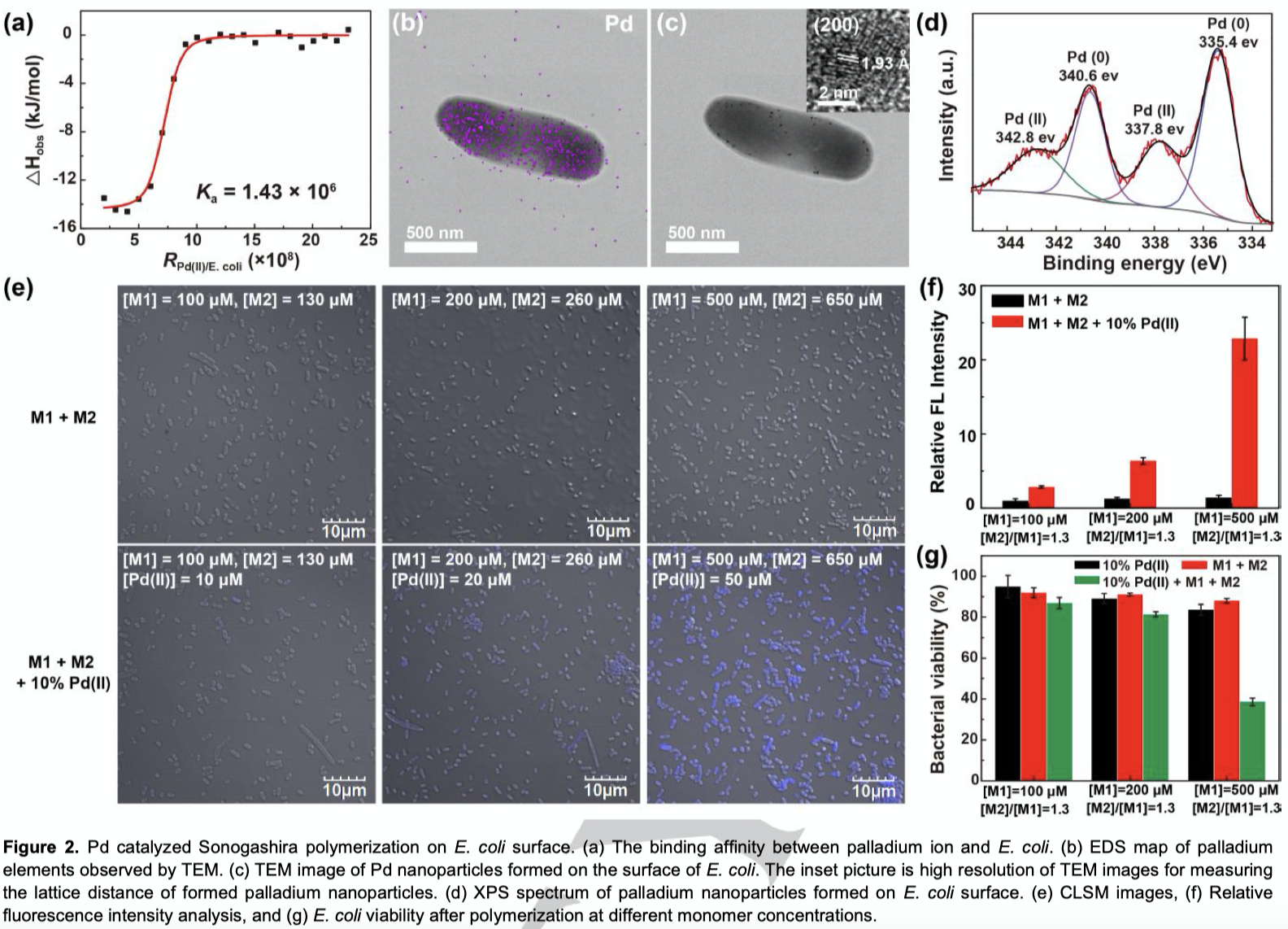
为了在细胞表面原位合成PPE,作者首先构建了在E.coli表面上的生物钯催化剂。Pd(II)离子与E.coli之间的亲和力通过等温滴定微量热法(isothermal titration microcalorimetry, ITC)来测定。推导出的结合常数(Ka)为1.43*106 M-1,表明Pd(II)离子与E.coli之间具有很强的静电结合力(Figure 2a)。细菌表面与Pd(II)离子结合后,添加甲酸钠(HCOONa)来引发钼酶(molybdoenzyme)催化E.coli表面的还原反应,将其还原为0价钯。EDS谱图中可以看出,E.coli表面存在Pd元素(Figure 2b)。在高分辨TEM图像中,可以观察到E.coli表面,晶格条纹面间距为1.93Å (200)的Pd纳米颗粒,与Pd(0)一致(Figure 2c)。为了进一步确认Pd(0)纳米颗粒的生成,作者对HCOONa处理过的Pd-E.coli样品进行XPS分析(Figure 2d)。在335.4(Pd 3d5/2)和340.6 eV(Pd 3d3/2)处的峰表明E.coli表面负载了Pd(0)。虽然也发现了Pd(II)在337.8和342.8 eV处的特征峰,不过可能是由于表面氧化所致。
将单体M1和M2加入表面附着生物钯的E.coli溶液中,即可发生原位聚合反应,并通过共聚焦激光扫描显微镜(CLSM)来追踪聚合过程。可以看到,在存在催化剂的情况下,E.coli表面荧光有显著增加,对照组则未观察到荧光(Figure 2e, f)。有研究报道,具有正电荷与疏水部分的PPE聚合物可能具有杀菌能力,因此作者测试了聚合反应前后的细菌存活率和细胞形态(Figure 2g)。可以看出仅存在Pd催化剂或单体时,E.coli的存活率影响很小;而同时存在的情况下,存活率变低,且当单体浓度增加至500 μM时,存活率下降至28%。在具有强还原能力的E.coli中,可以观察到明显的蓝色荧光和高的细菌杀死率,但在没有还原能力的P.aeruginosa上则荧光较弱,细菌杀死率也比较低。基于上述结果,可以得知,原位合成的聚合物可以对E.coli进行成像,追踪聚合过程,还表现出良好的抗菌能力。
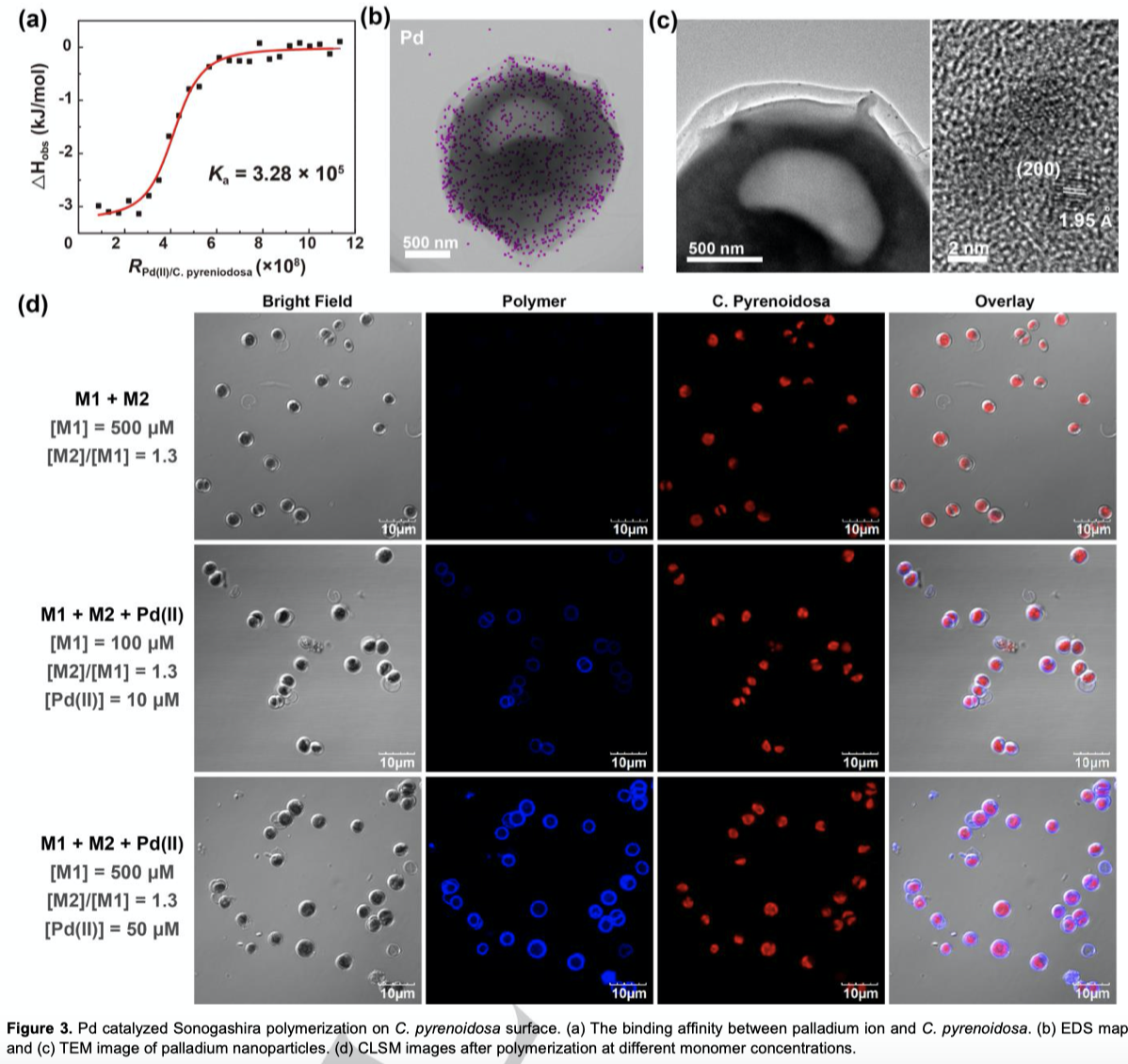
接下来,作者使用同样的原位聚合方法,在C.pyrenoidosa(蛋白核小球藻)上也修饰了聚合物PPE分子。Pd(II)离子与蛋白核小球藻的结合常数为3.28*105 M-1,表明Pd(II)离子通过很强的静电相互作用力与之相结合(Figure 3a)。与E.coli类似,经过抗坏血酸钠还原后,也通过EDS与TEM表征出蛋白核小球藻表面钯元素的存在(Figure 3b,c)。然后,作者在溶液中加入单体M1和M2,使用CLSM监测钯催化的聚合反应进程(Figure 3d)。在蛋白核小球藻红色发射的周围可以观察到蓝色荧光,且强度比仅用单体处理高数十倍,这些结果表明钯催化的Sonagashira聚合反应成功在蛋白核小球藻表面进行。
由于ATP是光合作用的重要产物,因此研究了生物钯催化的Sonagashira聚合反应对蛋白核小球藻产生ATP的影响。在聚合反应发生两个小时后,作者在白光下照射蛋白核小球藻溶液30分钟,并测量出产生ATP的量(Figure 4a)。结果表明,原位合成的聚合物增强了蛋白核小球藻的ATP合成。究其机理,可能是因为聚合物溶液的荧光发射光谱与蛋白核小球藻的吸收光谱重叠良好,可以被它用于光合作用。每个反应中心的吸收和捕获光能(ABS/RC和TR/RC)的增加确实证实了表面修饰了PPE的蛋白核小球藻具有更强的光吸收和捕获能力(Figure 4c,d)。由于PS II和PS I的活性都有助于光合作用效率的提升,因此也测量了PS I的能量转换效率。当单体浓度为500 μM时,生物钯负载的蛋白核小球藻的有效量子产率Y(I)表现出明显的增加(Figure 4e)。该结果表明,ATP合成的促进与PS I活性的增加有关,机理如Figure 4f所示。通常,光诱导的ATP合成伴随两条电子传递的途径:从PS II到PS I的线性电子传递和PS I周围的循环电子传输。PS II活性的降低和PS I活性的增加表明,修饰了PPE的蛋白核小球藻具有较高的循环电子转移能力,可驱动更多的ATP产生。
结语
中科院的王树课题组开发了一种新的原位聚合策略,用共轭聚合物修饰细胞表面以调节细胞活性。利用细胞表面的负电荷,通过表面酶或还原剂还原之后,bio-Pd纳米颗粒被装载到细胞表面,催化原位聚合反应,并可以通过共聚焦显微镜追踪反应过程。原位形成的光敏共轭聚合物除了对E.coli表现出良好的抗菌活性外,还可以通过增强光吸收和加速循环电子传递来增强C.pyrenoidosa的ATP合成。这一方法为细胞表面工程设计提供了一条新途径,可以通过不同的设计来调节细胞活性,从而实现预期的生物应用。
参考文献
[1] a) Z. Liu, X. Xu, R. Tang, Adv. Funct. Mater. 2016, 26, 1862-1880; b) R. Bian, Y. Jiang, Y. Wang, J. K. Sun, J. Hu, L. Jiang, H. Liu, Adv. Funct. Mater. 2018, 28, 1707408.
[2] a) J. T. Wilson, V. R. Krishnamurthy, W. Cui, Z. Qu, E. L. Chaikof, J. Am. Chem. Soc. 2009, 131, 18228-18229; b) J. T. Wilson, W. Cui, V. Kozlovskaya, E. Kharlampieva, D. Pan, Z. Qu, V. R. Krishnamurthy, J. Mets, V. Kumar, J. Wen, Y. Song, V. V. Tsukruk, E. L. Chaikof, J. Am. Chem. Soc. 2011, 133, 7054-7064; c) S. H. Yang, S. M. Kang, K. B. Lee, T. D. Chung, H. Lee, I. S. Choi, J. Am. Chem. Soc. 2011, 133, 2795-2797.
[3] R. Riccò, W. Liang, S. Li, J. J. Gassensmith, F. Caruso, C. Doonan, P. Falcaro, ACS Nano 2018, 12, 13-23.
















No comments yet.