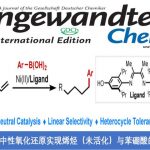
本记事介绍下最新的一篇Ru催化的苯胺衍生物的对位烷基化反应的论文。位置选择性极好,并且可以通过添加剂切换成间位选择性。
苯胺的位置选择性烷基化反应
以芳香族化合物为底物,进行位置选择性的直接官能团导入的合成手法,即「位置选择性C-H官能团化反应」是目前整个有机合成领域的一大热门课题。
为了对特定位置的C-H进行活化,被用的最多的一种手法是通过事先引入导向基团,与过渡金属进行配位,然后金属对最接近的芳香环上的C-H进行活化,也就是可以促进芳香环的环金属化反应(图 1A)(1),从而达到选择性C-H活化的目的。通过导向基团的开发,近年来报道了一系列的间位・对位C–H活化反应(2)。
然而,需要明白的是,即使有导向基的加入,并且可以达成与芳香环的环金属化反应,也并不是说可以实现在特定位置发生选择性的C-H活化。
接下来,小编介绍下具有代表性的芳香族化合物-苯胺的催化C-H烷基化反应。
Ackermann等人以嘧啶作为导向基,成功实现了苯胺的Ru催化的间位选择性烷基化反应(图 1C)(3)。通过导向基的作用,Ru催化剂在邻位发生环金属化形成的配合物a,不会与高级卤代烷烃反应。也就是说,螯合物a能够作为σ-芳基金属络合物进行反应,引起间位的亲电取代反应(4)。另外Weng与Lu等人报道了以甲基吡啶酰胺为导向基团,铜催化剂催化的氨基萘的对位C – H官能化反应(图 1C)(5)。铜催化剂与甲基吡啶酰胺部位形成二齿配位(络合物b),不会进行芳香环的环金属化。
这一次,巴斯大学的Frost教授,开发出了Ru催化的对位选择性的苯胺的C-H烷基化反应(图 1D)。该文章中使用的条件几乎与Ackerman等人的条件相同,而Ru催化剂不会与芳香环发生环金属化反应,而是与苯胺形成二齿配位,形成高位阻的苯胺衍生物c,最终发现了对位选择性C-H烷基化反应。
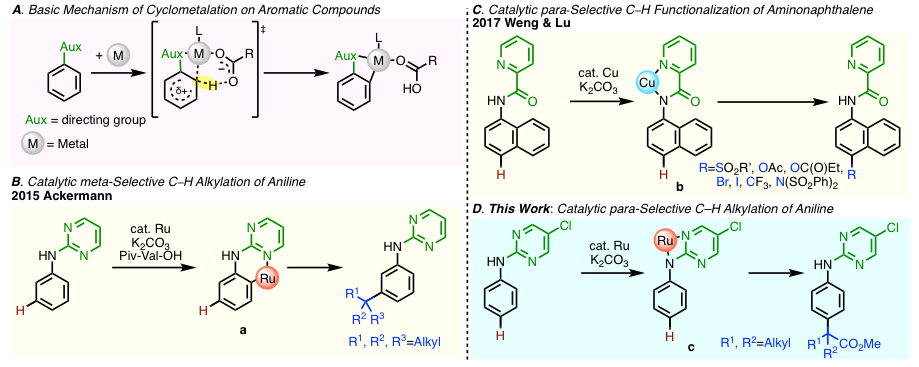
图1. (A) 芳香族化合物的环金属化反应 (B) 苯胺的间位烷基化反应 (C) 萘胺的对位烷基化反应 (D) 本文章介绍的反应
“Ruthenium-Catalyzed para-Selective C–H Alkylation of Aniline Derivatives”
Leitch, J. A.; McMullin, C. L.; Paterson, A. J.; Mahon, M. F.; Bhonoah, Y.; Frost, C. G. Angew. Chem., Int. Ed. 2017, 56, 15131. DOI: 10.1002/anie.201708961
论文作者介绍

研究者经历:
-1991 B.S., University of Loughborough
1991-1994 Ph.D., University of Loughborough
1994-1996 Posdoc, University of Texas (Prof. Philip D. Magnus)
1996-2011 Lecturer, Senior Ledcturer, University of Bath
2011- Professor, University of Bath
研究内容:位置选择性的C-H官能团化、串联催化剂体系的开发、生物探针的发展及其导入法的开发
论文概要
本反应,以TBME为溶剂,在Ru催化剂与K2CO3存在下,以作为导向基团的5-氯嘧啶取代的苯胺衍生物1为底物,与tert-溴代烷基酯2反应,得到了对位选择性烷基化产率3(图 2A)。作者尝试了多种苯胺衍生物与tert-溴代烷基酯,都得到了完美对位选择性的产物。另外5-位氯代嘧啶可以防止氯也被烷基化,有利于产率的提高。
推定的反应机理如下图 2B所示(参照论文SI)。
首先、Ru催化剂的氯离子被碳酸离子置换形成金属螯合物A,再与1反应形成螯合物B。B的金属-导向基部位作为高位阻的取代基起作用。Ru螯合物同时与tert-溴代烷基酯2发生单电子还原生成烷基自由基,与B反应生成自由基中间体C。C被在生成烷基自由基时形成的三价Ru催化剂进行单电子氧化,得到螯合物D,最终导向基从金属解离,形成对位选择性产物3。
作者等人,还通过把添加剂K2CO3改成KOAc/AcOH,成功把对位选择性切换成间位选择性(图 2C)。。
通过DFT计算算成了在碳酸盐与醋酸盐存在下,Ru螯合物形成时的吉布斯自由能变化。作者发现,在碳酸盐存在下,优先活化苯胺部位的N-H键(形成螯合物B),从而发生对位选择性。而在醋酸盐存在下苯胺的邻位的C-H键更容易被活化(芳香环环金属化体:上述螯合物a),从而得到间位选择性产物。
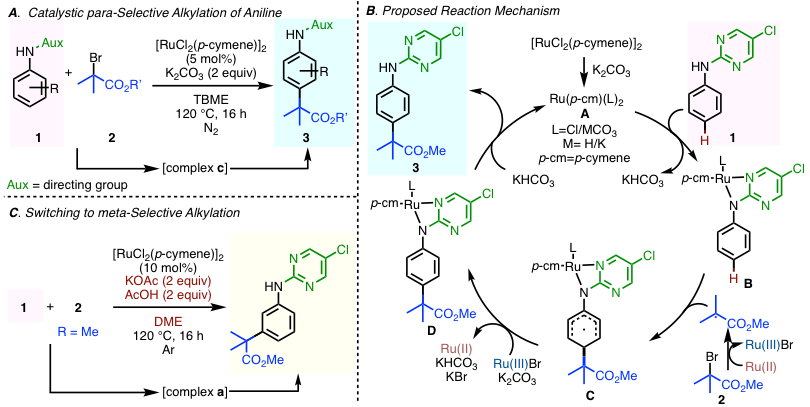
图2. (A) 苯胺的催化对位选择性烷基化反应 (B) 推定的反应机理 (C) 通过改变反应条件实现选择性的切换
参考文献
- Ackermann, L. Chem. Rev. 2011, 111, 1315. DOI: 10.1021/cr100412j
- Ma, W.; Gandeepan, P.; Li, J.; Ackermann, L. Chem. Front. 2017, 4, 1435. DOI: 10.1039/C7QO00134G
- Li, J.; Warratz, S.; Zell, D.; Sarkar, S. D.; Ishikawa, E. E.; Ackermann, L. J. Am. Chem. Soc. 2015, 137, 13894. DOI: 10.1021/jacs.5b08435
- Gagliardo, M.; Snelders, D. J. M.; Chase, P. A.; Gebbink, R. J. M. K.;van Klink, G. P. M.; van Koten, G. Angew. Chem., Int. Ed. 2007, 46, 8558. DOI: 10.1002/anie.200604290
- Li, J.-M.; Wang, Y.-H.; Yu, Y.; Wu, R.-B.; Weng, J.; Lu, G. ACS Catal. 2017, 7, 2661. DOI: 10.1021/acscatal.6b03671
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载






















No comments yet.