本文作者:杉杉
导读
近日,美国密西根大学Melanie S. Sanford课题组在Angew. Chem. Int. Ed.上发表论文,报道了一种脂环胺(alicyclic amines)的γ-C-H键功能化反应,从而有效的构建C(sp3)-卤素、氧、氮、硼和硫键。值得注意的是,在添加氧化剂之前将底物与Pd催化剂配位,可控制Cγ-H与Cα-H功能化的相对速率,从而实现相应的选择性。
Palladium-Mediated Cγ-H Functionalization of Alicyclic Amines
Melanie Sanford and Ellen Y. Aguilera
Angew. Chem. Int. Ed. ASAP DOI:10.1002/anie.202101782
正文
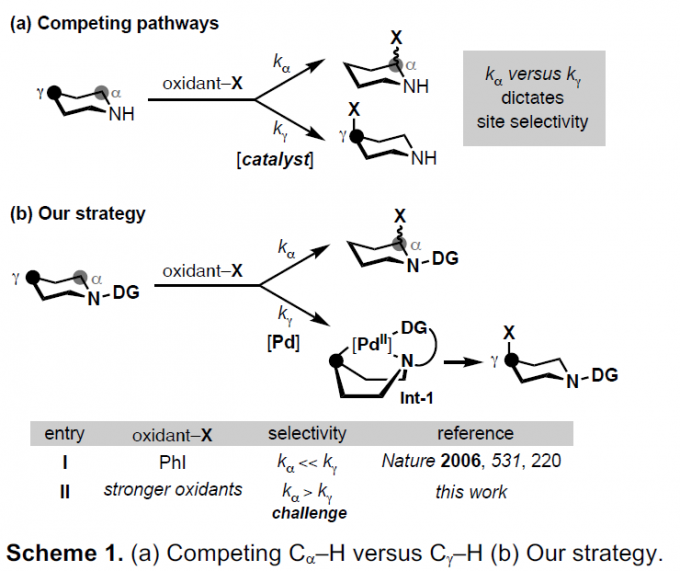
多取代脂环胺(Alicyclic amines)是生物活性分子中常见的骨架。对于官能化脂环胺骨架的构建,常需多步合成。在过去几十年中,已开发出多种脂环胺Cα-H功能化的方法[1-2](Scheme 1a, kα)。同时,相对于未活化的C(sp3)-H键,氮被氧化为自由基阳离子使Cα-H位具有高酸性(pKa〜16)。相反,远离氮原子的C(sp3)-H键(如Cγ-H)通常比Cα-H的反应性低,因此位点的选择性则更具难度。若要实现脂环胺的Cγ-H官能团化,则需控制Cα-H的反应速率。迄今为止,大多数文献均通过底物的修饰来实现选择性。如通过其他取代基来阻碍Cα-H的选择性[3],使胺基的氮质子化以使Cα-H电子失活[4]或引入一个导向基团来加速Cγ-H的功能化[5]。基于该课题组前期[6]在氮上引入一个合适的导向基团,可将Pd催化剂和芳基碘化物(ArI)氧化剂配对,从而使kγ远大于kα(Int-1, Scheme 1b)。此外,当使用更强的氧化剂,则kα远大于kγ(Scheme 1b, entry II)。
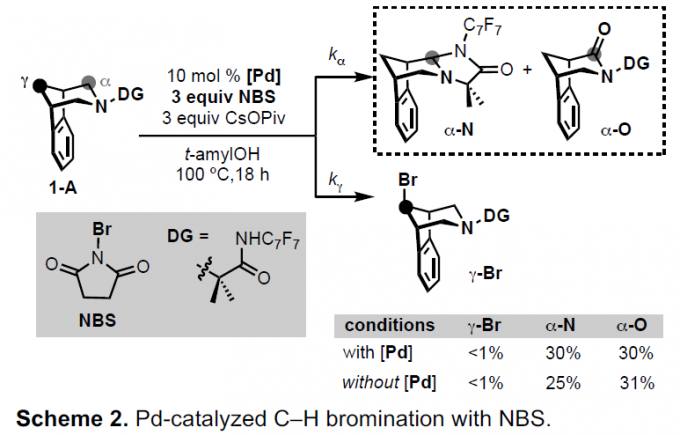
首先,作者以1-A为底物,NBS为氧化剂,对钯催化C-H溴化反应进行了研究(Scheme 2)。当在100℃的叔戊醇溶剂中,1-A与PhI反应以30%的收率获得Cγ-H苯基化产物,而没有检测到α-官能化产物(kγ远大于kα)。然而,当使用NBS代替PhI时,未检测到Cγ-H溴化产物γ–Br。相反,分别获得30%收率的α-氧化产物α–N和α–O。而在无Pd催化剂时,同样获得相似的结果。这些结果表明,使用NBS时,α-氧化速率(kα)远大于Pd催化的γ-氧化速率(kγ)。
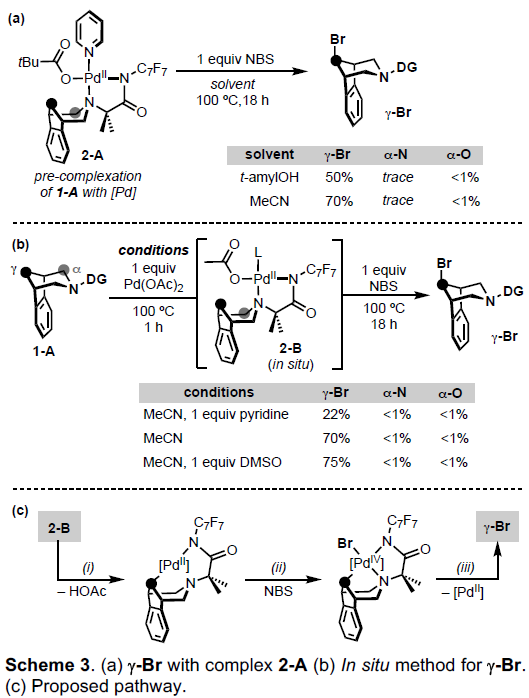
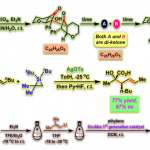
作者假设,是否可通过底物1-A和Pd之间的预配位,从而实现相对速率的控制(Scheme 3a)。反应结果表明,当以2-A为底物时,以NBS为氧化剂,可提高kγ,可在乙腈溶剂中获得70%收率的γ–Br产物,并且仅存在少量的α–N和α–O产物。为了简化合成的过程,作者设计了两步一锅法的策略,即先将1-A和Pd(OAc)2进行配位,然后加入NBS(Scheme 3b)。通过进一步的优化,可获得高达75%收率的γ–Br产物(α–N和α–O <1%)。此外,作者也提出了一种可能的反应机理(Scheme 3c)。首先,1-A与Pd(OAc)2配位形成2-B。2-B经乙酸盐辅助,实现Cγ-H活化。随后,通过NBS将该PdII中间体氧化为PdIV中间体。最后,经消除反应,即可获得γ–Br产物。
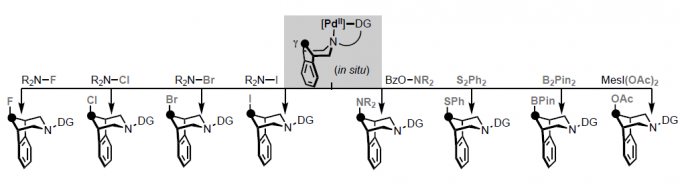
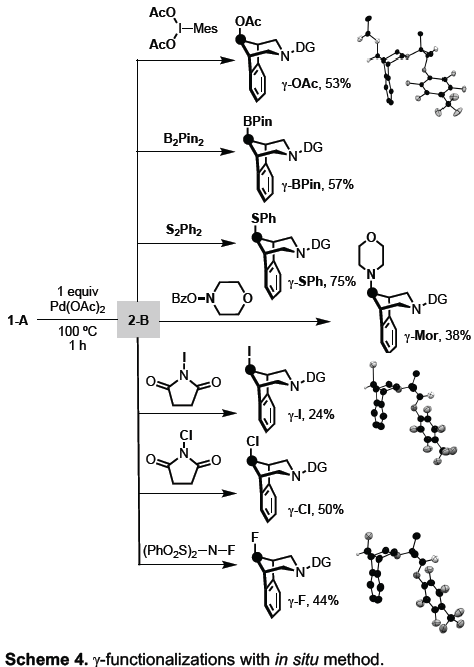
紧接着,作者研究了一系列不同的氧化剂(Scheme 4)。反应结果表明,2-B可与不同的氧化剂反应,从而有效的在γ位构建C-O、C-S、C-N、C-F、C-Cl、C-I和C-B键。值得注意的是,在C-X键形成过程中构型保持完整。
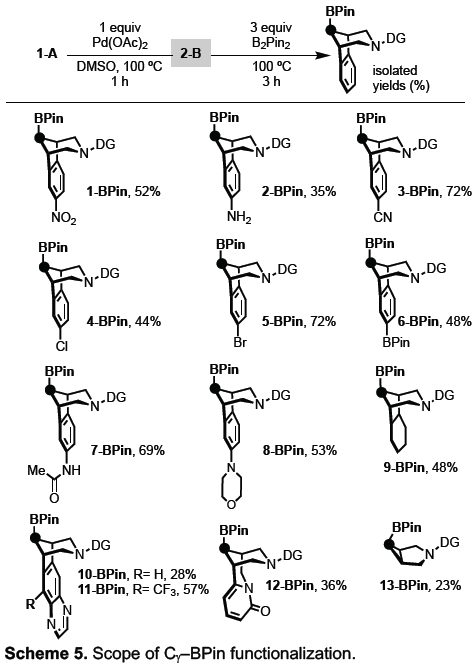
最后,作者对Cγ-BPin官能化的范围进行了扩展(Scheme 5)。当芳基上具有硝基、氨基、氰基、卤素、硼酸酯和酰胺基等,均具有良好的耐受性。其次,脂肪族环胺、杂芳胺以及生物活性分子varenicline(10-BPin)和cytisine(12-BPin)的胺,均以高选择性获得Cγ-H硼化产物。值得注意的是,具有硼酸酯产物可进一步转化为胺、醇等产物。
总结
美国密西根大学Melanie S. Sanford课题组报道了一种通过将底物与Pd催化剂配位后,再加入氧化剂的策略,从而实现脂环胺的Cγ-H的活化。通过该策略,成功实现了C(sp3)-卤素、氧、氮、硼和硫键的构建。值得注意的是,通过对Cγ-H与Cα-H功能化的相对速率的控制,对于反应至关重要。
参考文献
[1] For examples of C
α-H of alicyclic amines, see: a) S. J. Pastine, D. Gribkov, D. Sames,
J. Am. Chem. Soc.
2006,
128, 14220−14221; b) K. R. Campos,
Chem. Soc. Rev.
2007,
36, 1069−1084; c) E. A. Mitchell, A. Peschiulli, N. Lefevre, L. Meerpoel, B. U. W. Maes,
Chem. – Eur. J. 2012,
18, 10092−10142; d) L. Shi, W. Xia,
Chem. Soc. Rev.
2012,
41, 7687−7697; e) J. He, L. G. Hamann, H. M. L. Davies, R. E. J. Beckwith,
Nat. Commun. 2015,
6, 5943; f) J. E. Spangler, Y. Kobayashi, P. Verma, D.-H. Wang, J.-Q. Yu,
J. Am. Chem. Soc.
2015,
137, 11876−11879; g) W. Chen, L. Ma, A. Paul, D. Seidel,
Nat. Chem. 2017,
10, 165−169.
[2] For examples of amines undergoing side reactions in presence of metal catalysts and oxidants, see: a) S. Murahashi, T. Naota, K. Yonemura,
J. Am. Chem. Soc. 1988,
110, 8256-8258; b) N. S. Venkataramanan, G. Kuppuraj, S. Rajagopal,
Coord. Chem. Rev.
2005,
249, 1249-1268; c) J. Park, Y. Morimoto,Y.-M. Lee, Y. You, W. Nam, S. Fukuzumi,
Inorg. Chem.
2011,
50, 11612-11622; d) P. Liu, Y. Liu, E L.-M.Wong, S. Xiang, C.-M.Che,
Chem. Sci.
2011,
2, 2187-2195; e) X. W. Cai, M. Sha, C. P. Guo, R. M. Pan,
Asian J. Chem. 2012,
24, 3781-3784; f) J. Genovino, S. Ltz, D. Sames, B. B. Tour,
J. Am. Chem. Soc. 2013,
135, 12346-12352; g) Z. Ling, L. Yun, L. Liu, X. Fu,
Chem. Commun. 2013,
49, 4214-4216; h) H. A. Malik, B. L. H. Taylor, J. R. Kerrigan, J. E. Grob, K. N. Houk, J. Du Bois, L. G. Hamann, A. W. Patterson,
Chem. Sci. 2014,
5, 2352-2361; i) S. Kim, J. W. Ginsbach, J. Y. Lee, R. L. Peterson, J. J. Liu, M. A. Siegler, A. A. Sarjeant, E. I. Solomon, K. D. Karlin,
J. Am. Chem. Soc.
2015,
137, 2867-2874.
[3] For remote C–H functionalization blocking C
α-H sites on alicylic amines, see: a) A. McNally, B. Haffemayer, B. S. Collins, M. J. Gaunt,
Nature 2014,
510, 129-133; b) J. Calleja, D. Pla, T. W. Gorman, V. Domingo, B. Haffemayer, M. J. Gaunt,
Nature Chemistry 2015,
7, 1009-1016.
[4] For remote C−H functionalization protonating nitrogen on alicylic amines, see: a) C. Annese, L. D’Accolti, M. De Zotti, C. Fusco, C. Toniolo, P. G. Williard, R. Curcu,
J. Org. Chem.
2010,
75, 4812-4816; b) C. T. Mbofana, E. Chong, J. Lawniczak, M. S. Sanford,
Org. Lett.
2016,
18, 4258-4261; c) D. M. Schultz, F. Lvesque, D. A. DiRocco, M. Reibarkh, Y. Ji, L. A. Joyce, J. F. Dropinski, H. Sheng, B. D. Sherry, I. W. Davies,
Angew. Chem. Int. Ed. 2017,
56, 15274-15278; d) M. Lee, M. S. Sanford,
Org. Lett. 2017,
19, 572-575; e) C. M. White, J. Zhao,
J. Am. Chem. Soc.
2018,
140, 13988-14009.
[5] For remote C−H functionalization using directing groups, see: a) D. Antermite, J. A. Bull,
Synthesis 2019,
51, 3171-3204; b) C. He, W. G. Whitehurst, M. J. Gaunt,
Chem 2019,
5, 1031-1058; c) Z. Li, M. Dechantsreiter, S. Dandapani,
J. Org. Chem.
2020,
85, 6747-6760.
[6] a) J. J. Topczewski, P. J. Cabrera, N. I. Saper, M. S. Sanford,
Nature 2016,
531, 220−224; b) P. J. Cabrera, M. Lee, M. S. Sanford,
J. Am. Chem. Soc.
2018,
140, 5599-5606; c) A. L. Dewyer, P. M. Zimmerman,
ACS Catal.
2017,
7, 5466-5477.























No comments yet.