本文作者:Joy
导读
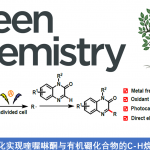
上海有机化学研究所的梅天胜团队采用镍催化与电化学结合的全新反应策略,成功实现一系列NH-亚砜亚胺 (NH-sulfoximine)底物的N-芳基化。这一策略为亚砜亚胺衍生物的构建开辟出一条较为实用的反应路线。在这一策略的设计中,作者采用成对电解 (paired electrolysis)的电化学合成策略,因此,无需牺牲阳极 (sacrificial anode)。同时,这一策略具有反应条件温和、官能团兼容性以及反应收率良好等优势。反应机理研究表明,在室温条件下,通过NiII物种的阳极氧化过程产生的NiIII物种,对于后续还原消除过程的顺利进行尤为关键。
Nickel-Catalyzed N-Arylation of NH-Sulfoximines with Aryl Halides via Paired Electrolysis
D.Liu, Z.Liu, C. Ma, K. Jiao, B. Sun, L. Wei, J. Lefranc, S. Herbert, T. Mei,
Angew. Chem. Int. Ed. 2021, 60, 9444. doi: 10.1002/anie.202016310.
正文
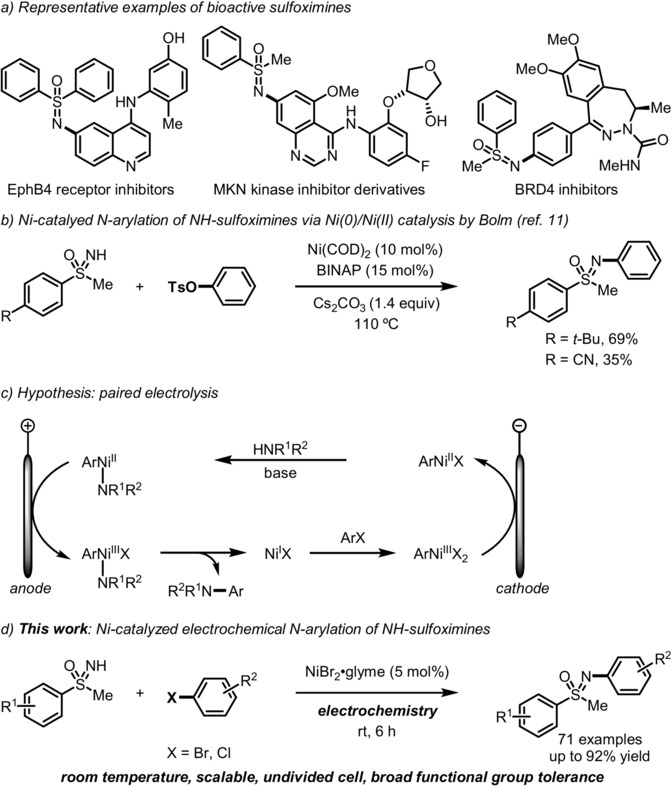
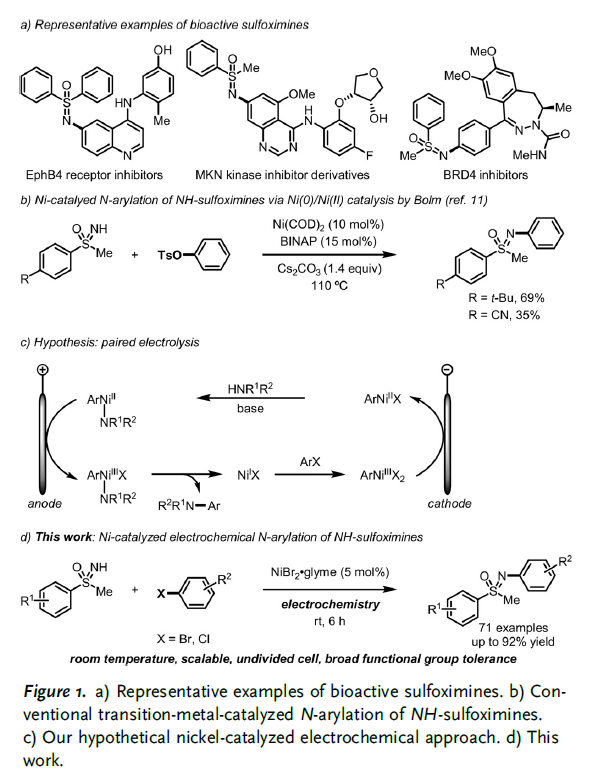
由于 N-芳基亚砜亚胺作为重要的结构单元,广泛存在于各类手性辅基、不对称催化的相关配体、构建假肽 (pseudopeptide)分子的重要砌块以及生物活性分子中。因此,采用过渡金属催化的亚砜亚胺N-芳基化反应方法学一直以来备受化学家的广泛关注 (Figure 1a)[1]–[2]。与钯催化以及铜催化过程相比,采用镍催化的亚砜亚胺与芳基卤之间的N-芳基化反应策略则较少有研究报道,尽管镍催化剂价格低廉,然而,对与反应性较低的亲电底物,例如,芳基卤与胺之间交叉偶联反应中的芳基氯底物,却同样能够表现出较高的反应活性[3]–[4]。2000年,Bolm团队首次报道采用Ni(COD)2与BINAP体系催化的亚砜亚胺与芳基对甲苯磺酸酯之间的N-芳基化反应方法学 (Figure1b)[5]。然而,上述策略中,却存在反应温度较高、底物应用范围有限等不利因素。为解决上述问题,近期,König与Wimmer通过将Ni催化与Ir光催化有效结合,并在室温条件下,成功开发出亚砜亚胺与芳基溴之间的N-芳基化反应策略[6]。然而,这一策略中,需要采用昂贵的Ir催化剂,同时,尚未报道采用更为廉价易得的芳基氯底物参与相应NH-亚砜亚胺的N-芳基化过程。
在过去几年中,有机电化学策略由于能够避免采用化学氧化剂或还原剂,同时能够进一步改变反应活性与反应过程的选择性而逐渐兴起[7]。尤其,将镍催化与电化学反应过程结合的相关合成转化方法学,已经发展成为实现交叉偶联反应过程的重要策略之一[8]。例如,Baran小组报道在温和的反应条件下,通过镍催化促进的芳卤胺化反应方法学。其中,反应机理步骤中涉及两种以上不同氧化态的Ni中间体 [9]–[10]。基于以上研究的启发,作者设想,采用Ni电催化促进的NH-亚砜亚胺与芳卤之间的N-芳基化过程,能够在较为温和反应条件下,通过成对电解的方式进行[11]。其中,通过阳极氧化过程产生的NiIII物种,能够促进还原消除的进行,进而形成C-N键。同时,通过阴极还原过程,由前催化剂NiII产生NiI物种。接下来,NiI物种能够与芳卤进行进一步的氧化加成过程,并获得ArNiIIIX2中间体。ArNiIIIX2中间体能够较为容易地经历阴极还原过程,形成ArNiIIX中间体 (Figure1c)。基于上述设想,作者最终成功设计出采用Ni催化剂参与的NH-亚砜亚胺与芳基溴以及芳基氯之间的N-芳基化反应策略。并且,该策略能够在室温条件下有效地进行 (Figure1d)。同时,反应机理研究表明,通过NiII物种的阳极氧化过程,对于促进NiIII物种的还原消除过程,进而形成C-N键尤为重要。
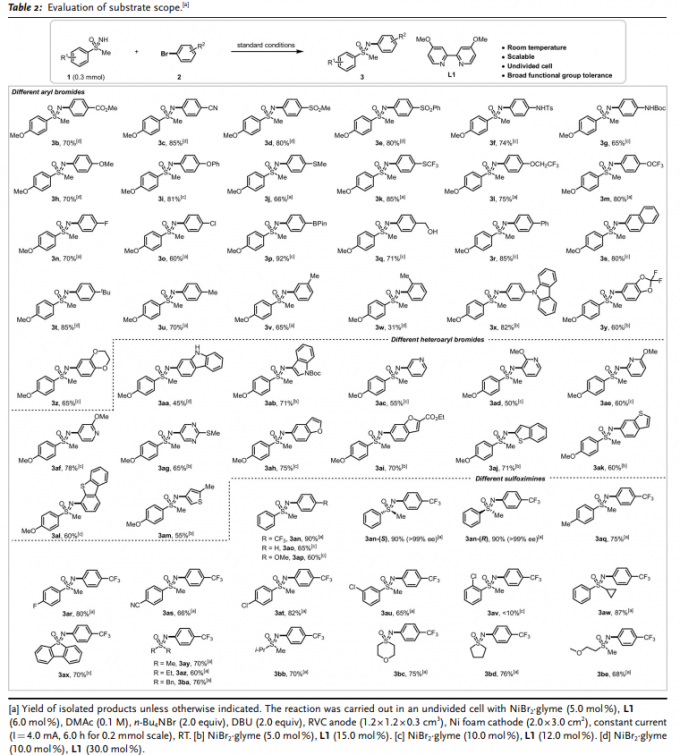
首先,作者采用NH-亚砜亚胺1a与芳基溴2a作为模型底物,进行相关反应条件的优化筛选。进而确定最佳的反应条件为: 采用5.0 mol% NiBr2·glyme作为催化剂, 6.0 mol% di-OMebpy (4,4′-二甲氧基-2,2′-联吡啶) L1作为配体,2 eq. DBU作为碱,2 eq. n-Bu4NBr作为电解质,反应溶剂为 DMAc,反应温度为室温,在无隔膜电解槽 (undivided cell)中,采用泡沫镍 (Ni foam)作为阴极,RVC (reticulated vitreous carbon)作为阳极,控制电流为4.0 mA的条件下进行电解,6h后,能够以90%的分离收率,获得相应的N-芳基亚砜亚胺3a产物 (Table1,entry 1)。
在上述最佳的反应条件下,作者对N-芳基化策略相应的底物应用进行考察。研究表明,上述镍催化的N-芳基化策略,表现出优良的官能团兼容性 (3b–3v)。在标准反应条件下,一系列带有吸电子基与供电子基团取代的芳基溴底物,均能获得良好的反应收率 (3b–3i)。然而,采用邻位甲基取代的芳基溴底物时,却观察到反应收率显著降低 (3w),这可能源于立体位阻的增加。同时,研究发现,上述的最佳反应条件对于各类杂芳基溴底物同样能够良好地兼容 (3x–3z以及3aa–3am)。接下来,作者采用4-溴三氟甲苯2a作为模板底物,进一步对NH-亚砜的底物适用范围进行考察 (Table 2)。研究表明,上述的标准反应条件对于电中性 (3an)、富电子 (3aq)以及缺电子 (3ar–3av)的亚砜亚胺底物,均能够良好地兼容,并获得良好至优良的产物收率。值得注意的是,具有环丙基 (3aw)、二芳基 (3ax)以及二烷基 (3ay–3be)取代的亚砜亚胺底物,同样能够有效地参与上述镍催化的N-芳基化过程,并获得良好至优良的反应收率。并且,作者进一步发现,在选择对映纯的NH-甲基苯亚砜亚胺底物与4-溴三氟甲苯2a进行反应时,未观察到目标产物的外消旋化 (3an–R, 3an–S)。
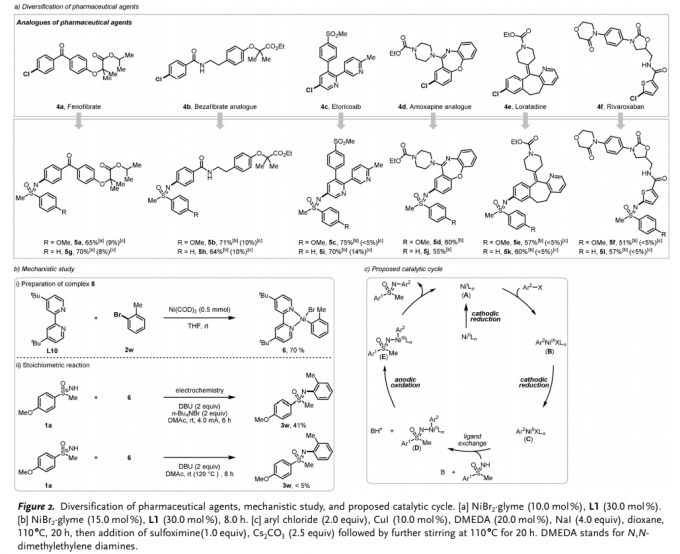
尽管与芳基溴相比,芳基氯更为廉价易得,然而,采用镍催化的NH-亚砜亚胺与芳基氯之间的N-芳基化反应,尚未有相关的文献报道。令人欣喜的是,上述镍催化的N-芳基化反应方法学同样能够较好地应用于具有芳基氯结构单元的 (4a–4f)的医药相关化合物 (medicinally relevant compound) 结构的多样化 (diversification)修饰,进而表明,上述的镍催化的N-芳基化反应策略具有良好的合成应用价值 (5a-5l)。相反地,在Cu催化条件下,芳基氯参与的相关反应过程,则反应收率较低 (Figure 2a)。
为提出合理的反应机理,作者首先将2-溴甲苯 (2w)在4,4′-叔丁基-2,2′-联吡啶L10以及1 eq. Ni(COD)2存在的条件下,室温下反应4 h。最终发现,能够以70%的反应收率,获得NiII配合物6。接下来,该小组进行相关的化学计量反应实验研究:首先,将配合物6与亚砜亚胺1a分别在室温以及120 oC的条件下进行反应,最终,作者发现,均未以良好的反应收率获得相应目标产物3w。然而,作者进一步观察到,在存在外加电流的条件下,将配合物6与1a进行反应时,能够以41%的收率,获得相应的目标产物3w。上述研究表明,通过ArNiII物种的阳极氧化过程,产生的 ArNiIII中间体,对于目标产物的形成尤为关键 (Figure2b)。
基于前期的文献报道[13]-[16]以及作者通过CV (cyclic voltammetric)方法的深入研究 (参阅SI),进而提出一种合理的催化循环过程 (Figure2c)。首先,NiII催化剂通过阴极还原过程,产生NiI物种 A。之后,通过氧化加成过程,形成ArNiIII中间体 B。接下来,中间体 B进一步经历阴极还原过程,形成ArNiII物种,并进一步与NH-亚砜亚胺经历配体交换过程,形成相应的ArNiII物种 D。之后,通过中间体D的阳极氧化过程,形成ArNiIII物种 E,最终,通过E的还原消除过程,形成相应的芳基化产物3或5,并使NiI物种再生。然而,当前的机理研究并无法排除其他可能的反应路径。并且,反应机理步骤中同样可能涉及Ni0/NiII/NiIII/NiI的催化循环序列[12]。
总结
上海有机化学研究所的梅天胜团队报道首例采用Ni催化剂参与的NH-亚砜亚胺与芳基溴以及芳基氯之间的电化学N-芳基化反应方法学,并获得良好至优良反应收率的亚砜亚胺基衍生物 (sulfoximidoyl derivative)。上述策略具有操作简单实用、反应条件温和以及优良的官能团兼容性等优势,并能够进一步应用于医药相关化合物的多样化修饰。
参考文献
- Bizet, R. Kowalczyk, C. Bolm, Chem. Soc. Rev.2014, 43, 2426. doi: 10.1039/C3CS60427F.
- W. Goldberg, J. G. Kettle, J. Xiong, D. Lin, Tetrahedron2014, 70, 6613.doi: 10.1016/j.tet.2014.06.120.
- Marín, R. J. Rama, M. C. Nicasio, Chem. Rec. 2016, 16, 1819. doi:10.1002/tcr.201500305.
- Y. Liu, J. M. Dennis, S. L. Buchwald, J. Am. Chem. Soc.2020, 142, 4500.doi: 10.1021/jacs.0c00286.
- Bolm, J. P. Hildebrand, J. Rudolph, Synthesis 2000, 911.doi: 10.1055/s-2000-6287.
- Wimmer, B. König, Org. Lett.2019, 21, 2740. doi: 10.1021/acs.orglett.9b00698.
- Wang, S. S. Stahl, Acc. Chem. Res.2020, 53, 561. doi: 10.1021/acs.accounts.9b00544.
- Mo, Z. Lu, G. Rughoobur, P. Patil, N. Gershenfeld, A. I. Akinwande, S. L.Buchwald, K. F. Jensen, Science2020, 368, 1352. doi: 10.1126/science.aba3823.
- Li, Y. Kawamata, H. Nakamura, J. C. Vantourout, Z. Liu, Q. Hou, D. Bao, J. T. Starr, J. Chen, M. Yan, P. S. Baran, Angew. Chem. Int. Ed.2017, 56, 13088.doi: 10.1002/anie.201707906.
- T. Flood, S. Asai, X. Zhang, J. Wang, L. Yoon, Z. C. Adams, B. C. Dillingham, B. B. Sanchez, J. C. Vantourout, M. E. Flanagan, D. W. Piotrowaski, P. Richardson, S. A. Green, R. A. Shenvi, J. S. Chen, P. S. Baran, P. E. Dawson, J. Am. Chem. Soc. 2019, 141, 9998. doi: 10.1021/jacs.9b03774.
- Zhang, X. Hu, Chem. Sci. 2020, 11, 10786. doi: 10.1039/D0SC01445A.
- Diccianni, Q. Lin, T. Diao, Acc. Chem. Res. 2020, 53, 906. doi: 10.1021/acs.accounts.0c00032.
- T. Flood, S. Asai, X. Zhang, J. Wang, L. Yoon, Z. C. Adams, B. C. Dillingham, B. B. Sanchez, J. C. Vantourout, M. E. Flanagan, D. W. Piotrowaski, P. Richardson, S. A. Green, R. A. Shenvi, J. S. Chen, P. S. Baran, P. E. Dawson, J. Am. Chem. Soc. 2019, 141, 9998. doi: 10.1021/jacs.9b03774.
- Kawamata, J. C. Vantourout, D. P. Hickey, P. Bai, L. Chen, Q. Hou, W. Qiao, K. Barman, M. A. Edwards, A. F. Garrido-Castro, J. N. de Gruyter, H. Nakamura, K. Knouse, C. Qin, K. J. Clay, D. Bao, C. Li, J. T. Starr, C. Garcia-Irizarry, N. Sach, H. S. White, M. Neurock, S. D. Minteer, P. S. Baran, J. Am. Chem. Soc. 2019, 141, 6392. doi: 10.1021/jacs.9b01886.
- Nakamura, K. Yasui, Y. Kanda, P. S. Baran, J. Am. Chem. Soc. 2019, 141, 1494. doi: 10.1021/jacs.8b13697.
- Luo, B. Hu,W. Wu, M. Hu, T. L. Liu, Angew. Chem. Int. Ed. 2021, 60, 6107. doi: 10.1002/anie.202014244.
















No comments yet.