本文作者:杉杉
导读
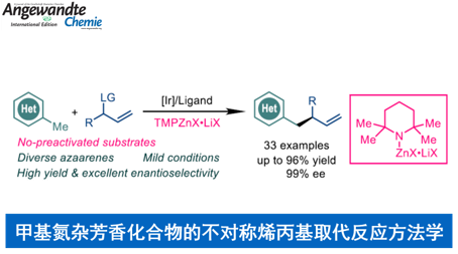
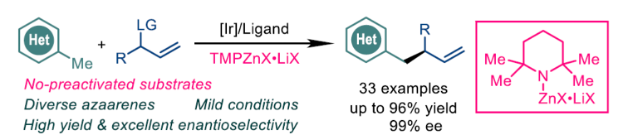
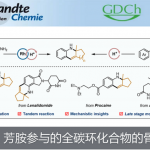
近日,上海有机化学研究所的游书力课题组在Angew. Chem. Int. Ed.中发表论文,成功设计出一种全新的采用铱催化剂促进的通过甲基氮杂芳香化合物 (methyl azaarenes)参与的不对称烯丙基取代反应方法学,进而成功完成一系列手性氮杂芳香分子的构建。这一全新的对映选择性烯丙基取代策略具有广泛的底物应用范围、良好的反应收率以及优良的对映选择性等优势。
Iridium-Catalyzed Asymmetric Allylic Substitution of Methyl Azaarenes
Liu, W. Zhang, C. Zheng, S. You, Angew. Chem. Int. Ed. 2022, ASAP. doi: 10.1002/anie.202200164.
正文
具有手性基团取代的氮杂芳香结构单元广泛存在于各类生物活性天然产物、药物以及农用化学品分子中。目前,通过取代氮杂芳香化合物参与的α-选择性官能团化反应方法学,已经有诸多的研究报道[1]-[2]。然而,对于催化对映选择性α-选择性官能团化策略的研究,却较少有相关的文献报道[3]-[4]。这里,受到近年来对于采用Knochel试剂[5]参与的相关合成转化研究以及本课题组采用铱催化剂促进的AAA (asymmetric allylic alkylation)反应方法学相关研究报道[6]-[7]的启发,上海有机所的游书力课题组报道一种全新的选择铱催化剂促进的通过各类甲基氮杂芳香分子参与的不对称烯丙基取代反应方法学,进而成功完成一系列手性氮杂芳香分子的构建(Scheme 1)。
正文
具有手性基团取代的氮杂芳香结构单元广泛存在于各类生物活性天然产物、药物以及农用化学品分子中。目前,通过取代氮杂芳香化合物参与的α-选择性官能团化反应方法学,已经有诸多的研究报道[1]-[2]。然而,对于催化对映选择性α-选择性官能团化策略的研究,却较少有相关的文献报道[3]-[4]。这里,受到近年来对于采用Knochel试剂[5]参与的相关合成转化研究以及本课题组采用铱催化剂促进的AAA (asymmetric allylic alkylation)反应方法学相关研究报道[6]-[7]的启发,上海有机所的游书力课题组报道一种全新的选择铱催化剂促进的通过各类甲基氮杂芳香分子参与的不对称烯丙基取代反应方法学,进而成功完成一系列手性氮杂芳香分子的构建(Scheme 1)。
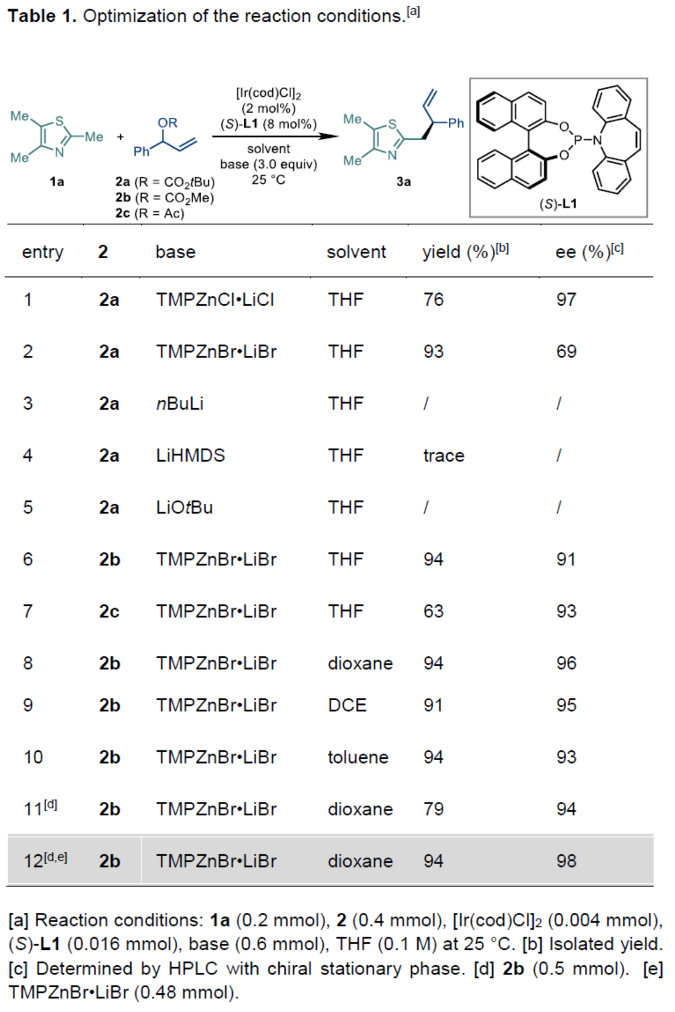
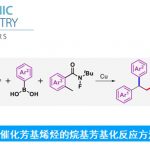
首先,作者采用2,4,5-三甲基噻唑1a与烯丙基碳酸酯2b作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用[Ir(cod)Cl]2作为催化剂,(S)-L1作为手性配体TMPZnBr•LiBr作为碱,二氧六环作为反应溶剂,反应温度为25oC,最终获得94%收率的目标产物3a (98% ee)。
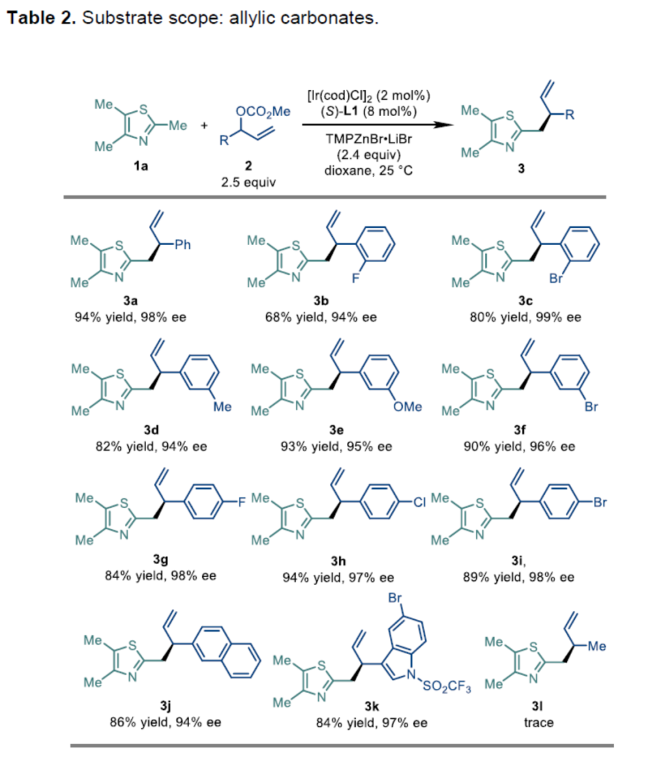
在上述的最佳反应条件下,作者首先对一系列烯丙基碳酸酯底物的应用范围进行考察 (Table 2)。研究表明,一系列苯环不同位置带有不同基团取代的烯丙基碳酸酯底物,均能够顺利地参与上述的不对称烯丙基取代过程,并以中等至良好的反应收率以及高度的对映选择性 (94-99% ee),获得相应的手性产物3a–3i。同时,研究发现,2-萘基或3-吲哚基衍生的烯丙基碳酸酯底物,同样能够与上述的标准反应体系良好地兼容,并分别获得相应的手性产物3j (86%收率,94% ee)与3k (84%收率,97% ee)。然而,上述的标准反应体系对于巴豆基碳酸酯底物,则仅能够获得痕量的目标产物。
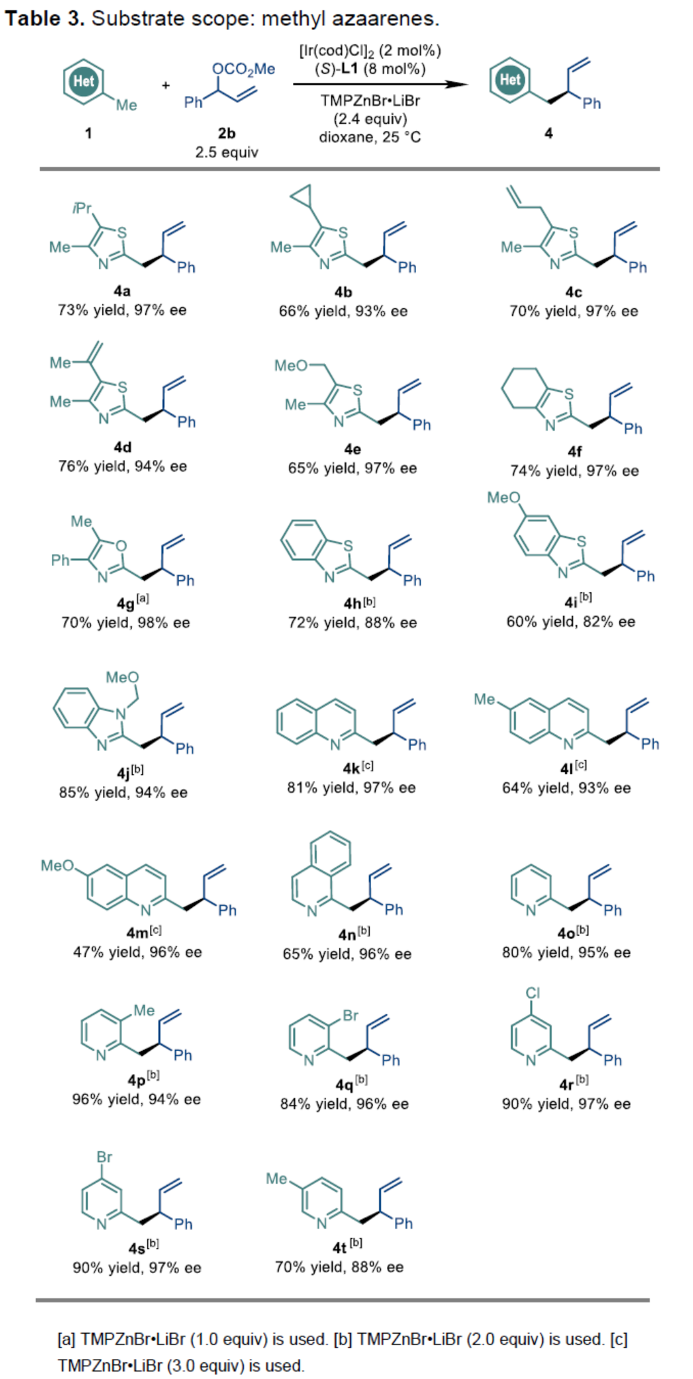
接下来,作者对各类甲基氮杂芳香底物的应用范围进行深入研究 (Table 3)。该小组发现,上述的最佳反应条件对于噻唑环C5-位中具有异丙基、环丙基、烯丙基、乙烯基或MOM基团取代的 2,4-二甲基噻唑以及2-甲基-4,5,6,7-四氢苯并[d]噻唑底物,均能够有效地参与上述的对映选择性转化过程,并获得相应的手性产物4a–4f (65-76%反应收率,83-97% ee)。同时,上述的标准反应体系对于2-甲基噁唑、2-甲基苯并噻唑、2-甲基苯并咪唑衍生物、2-甲基喹啉、1-甲基异喹啉以及2-甲基吡啶衍生物,均能够有效地兼容,进而获得相应的目标产物4g–4t (47-85% 反应收率,82-98% ee)。接下来,作者发现,对于部分底物,进一步调整TMPZnBr•LiBr碱的加入量,能够有效地避免双重烯丙基化副产物的形成。
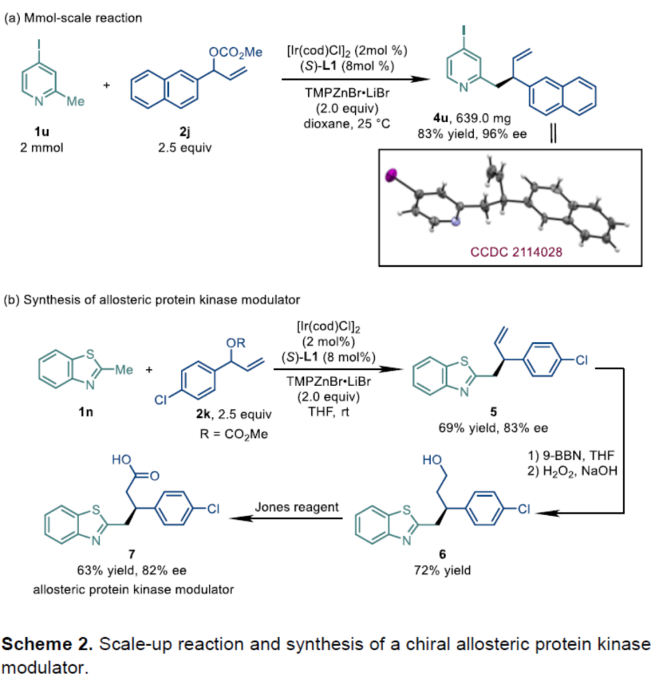
之后,该小组进一步对这一全新的不对称烯丙基取代策略的合成应用价值进行如下研究 (Scheme 2)。
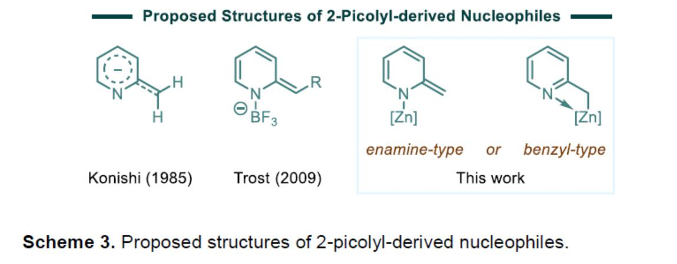
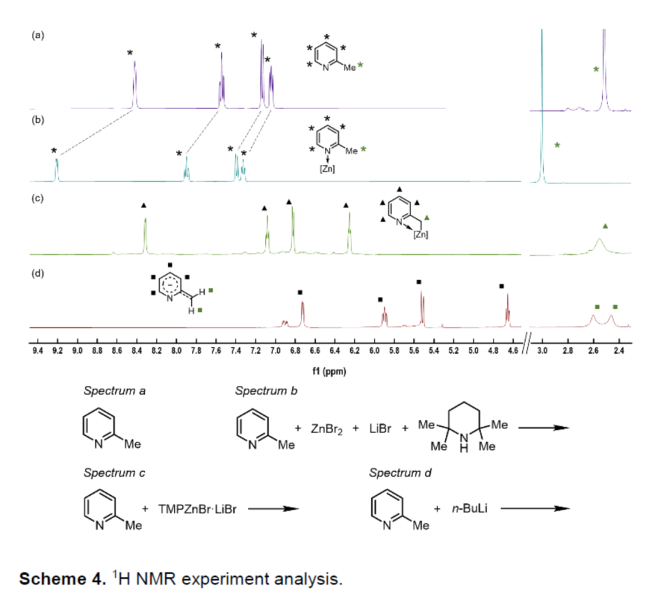
接下来,作者进一步通过一系列1H-NMR实验 (400 MHz, THF-d8, 室温),对于反应过程中所涉及的亲核中间体相关的结构特征进行深入研究 (Scheme 3-4)[8]。实验表明,TMPZnBr•LiBr在上述的反应过程中起双重作用:首先,作为碱,攫取苄基位置的质子;同时,作为Lewis酸,通过与分子中吡啶结构单元的配位,进而促进后续去质子化过程的有效进行。
总结
上海有机化学研究所的游书力团队报道一种全新的采用铱催化剂促进的通过各类甲基氮杂芳香化合物参与的不对称烯丙基取代反应方法学,进而成功完成一系列手性氮杂芳香分子的构建。这一全新的对映选择性烯丙基取代策略具有广泛的底物应用范围、良好至优良的反应收率、优良的对映选择性以及广阔的合成应用前景。
参考文献
- [1] M. W. Gribble Jr, S. Guo, S. L. Buchwald, J. Am. Chem. Soc. 2018, 140, 5057. doi: 10.1021/jacs.8b02568.
- [2] L. Yang, H. Huang, Chem. Rev. 2015, 115, 3468. doi: 10.1021/cr500610p.
- [3] D. Best, S. Kujawa, H. Lam, J. Am. Chem. Soc. 2012, 134, 18193. doi: 10.1021/ja3083494.
- [4] (a) J. Izquierdo, A. Landa, I. Bastida, R. López, M. Oiarbide, C. Palomo, J. Am. Chem. Soc. 2016, 138, 3282. doi:10.1021/jacs.5b13385.
- (b) M. Meazza, F. Tur, N. Hammer, K. A. Jøgensen, Angew. Chem. Int. Ed. 2017, 56, 1634. doi: 10.1002/anie.201611306.
- (c) P. Rai, S. Waiba, K. Maji, D. Sahoo, B. Maji, Org. Lett. 2021, 23, 8888. doi: 10.1021/acs.orglett.1c03387.
- (d) S. Xue, B. Limburg, D. Ghorai, J. Benet-Buchholz, A. W. Kleij, Org. Lett. 2021, 23, 4447. doi: 10.1021/acs.orglett.1c01380.
- (e) R. Murakami, K. Sano, T. Iwai, T. Taniguchi, K. Monde, M. Sawamura,
- Angew. Chem. Int. Ed. 2018, 57, 9465. doi: 10.1002/anie.201802821.
- [5] (a) M. Mosrin, P. Knochel, Org. Lett. 2009, 11, 1837. doi: 10.1021/ol900342a.
- (b) S. Duez, A. K. Steib, S. M. Manolikakes, P. Knochel, Angew. Chem. Int. Ed. 2011, 50, 7686. doi:10.1002/anie.201103074.
- (c) D. Haas, J. M. Hammann, R. Greiner, P. Knochel, ACS Catal. 2016, 6, 1540. doi: 10.1021/acscatal.5b02718.
- [6] (a) B. M. Trost, D. A. Thaisrivongs, J. Am. Chem. Soc. 2008, 130, 14092. doi: 10.1021/ja806781u.
- (b) J. Qu, G. Helmchen, Acc. Chem. Res. 2017, 50, 2539. doi: 10.1021/acs.accounts.7b00300.
- (c) S. L. Rössler, D. A. Petrone, E. M. Carreira, Acc. Chem. Res. 2019, 52, 2657. doi: 10.1021/acs.accounts.9b00209.
- [7] (a) R. Murakami, K. Sano, T. Iwai, T. Taniguchi, K. Monde, M. Sawamura, Angew. Chem. Int. Ed. 2018, 57, 9465. doi:10.1002/anie.201802821
- (b) P. J. Moon, Z. Wei, R. J. Lundgren, J. Am. Chem. Soc. 2018, 140, 17418. doi: 10.1021/jacs.8b11390.
- [8] (a) K. Konishi, H. Matsumoto, K. Saito, K. Takahashi, Bull. Chem. Soc. Jpn. 1985, 58, 2294. doi: 10.1246/bcsj.58.2294.
- (b) B. M. Trost, D. A. Thaisrivongs, J. Am. Chem. Soc. 2009, 131, 12056. doi: 10.1021/ja904441a.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载



















No comments yet.